Доцент Карташева Маргарита Николаевна Курс лекций. Российский Государственный
















































































































![Примеры: • Na 3 [Al(OH) 6 ] – гексагидроксоалюминат натрия • K Примеры: • Na 3 [Al(OH) 6 ] – гексагидроксоалюминат натрия • K](http://present5.com/presentbyword/20161219/l_1-4_osnovnye_opredelenia_i_klassy_ch1-1_images/l_1-4_osnovnye_opredelenia_i_klassy_ch1-1_131.jpg)





































































l_1-4_osnovnye_opredelenia_i_klassy_ch1-1.ppt
- Размер: 882.0 Кб
- Автор:
- Количество слайдов: 225
Описание презентации Доцент Карташева Маргарита Николаевна Курс лекций. Российский Государственный по слайдам
 Доцент Карташева Маргарита Николаевна Курс лекций. Российский Государственный Университет нефти и газа им. И. М. Губкина КАФЕДРА ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Доцент Карташева Маргарита Николаевна Курс лекций. Российский Государственный Университет нефти и газа им. И. М. Губкина КАФЕДРА ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
 Адрес в интернет Vanyo. ru/margo
Адрес в интернет Vanyo. ru/margo

 Введение 1 • Как только человек рождается на свет он попадает в мир химических веществ и превращений. Вдыхает воздух, а воздух это смесь газов (кислород, азот идр. ) выдыхает углекислый газ. А из чего состоит наша одежда, что собой представляют волокна из которых она изготовлена: основа х/б ткани природное вещество целлюлоза или клетчатка (орг происх)
Введение 1 • Как только человек рождается на свет он попадает в мир химических веществ и превращений. Вдыхает воздух, а воздух это смесь газов (кислород, азот идр. ) выдыхает углекислый газ. А из чего состоит наша одежда, что собой представляют волокна из которых она изготовлена: основа х/б ткани природное вещество целлюлоза или клетчатка (орг происх)
 Введение 2 • Шерсть – белковая основа. Молоко – смесь воды и мельчайших капелек молочного жира, а еще молочный белок казеин, минеральные соли, молочный сахар лактоза все эти вещества имеют естественное происхождение. Стеклянная посуда – основа оксид кремния + разл. добавки, шины автомобилей. , соски на детские бутылочки и др. – резина. Это тоже вещества но искусственного происхождения. , а точнее материалы, т. к. представляют собой смеси веществ. Сами мы представляем сложную химическую систему из отдельных элементов, простых и сложных веществ. Любая наша реакция на внешний раздражитель носит химическую природу.
Введение 2 • Шерсть – белковая основа. Молоко – смесь воды и мельчайших капелек молочного жира, а еще молочный белок казеин, минеральные соли, молочный сахар лактоза все эти вещества имеют естественное происхождение. Стеклянная посуда – основа оксид кремния + разл. добавки, шины автомобилей. , соски на детские бутылочки и др. – резина. Это тоже вещества но искусственного происхождения. , а точнее материалы, т. к. представляют собой смеси веществ. Сами мы представляем сложную химическую систему из отдельных элементов, простых и сложных веществ. Любая наша реакция на внешний раздражитель носит химическую природу.
 Введение 3 • А с чего же все начиналось? Из чего состоят химические элементы и вещества? Повторим некоторые исторические факты. • Как самостоятельная наука химия появилась лишь в 19 вв. А каковы предпосылки. Период древней Греции – одна наука философия.
Введение 3 • А с чего же все начиналось? Из чего состоят химические элементы и вещества? Повторим некоторые исторические факты. • Как самостоятельная наука химия появилась лишь в 19 вв. А каковы предпосылки. Период древней Греции – одна наука философия.
 Древняя Греция. Одна наука – философия. Представители Левкипп (500 -400 лет до н. э. ) – все вещества состоят из мельчайших неделимых частиц атомов и пустоты. Демокрит (460 -370 лет до н. э. ) – атомы абсолютно твердые частицы, бескачественные непроницаемые, неделимые, одинаковые по своей природе, различаются лишь формой, величиной, положением в пространстве. Могут двигаться. Природа движения механическая. Атомы и движение вечны.
Древняя Греция. Одна наука – философия. Представители Левкипп (500 -400 лет до н. э. ) – все вещества состоят из мельчайших неделимых частиц атомов и пустоты. Демокрит (460 -370 лет до н. э. ) – атомы абсолютно твердые частицы, бескачественные непроницаемые, неделимые, одинаковые по своей природе, различаются лишь формой, величиной, положением в пространстве. Могут двигаться. Природа движения механическая. Атомы и движение вечны.
 Эпикур (342 -270 лет до н. э. ) Предполагал, что движение атомов определяется внутренним свойством атомов – тяжестью. Тяжесть – это внутреннее свойство каждого атома. Все тела возникают в результате соединения и разъединения атомов естественным путем вследствии их закономерного движения. Без движения и перемещения невозможно образование материального мира.
Эпикур (342 -270 лет до н. э. ) Предполагал, что движение атомов определяется внутренним свойством атомов – тяжестью. Тяжесть – это внутреннее свойство каждого атома. Все тела возникают в результате соединения и разъединения атомов естественным путем вследствии их закономерного движения. Без движения и перемещения невозможно образование материального мира.
 Эпоха Возрождения Галилео Галилей (1564 -1642) – весь мир образован из атомов – кирпичиков мироздания. Атомами исчерпываются все изменения в мире и все наше познание. Пьер Гассенди (1592 -1655) – ввел учение о молекуле. Первичные источники всех тел сростки атомов – молекулы. Роберт Бойль (1627 -1691). Внес понятие о химическом элементе. Химический элемент – это нечто материальное и не разлагающееся на части. Важнейшая заслуга –превращение химии в отрасль естествознания.
Эпоха Возрождения Галилео Галилей (1564 -1642) – весь мир образован из атомов – кирпичиков мироздания. Атомами исчерпываются все изменения в мире и все наше познание. Пьер Гассенди (1592 -1655) – ввел учение о молекуле. Первичные источники всех тел сростки атомов – молекулы. Роберт Бойль (1627 -1691). Внес понятие о химическом элементе. Химический элемент – это нечто материальное и не разлагающееся на части. Важнейшая заслуга –превращение химии в отрасль естествознания.
 Основные этапы развития химии • До нашей эры • Крашение • Брожение • получение металлов • Греческая натурфилософия: идеи атомистики
Основные этапы развития химии • До нашей эры • Крашение • Брожение • получение металлов • Греческая натурфилософия: идеи атомистики
 Алхимия ( III IV ‑ вв. н. э. ) • Попытки получения драгоценных металлов из недрагоценных • Поиск философского камня • Создание лабораторий, проведение экспериментов
Алхимия ( III IV ‑ вв. н. э. ) • Попытки получения драгоценных металлов из недрагоценных • Поиск философского камня • Создание лабораторий, проведение экспериментов
 Возрождени е • Применение химических знаний на практике: медицина, металлургия, получение стекла • Р. Бойль дает определение химического элемента
Возрождени е • Применение химических знаний на практике: медицина, металлургия, получение стекла • Р. Бойль дает определение химического элемента
 XVIII – XIX вв • Превращение химии в науку • Закон сохранения массы (Ломоносов и Лавуазье) • Понятие молекулы (Дж. Дальтон)
XVIII – XIX вв • Превращение химии в науку • Закон сохранения массы (Ломоносов и Лавуазье) • Понятие молекулы (Дж. Дальтон)
 Атомно-молекулярное учение. Основные положения • Основой современного естествознания является атомно-молекулярное учение, которое получило начало своего развития вместе с химической наукой в 18 -19 веке. А последующее развитие науки, расширившие наши представления о строение вещества, в целом подтвердило правильность атомно-молекулярного учения.
Атомно-молекулярное учение. Основные положения • Основой современного естествознания является атомно-молекулярное учение, которое получило начало своего развития вместе с химической наукой в 18 -19 веке. А последующее развитие науки, расширившие наши представления о строение вещества, в целом подтвердило правильность атомно-молекулярного учения.
 Основные положения атомно-молеклярного учения • (разработаны М. В. Ломоносовым впоследствии дополнены и доработаны): • 1) все вещества состоят из молекул, атомов или ионов • 2) Атомы и молекулы находятся в непрерывном движении, с увеличением температуры скорость их движения возрастает;
Основные положения атомно-молеклярного учения • (разработаны М. В. Ломоносовым впоследствии дополнены и доработаны): • 1) все вещества состоят из молекул, атомов или ионов • 2) Атомы и молекулы находятся в непрерывном движении, с увеличением температуры скорость их движения возрастает;
 продолжение • 3) Атомы и молекулы имеют массу и размеры; • 4) Между молекулами действуют как силы притяжения, так и силы отталкивания; • 5) Простые вещества состоят из одинаковых атомов, а сложные из разных.
продолжение • 3) Атомы и молекулы имеют массу и размеры; • 4) Между молекулами действуют как силы притяжения, так и силы отталкивания; • 5) Простые вещества состоят из одинаковых атомов, а сложные из разных.
 • Впервые определение химии дано М. В. Ломоносовым – • химия наука об изменениях, происходящих в смешанном теле. • Химические факты объединены математическим способом изложения и приведены в систему на основе представлений о строении вещества.
• Впервые определение химии дано М. В. Ломоносовым – • химия наука об изменениях, происходящих в смешанном теле. • Химические факты объединены математическим способом изложения и приведены в систему на основе представлений о строении вещества.
 Определение Менделеева • Самое краткое определение химии дал великий русский ученый Д. И. Менделеев: • химия – это учение об элементах и их соединениях.
Определение Менделеева • Самое краткое определение химии дал великий русский ученый Д. И. Менделеев: • химия – это учение об элементах и их соединениях.
 Современное определение • Химия – естественная наука, изучающая состав, свойства и химические превращения веществ, явления которые сопровождают эти превращения, а также рассматривает вопросы использования результатов этих превращений.
Современное определение • Химия – естественная наука, изучающая состав, свойства и химические превращения веществ, явления которые сопровождают эти превращения, а также рассматривает вопросы использования результатов этих превращений.
 это все, что окружает нас, бесконечное множество всех существующих в мире объектов
это все, что окружает нас, бесконечное множество всех существующих в мире объектов
 Объекты изучения в химии • Атомы • Молекулы • Вещества • Свойства веществ • Явления
Объекты изучения в химии • Атомы • Молекулы • Вещества • Свойства веществ • Явления
 Молекула – наименьшая частица вещества, обладающая всеми его химическими свойствами.
Молекула – наименьшая частица вещества, обладающая всеми его химическими свойствами.
 Атом – • наименьшая химически неделимая частица элемента • Атом наименьшая электронейтральная частица химического элемента, обладающая его химическими свойствами.
Атом – • наименьшая химически неделимая частица элемента • Атом наименьшая электронейтральная частица химического элемента, обладающая его химическими свойствами.
 Атом — продолжение • Каждый отдельный атом характеризуется определенным размером и массой. • Атом химически неделимая частица. • Атомы могут соединяться между собой, образуя молекулы- частицы состоящие из различного числа атомов.
Атом — продолжение • Каждый отдельный атом характеризуется определенным размером и массой. • Атом химически неделимая частица. • Атомы могут соединяться между собой, образуя молекулы- частицы состоящие из различного числа атомов.
 Химический элемент – • вид атомов с определенным зарядом ядра. • Символы х. э. приводятся в периодической системе Д. И. Менделеева
Химический элемент – • вид атомов с определенным зарядом ядра. • Символы х. э. приводятся в периодической системе Д. И. Менделеева
 Ион • — атом или группа атомов, имеющих электрический заряд. • Все вышеупомянутые частицы имеют определенные свойства.
Ион • — атом или группа атомов, имеющих электрический заряд. • Все вышеупомянутые частицы имеют определенные свойства.
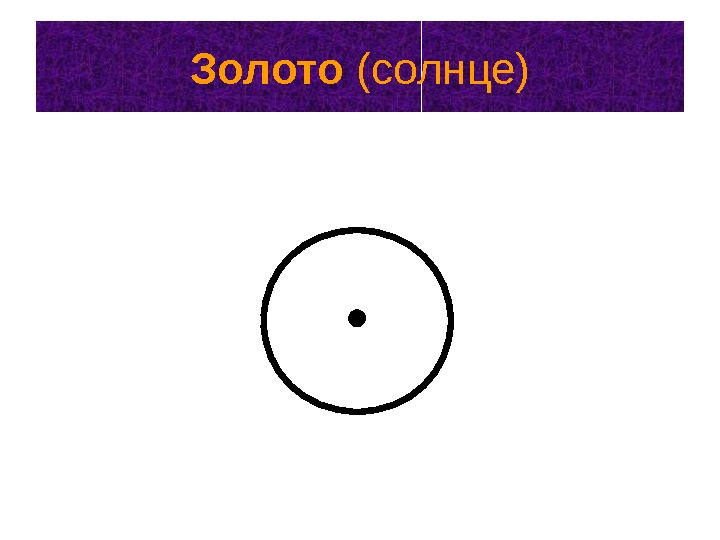
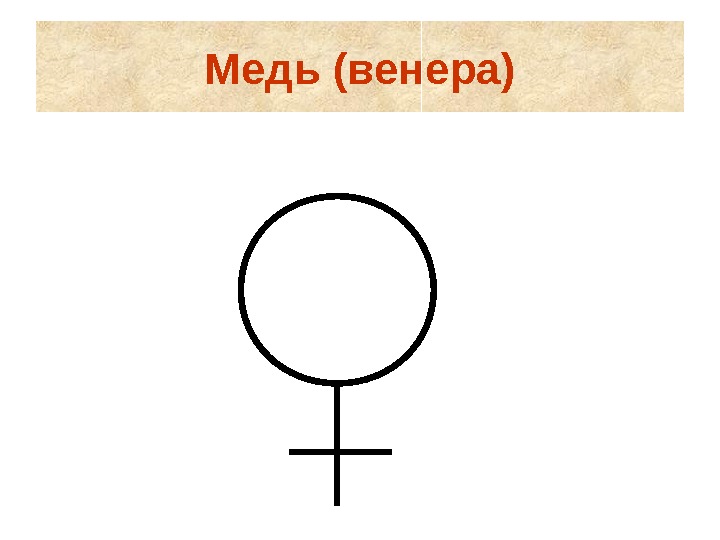
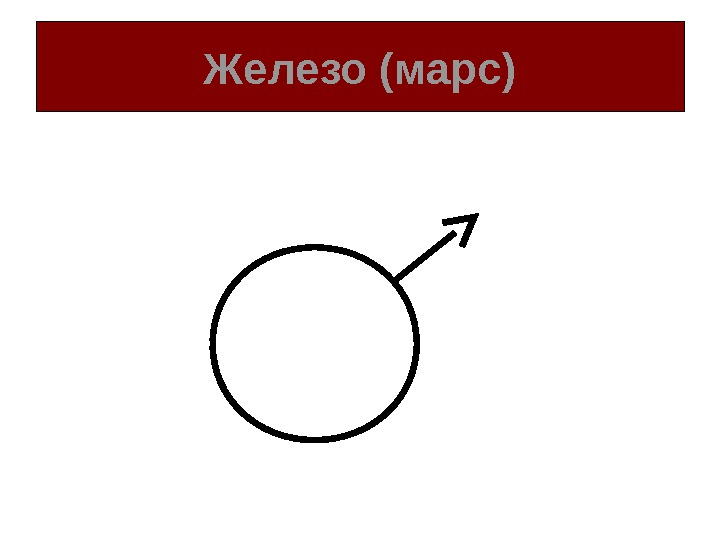
 Обозначение химических элементов • Алхимики считали, что химические элементы связаны со звездами и планетами. • Элементам присваивали астрологические символы.
Обозначение химических элементов • Алхимики считали, что химические элементы связаны со звездами и планетами. • Элементам присваивали астрологические символы.
 Золото (солнце)
Золото (солнце)
 Медь (венера)
Медь (венера)
 Железо (марс)
Железо (марс)
 Джон Дальтон 1766 – 1844 Английский химик и физик Предложил систему обозначений для различных атомов элементов с помощью геометрических фигур Водород Кислород
Джон Дальтон 1766 – 1844 Английский химик и физик Предложил систему обозначений для различных атомов элементов с помощью геометрических фигур Водород Кислород
 Современные обозначение и название некоторых химических элементов.
Современные обозначение и название некоторых химических элементов.
 Первые обозначения атомов химических элементов • предложены шведским химиком Йенсом Якобом Берцелиусом в 1814 г. • Как правило обозначаются первой буквой (или первой и следующей) латинского названия элемента
Первые обозначения атомов химических элементов • предложены шведским химиком Йенсом Якобом Берцелиусом в 1814 г. • Как правило обозначаются первой буквой (или первой и следующей) латинского названия элемента
 Н – гидрогениум- водород – рождающий воду С – карбонеум – углерод О – оксигениум – кислород – рождающий кислоты.
Н – гидрогениум- водород – рождающий воду С – карбонеум – углерод О – оксигениум – кислород – рождающий кислоты.
 Некоторые названия обязаны цвету простых веществ • S – сера — от индийского «сира» — светложелтый. • Cl – хлор – от греческого «хлорос» -зеленый • I – йод – от греческого «иодос» -фиолетовый
Некоторые названия обязаны цвету простых веществ • S – сера — от индийского «сира» — светложелтый. • Cl – хлор – от греческого «хлорос» -зеленый • I – йод – от греческого «иодос» -фиолетовый
 От названия минералов, содержащих элемент • Si – кремний от кремня • Ве – берилий от берилла (изумруд)
От названия минералов, содержащих элемент • Si – кремний от кремня • Ве – берилий от берилла (изумруд)
 От географических названий • Na – натрий – по названию соленого озера Натрум в Африке • Cu – медь – купрум (лат. ) – по названию о. Кипр, где большие месторождения меди.
От географических названий • Na – натрий – по названию соленого озера Натрум в Африке • Cu – медь – купрум (лат. ) – по названию о. Кипр, где большие месторождения меди.
 Степень окисления элемента • Степень окисления (с. о. ) – условный заряд атома элемента в соединении, вычисленный исходя из предположения, что данное соединение состоит только из заряженных частиц – одноатомных ионов.
Степень окисления элемента • Степень окисления (с. о. ) – условный заряд атома элемента в соединении, вычисленный исходя из предположения, что данное соединение состоит только из заряженных частиц – одноатомных ионов.
 продолжение • Степень окисления может быть нулевой, положительной и отрицательной. • Степень окисления атомов в простых веществах всегда равна 0. • Обозначение С 0 , О
продолжение • Степень окисления может быть нулевой, положительной и отрицательной. • Степень окисления атомов в простых веществах всегда равна 0. • Обозначение С 0 , О
 Степень окисления атомов элементов в сложных веществах • может быть постоянной и переменной. • Постоянная степень окисления атомов элементов • Катионы: Li + ; Na + ; K + ; Rb + ; Cs + ; Ag + ; Be 2+ ; Mg 2+ ; Ca 2+ ; Sr 2+ ; Ba 2+ ; Zn 2+ ; Cd 2+ ; Al 3+ • Анионы: F — ; S 2 —
Степень окисления атомов элементов в сложных веществах • может быть постоянной и переменной. • Постоянная степень окисления атомов элементов • Катионы: Li + ; Na + ; K + ; Rb + ; Cs + ; Ag + ; Be 2+ ; Mg 2+ ; Ca 2+ ; Sr 2+ ; Ba 2+ ; Zn 2+ ; Cd 2+ ; Al 3+ • Анионы: F — ; S 2 —
 Валентность • Способность атома элемента образовывать химические связи. • Численно равна количеству связей, которые образует данный атом с другими атомами. • Не имеет знака, обозначается римскими цифрами. • Часто численно совпадает со степенью окисления (но не всегда)
Валентность • Способность атома элемента образовывать химические связи. • Численно равна количеству связей, которые образует данный атом с другими атомами. • Не имеет знака, обозначается римскими цифрами. • Часто численно совпадает со степенью окисления (но не всегда)
 Определение степени окисления 1) С. О. водорода принята равной +1 исключения соединения металлов с водородом – гидриды. Са +2 Н 2 -1 ; Al +3 H 3 -1 2)С. О. кислорода принята равной -2 исключения Н 2 +1 О 2 -1 – перекись водорода O +2 F 2 -1 – фторид кислорода
Определение степени окисления 1) С. О. водорода принята равной +1 исключения соединения металлов с водородом – гидриды. Са +2 Н 2 -1 ; Al +3 H 3 -1 2)С. О. кислорода принята равной -2 исключения Н 2 +1 О 2 -1 – перекись водорода O +2 F 2 -1 – фторид кислорода
 3) Молекула вещества электронейтральна. Поэтому алгебраическая сумма зарядов равна 0. ИЛИ Количество положительных зарядов = количеству отрицательных зарядов
3) Молекула вещества электронейтральна. Поэтому алгебраическая сумма зарядов равна 0. ИЛИ Количество положительных зарядов = количеству отрицательных зарядов
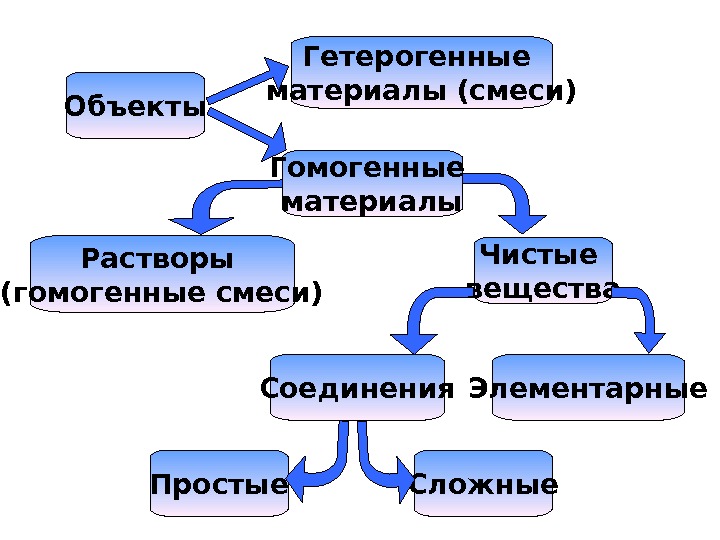
 Объекты Гетерогенные материалы (смеси) Растворы (гомогенные смеси) Чистые вещества Соединения Элементарные Простые Сложные. Гомогенные материалы
Объекты Гетерогенные материалы (смеси) Растворы (гомогенные смеси) Чистые вещества Соединения Элементарные Простые Сложные. Гомогенные материалы
 Смеси • системы, состоящие из нескольких веществ, сохраняющих свои индивидуальные свойства причем каждое из веществ может быть выделены в чистом виде.
Смеси • системы, состоящие из нескольких веществ, сохраняющих свои индивидуальные свойства причем каждое из веществ может быть выделены в чистом виде.
 2 HCl H 2 +Cl
2 HCl H 2 +Cl
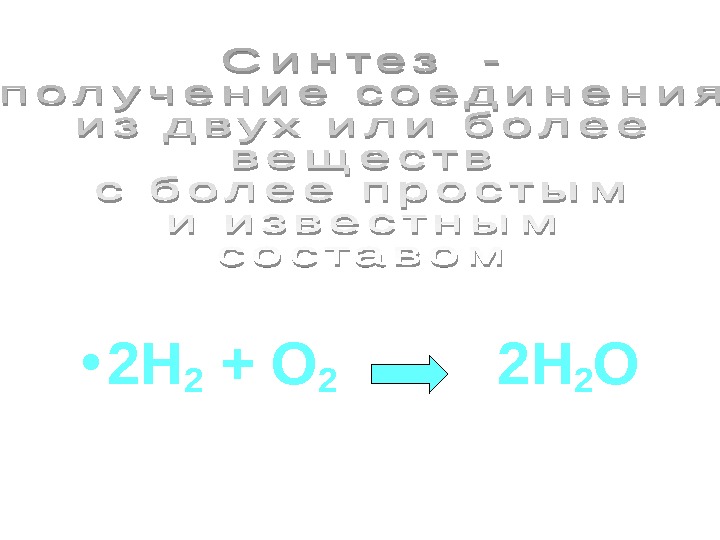
 • 2 H 2 + O 2 2 H 2 O
• 2 H 2 + O 2 2 H 2 O
 Свойства гомогенного материала во всех частях одинаковы
Свойства гомогенного материала во всех частях одинаковы
 Вещество • Вещество – чистая материя без примесей. • Состоит из молекул. • Имеет постоянные физические характеристики температуру кипения, плавления, кристаллизации.
Вещество • Вещество – чистая материя без примесей. • Состоит из молекул. • Имеет постоянные физические характеристики температуру кипения, плавления, кристаллизации.
 Второе определение Вещество – форма материи, состоящая из частиц, обладающих массой покоя.
Второе определение Вещество – форма материи, состоящая из частиц, обладающих массой покоя.
 Молекула — продолжение Все молекулы одного индивидуального вещества одинаковы, но отличаются от молекул другого индивидуального вещества составом и строением
Молекула — продолжение Все молекулы одного индивидуального вещества одинаковы, но отличаются от молекул другого индивидуального вещества составом и строением
 Соединение — вещество, которое состоит из нескольких атомов.
Соединение — вещество, которое состоит из нескольких атомов.
 Материал • вещество того же наименования, полученное в реальных условиях, т. е. содержащее неизбежные примеси.
Материал • вещество того же наименования, полученное в реальных условиях, т. е. содержащее неизбежные примеси.
 Гетерогенный материал состоит из частей с различными свойствами. Гетерогенные материалы представляют собой смесь двух или более гомогенных материалов.
Гетерогенный материал состоит из частей с различными свойствами. Гетерогенные материалы представляют собой смесь двух или более гомогенных материалов.
 Гомогенный материал – материал свойства которого во всех частях одинаковы
Гомогенный материал – материал свойства которого во всех частях одинаковы
 Чистое вещество – это в химическом смысле гомогенный материал, имеющий определенный химический состав.
Чистое вещество – это в химическом смысле гомогенный материал, имеющий определенный химический состав.
 Элементарное вещество — вещество, которое нельзя разложить химически. Это достаточно условно, так как при облучении можно разложить и элементарное вещество.
Элементарное вещество — вещество, которое нельзя разложить химически. Это достаточно условно, так как при облучении можно разложить и элементарное вещество.
 Химическая формула • – условное обозначение химического элемента или вещества с помощью символов химических элементов и числовых индексов.
Химическая формула • – условное обозначение химического элемента или вещества с помощью символов химических элементов и числовых индексов.
 продолжение • Химическая формула показывает качественный и количественный состав вещества.
продолжение • Химическая формула показывает качественный и количественный состав вещества.
 Примеры чтения некоторых формул • Al 2 O 3 – алюминий-два-о-три, • Ca ( OH ) 2 – кальций-о-аш- дважды, • H 3 As. O 4 – аш-три арсеникум-о-четыре, • Cr 2 ( SO 4 )3 – хром-два-эс-о-четыре.
Примеры чтения некоторых формул • Al 2 O 3 – алюминий-два-о-три, • Ca ( OH ) 2 – кальций-о-аш- дважды, • H 3 As. O 4 – аш-три арсеникум-о-четыре, • Cr 2 ( SO 4 )3 – хром-два-эс-о-четыре.
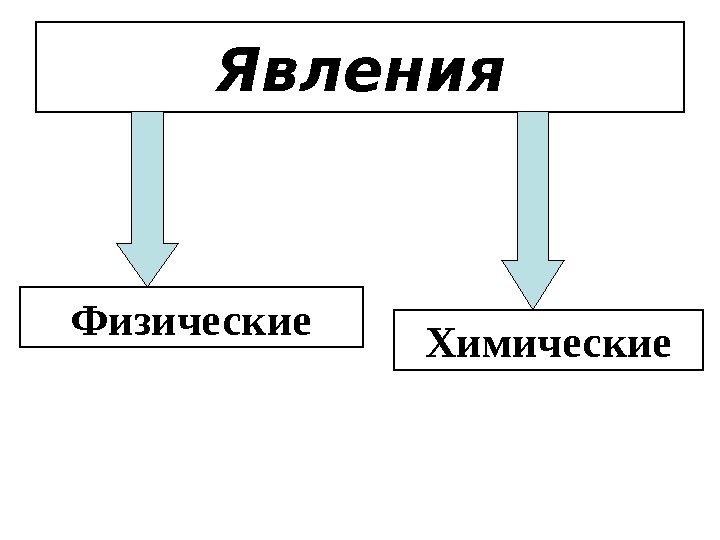
 Явления — изменения, происходящие в окружающем мире.
Явления — изменения, происходящие в окружающем мире.
 Явления Физические Химические
Явления Физические Химические
 Физические явления – явления при которых не происходит образования новых веществ. При этом внутреннее строение, состав и свойства не изменяются. Вода лед – жидкость — пар. Деформация металла. Измельчение.
Физические явления – явления при которых не происходит образования новых веществ. При этом внутреннее строение, состав и свойства не изменяются. Вода лед – жидкость — пар. Деформация металла. Измельчение.
 Химические явления — явления при которых происходит образование новых веществ. Такие явления называются химическими реакциями
Химические явления — явления при которых происходит образование новых веществ. Такие явления называются химическими реакциями
 • Многие физические явления сопровождаются химическими и наоборот. Например, в результате химической реакции горения угля выделяется тепло и свет (переход химической формы материи в тепловую); воспламенение от сжатия в дизельном двигателе.
• Многие физические явления сопровождаются химическими и наоборот. Например, в результате химической реакции горения угля выделяется тепло и свет (переход химической формы материи в тепловую); воспламенение от сжатия в дизельном двигателе.
 Химические явления (химическая реакция) – результат взаимодействия не менее 2 -х исходных веществ, при котором образуются одно или несколько других, отличающихся от первоначальных составом, структурой и свойствами.
Химические явления (химическая реакция) – результат взаимодействия не менее 2 -х исходных веществ, при котором образуются одно или несколько других, отличающихся от первоначальных составом, структурой и свойствами.
 Химическое уравнение • Условная запись, отражающая суть химического превращения или явления. • В уравнении химической реакции слева (до знака равенства) записывают формулы исходных веществ (реагенты) , • справа (после знака равенства) записывают формулы полученных веществ (продукты).
Химическое уравнение • Условная запись, отражающая суть химического превращения или явления. • В уравнении химической реакции слева (до знака равенства) записывают формулы исходных веществ (реагенты) , • справа (после знака равенства) записывают формулы полученных веществ (продукты).
 Типы химических реакций • Реакции протекающие с изменением степени окисления элементов в реагирующих веществах(см. лекцию ОВР) • Реакции, протекающие без изменения степени окисления элементов в реагирующих веществах.
Типы химических реакций • Реакции протекающие с изменением степени окисления элементов в реагирующих веществах(см. лекцию ОВР) • Реакции, протекающие без изменения степени окисления элементов в реагирующих веществах.
 Реакции соединения – реакции в результате которых из 2 -х и более веществ образуется одно • 2 Mg + O 2 2 Mg. O • Ca. O + CO 2 Ca. CO
Реакции соединения – реакции в результате которых из 2 -х и более веществ образуется одно • 2 Mg + O 2 2 Mg. O • Ca. O + CO 2 Ca. CO
 Реакции разложения – реакции в результате которых из одного вещества образуются два и более веществ • ( NH 4 ) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O • Cu ( OH ) 2 Cu. O + H 2 O • Условия: нагревание, тепловой или световой импульс, реже самопроизвольно
Реакции разложения – реакции в результате которых из одного вещества образуются два и более веществ • ( NH 4 ) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O • Cu ( OH ) 2 Cu. O + H 2 O • Условия: нагревание, тепловой или световой импульс, реже самопроизвольно
 Реакции замещения – р еакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе (всегда ОВР) • Zn + 2 HCl Zn. Cl 2 + H 2 • 2 Al + 3 Cu. SO 4 Al 2 (SO 4 )3 + 3 Cu
Реакции замещения – р еакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе (всегда ОВР) • Zn + 2 HCl Zn. Cl 2 + H 2 • 2 Al + 3 Cu. SO 4 Al 2 (SO 4 )3 + 3 Cu
 Реакции обмена – реакции в результате которых молекулы 2 -х соединений обмениваются своими составными частями (без изменения с. о. ) • Cu. SO 4 + 2 Na. OH Cu ( OH )2 + Na 2 SO 4 Эти реакции протекают необратимо если: • Образуется осадок • Выделяется газ • Образуется слабый электролит (вода и др. )
Реакции обмена – реакции в результате которых молекулы 2 -х соединений обмениваются своими составными частями (без изменения с. о. ) • Cu. SO 4 + 2 Na. OH Cu ( OH )2 + Na 2 SO 4 Эти реакции протекают необратимо если: • Образуется осадок • Выделяется газ • Образуется слабый электролит (вода и др. )
 По тепловому эффекту • Экзотермические — протекают с выделением тепла Ca ( OH ) 2 +2 HCl Ca. Cl 2 +2 H 2 O + Q • Эндотермические — протекают с поглощением тепла Ca. CO 3 Ca. O + CO 2 – Q
По тепловому эффекту • Экзотермические — протекают с выделением тепла Ca ( OH ) 2 +2 HCl Ca. Cl 2 +2 H 2 O + Q • Эндотермические — протекают с поглощением тепла Ca. CO 3 Ca. O + CO 2 – Q
 Необратимые реакции – реакции, которые при данных условиях протекают практически только в одном направлении. • Обратимые реакции – реакции, которые при данных условиях протекает впрямом и обратном направлениях 2 NO N 2 O
Необратимые реакции – реакции, которые при данных условиях протекают практически только в одном направлении. • Обратимые реакции – реакции, которые при данных условиях протекает впрямом и обратном направлениях 2 NO N 2 O
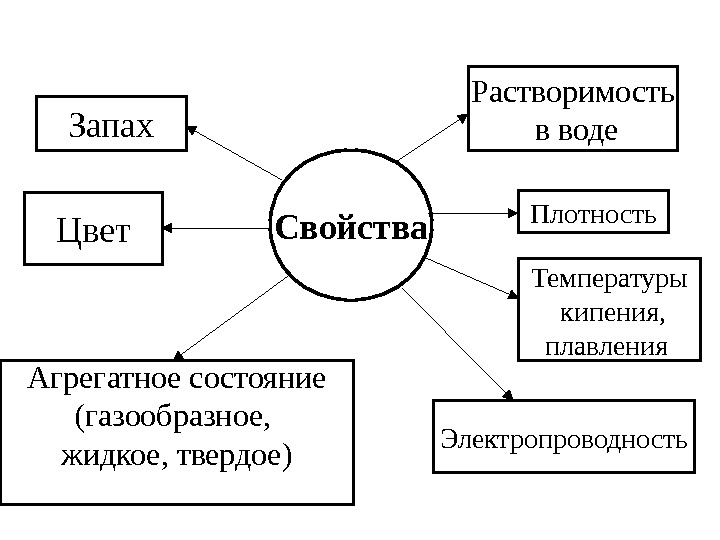
 Свойство • качественная и количественная характеристика физического тела или явления.
Свойство • качественная и количественная характеристика физического тела или явления.
 Свойства Растворимость в воде Плотность Температуры кипения, плавления Электропроводность. Запах Цвет Агрегатное состояние (газообразное, жидкое, твердое)
Свойства Растворимость в воде Плотность Температуры кипения, плавления Электропроводность. Запах Цвет Агрегатное состояние (газообразное, жидкое, твердое)
 Классификация веществ • По происхождению • Натуральные – природного происхождения (алмаз) • Искусственно полученные (фианит)
Классификация веществ • По происхождению • Натуральные – природного происхождения (алмаз) • Искусственно полученные (фианит)
 По агрегатному состоянию • Твердые • Жидкие • Газообразные
По агрегатному состоянию • Твердые • Жидкие • Газообразные
 По внутреннему строению • Аморфные – не имеют четкой кристаллической структуры (графит, стекло, янтарь) • Кристаллические – имеют плоские грани и специфическую внутреннюю структуру (алмаз, горный хрусталь, хлорид натрия)
По внутреннему строению • Аморфные – не имеют четкой кристаллической структуры (графит, стекло, янтарь) • Кристаллические – имеют плоские грани и специфическую внутреннюю структуру (алмаз, горный хрусталь, хлорид натрия)
 По составу • ПРОСТЫЕ – вещества, состоящие из атомов одного элемента
По составу • ПРОСТЫЕ – вещества, состоящие из атомов одного элемента
 Аллотропия – это способность химических элементов существовать в виде нескольких простых веществ. Примеры : кислород — О 2 , озон — О 3 фосфор (Р) – белый, красный, черный углерод (С) – алмаз, графит, карбин, фулерены С 60 , С
Аллотропия – это способность химических элементов существовать в виде нескольких простых веществ. Примеры : кислород — О 2 , озон — О 3 фосфор (Р) – белый, красный, черный углерод (С) – алмаз, графит, карбин, фулерены С 60 , С
 Многоатомные • Вещества, состоящие из 2 -х и более атомов одного и того же элемента • Двухатомные Н 2 , N 2 , О 2 , F 2 , Cl 2 , Br 2 , I 2 • Трехатомные О 3 –озон.
Многоатомные • Вещества, состоящие из 2 -х и более атомов одного и того же элемента • Двухатомные Н 2 , N 2 , О 2 , F 2 , Cl 2 , Br 2 , I 2 • Трехатомные О 3 –озон.
 Одноатомные • Вещества, состоящие из одного атома элемента • все остальные: • С, Са, Не и т. д.
Одноатомные • Вещества, состоящие из одного атома элемента • все остальные: • С, Са, Не и т. д.
 СЛОЖНЫЕ • Вещества, состоящие из атомов различных элементов • Оксиды, кислоты, основания, соли: Са. О, Н 3 РО 4 , Са(ОН) 2 , Na. Cl
СЛОЖНЫЕ • Вещества, состоящие из атомов различных элементов • Оксиды, кислоты, основания, соли: Са. О, Н 3 РО 4 , Са(ОН) 2 , Na. Cl
 Классы неорганических соединений Ч 1.
Классы неорганических соединений Ч 1.
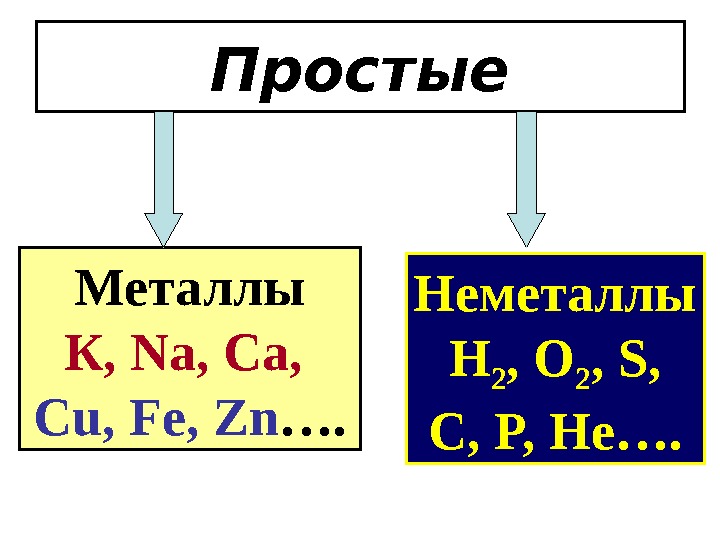
 Общая классификация неорганических веществ Неорганические вещества Простые Сложные
Общая классификация неорганических веществ Неорганические вещества Простые Сложные
 Простые Металлы К , Na, Ca, Cu, Fe, Zn …. Неметаллы H 2 , O 2 , S, C, P, He ….
Простые Металлы К , Na, Ca, Cu, Fe, Zn …. Неметаллы H 2 , O 2 , S, C, P, He ….
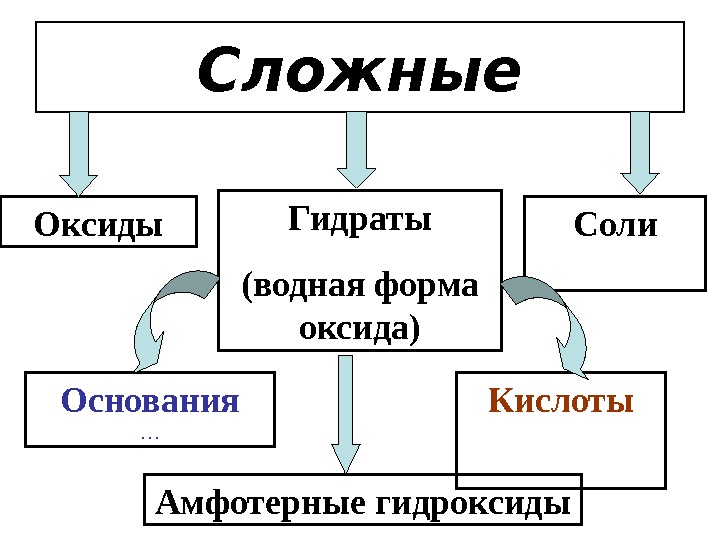
 Сложные Оксиды Основания … Кислоты C оли. Гидраты (водная форма оксида) Амфотерные гидроксиды
Сложные Оксиды Основания … Кислоты C оли. Гидраты (водная форма оксида) Амфотерные гидроксиды
 Исключением является основание NH 4 OH ( гидроксид аммония), которое не содержит атомов металла)Основания – сложные вещества, в состав которых входят катионы металла и анионы гидроксогруппы OH —
Исключением является основание NH 4 OH ( гидроксид аммония), которое не содержит атомов металла)Основания – сложные вещества, в состав которых входят катионы металла и анионы гидроксогруппы OH —
 Общая формула • Me +n (OH) n -1 • Me – металл • n – степень окисления металла
Общая формула • Me +n (OH) n -1 • Me – металл • n – степень окисления металла
 Номенклатура оснований Название оснований составляют из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия; Mg(OH) 2 — гидроксид магния; Ca(OH) 2 — гидроксид кальция; Al(OH) 3 — гидроксид алюминия.
Номенклатура оснований Название оснований составляют из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия; Mg(OH) 2 — гидроксид магния; Ca(OH) 2 — гидроксид кальция; Al(OH) 3 — гидроксид алюминия.
 Пример Если металл образует несколько оснований, то после названия металла в скобках римской цифрой указывается степень его окисления: Fe(OH) 2 – гидроксид железа ( II); Fe(OH) 3 – гидроксид железа ( III); Cr(OH) 2 – гидроксид хрома ( II); Cr(OH) 3 – гидроксид хрома ( III).
Пример Если металл образует несколько оснований, то после названия металла в скобках римской цифрой указывается степень его окисления: Fe(OH) 2 – гидроксид железа ( II); Fe(OH) 3 – гидроксид железа ( III); Cr(OH) 2 – гидроксид хрома ( II); Cr(OH) 3 – гидроксид хрома ( III).
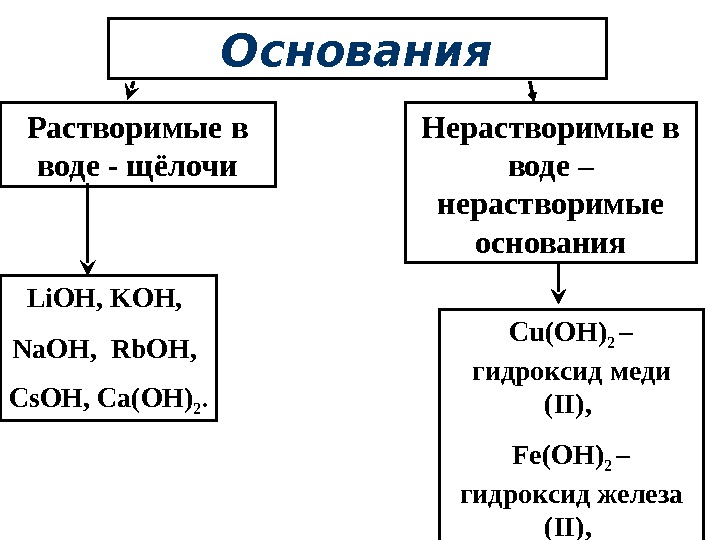
 Основания Растворимые в воде — щёлочи Нерастворимые в воде – нерастворимые основания Li. OH, KOH, Na. OH, Rb. OH, Cs. OH, Ca(OH) 2. Cu(OH) 2 – гидроксид меди ( II ) , Fe(OH) 2 – гидроксид железа ( II ) ,
Основания Растворимые в воде — щёлочи Нерастворимые в воде – нерастворимые основания Li. OH, KOH, Na. OH, Rb. OH, Cs. OH, Ca(OH) 2. Cu(OH) 2 – гидроксид меди ( II ) , Fe(OH) 2 – гидроксид железа ( II ) ,
 Кислоты. Определение Кислоты — это сложные вещества, в состав которых входят ионы водорода Н + , способные замещаться на металл, и кислотный остаток
Кислоты. Определение Кислоты — это сложные вещества, в состав которых входят ионы водорода Н + , способные замещаться на металл, и кислотный остаток
 Общая формула кислот • Н n + Х -n – • Х — кислотный остаток • n – заряд кислотного остатка
Общая формула кислот • Н n + Х -n – • Х — кислотный остаток • n – заряд кислотного остатка
 Классификация кислот. По наличию атомов кислорода в составе молекулы : • Бескислородные • Кислородосодержащие (оксокислоты) – гидраты кислотных оксидов (ангидридов)
Классификация кислот. По наличию атомов кислорода в составе молекулы : • Бескислородные • Кислородосодержащие (оксокислоты) – гидраты кислотных оксидов (ангидридов)
 По числу атомов водорода в кислоте , способных замещаться на металл различают кислоты • одноосновные • многоосновные.
По числу атомов водорода в кислоте , способных замещаться на металл различают кислоты • одноосновные • многоосновные.
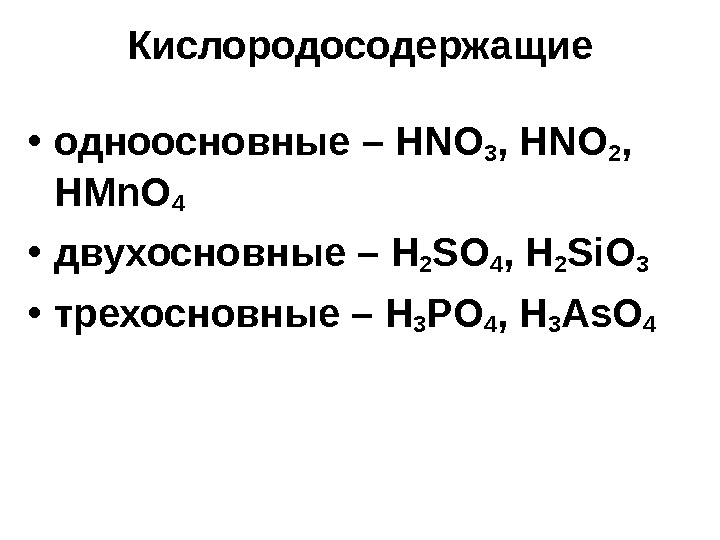
 Кислородосодержащие • одноосновные – HNO 3 , HNO 2 , HMn. O 4 • двухосновные – H 2 SO 4 , H 2 Si. O 3 • трехосновные – H 3 PO 4 , H 3 As. O
Кислородосодержащие • одноосновные – HNO 3 , HNO 2 , HMn. O 4 • двухосновные – H 2 SO 4 , H 2 Si. O 3 • трехосновные – H 3 PO 4 , H 3 As. O
 Бески c лородные • одноосновные HF, HCl, HBr, HI • двухосновные H 2 S, H 2 Se, H 2 Te,
Бески c лородные • одноосновные HF, HCl, HBr, HI • двухосновные H 2 S, H 2 Se, H 2 Te,
 Номенклатура Бески c лородные кислоты – название неметалла + «О» +слово водородная. Примеры: HCl -хлороводородная ; HF — фтороводородная ; H 2 Se –селеноводородная. Запишите формулы кислот: сероводородной , иодоводородной, бромоводородной
Номенклатура Бески c лородные кислоты – название неметалла + «О» +слово водородная. Примеры: HCl -хлороводородная ; HF — фтороводородная ; H 2 Se –селеноводородная. Запишите формулы кислот: сероводородной , иодоводородной, бромоводородной
 Кислородосодержащи е По степени окисления кислотообразующего элемента • H 2 + S +6 O 4 -2 – c ер ная кислота • H+N +5 O 3 -2 — азот ная кислота • H 2 + S +4 O 3 -2 – серн истая кислота • H+N +3 O 2 -2 – азот истая кислота • H 2 + Cr +6 O 4 -2 – хром овая кислота • H + Cr +3 O 2 -2 – хром истая кислота
Кислородосодержащи е По степени окисления кислотообразующего элемента • H 2 + S +6 O 4 -2 – c ер ная кислота • H+N +5 O 3 -2 — азот ная кислота • H 2 + S +4 O 3 -2 – серн истая кислота • H+N +3 O 2 -2 – азот истая кислота • H 2 + Cr +6 O 4 -2 – хром овая кислота • H + Cr +3 O 2 -2 – хром истая кислота
 По количеству молекул воды, присоединенных одной молекулой ангидрида • P 2 O 5 + 3 H 2 O → H 3 PO 4 — орто фосфорная кислота • P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 – пиро фосфорная кислота • P 2 O 5 + H 2 O → 2 HPO 3 – мета фосфорная кислота
По количеству молекул воды, присоединенных одной молекулой ангидрида • P 2 O 5 + 3 H 2 O → H 3 PO 4 — орто фосфорная кислота • P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 – пиро фосфорная кислота • P 2 O 5 + H 2 O → 2 HPO 3 – мета фосфорная кислота
 • H 3 Al. O 3 – орто алюминиевая кислота (более богатая водой) • HAl. O 2 – мета алюминиевая кислота ( H 3 Al. O 3 – Н 2 О → HAl. O 2 )
• H 3 Al. O 3 – орто алюминиевая кислота (более богатая водой) • HAl. O 2 – мета алюминиевая кислота ( H 3 Al. O 3 – Н 2 О → HAl. O 2 )
 Оксиды. Определение. Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород в степени окисления «-2»
Оксиды. Определение. Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород в степени окисления «-2»
 общая формула оксида • Э 2 +х О х -2 — • «+х» – степень окисления элемента • «-2» – степень окисления кислорода
общая формула оксида • Э 2 +х О х -2 — • «+х» – степень окисления элемента • «-2» – степень окисления кислорода
 Оксиды. Номенклатура. «Оксид» + название элемента, образующего оксид в родительном падеже + в скобках римскими цифрами валентность, если для элемента она может быть переменной:
Оксиды. Номенклатура. «Оксид» + название элемента, образующего оксид в родительном падеже + в скобках римскими цифрами валентность, если для элемента она может быть переменной:
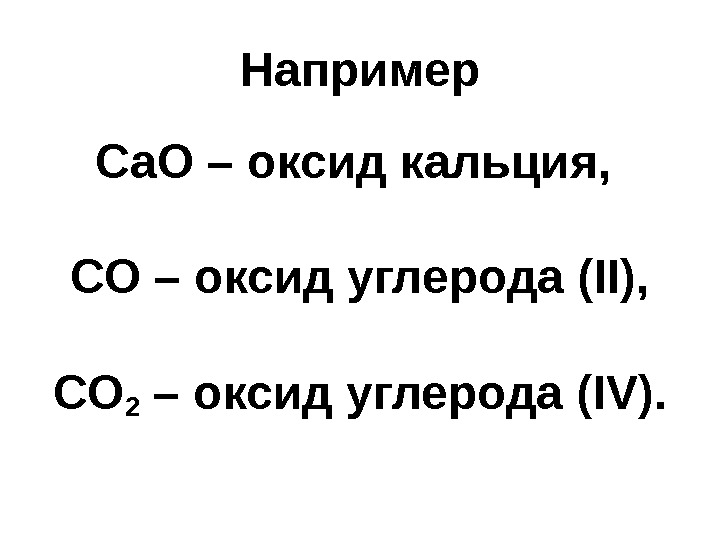
 Например Са. О – оксид кальция, СО – оксид углерода ( II), CO 2 – оксид углерода ( IV).
Например Са. О – оксид кальция, СО – оксид углерода ( II), CO 2 – оксид углерода ( IV).
 Примеры. • Запишите формулы оксидов : оксид железа ( II), оксид серы ( VI), оксид бора. • 2. Назовите оксиды: K 2 O, Al 2 O 3 , Mn. O, Mn 2 O 7 , Si. O 2 , Si. O
Примеры. • Запишите формулы оксидов : оксид железа ( II), оксид серы ( VI), оксид бора. • 2. Назовите оксиды: K 2 O, Al 2 O 3 , Mn. O, Mn 2 O 7 , Si. O 2 , Si. O
 Оксиды. Классификация. 1. Несолеобразующие. Не могут образовать солей. 2. Солеобразующие. Образуют соли.
Оксиды. Классификация. 1. Несолеобразующие. Не могут образовать солей. 2. Солеобразующие. Образуют соли.
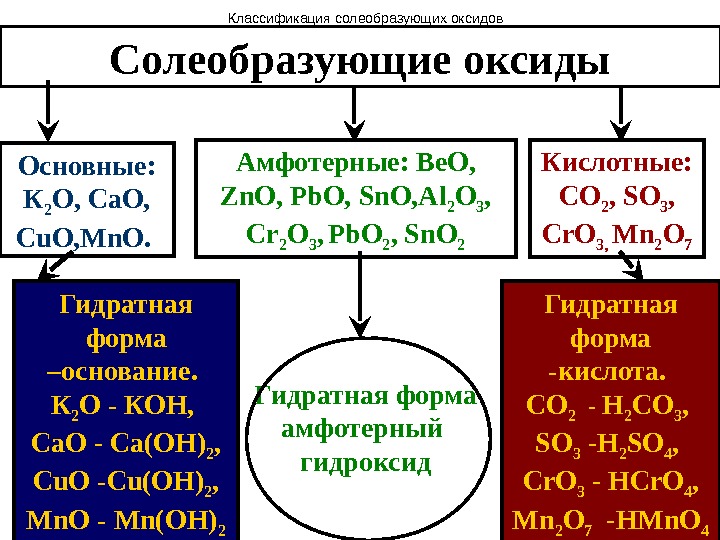
 Солеобразующие оксиды Основные: К 2 О, Са. О, Cu. O, Mn. O. Гидратная форма –основание. К 2 О — КОН, Са. О — Са(ОН) 2 , Cu. O — Cu(OH) 2 , Mn. O — Mn(OH) 2 Кислотные: СО 2 , SO 3 , Cr. O 3, Mn 2 O 7 Гидратная форма -кислота. СО 2 — H 2 CO 3 , SO 3 — H 2 SO 4 , Cr. O 3 — HCr. O 4 , Mn 2 O 7 — HMn. O 4 Амфотерные: Be. O, Zn. O, Pb. O, Sn. O, Al 2 O 3 , Cr 2 O 3 , Pb. O 2 , Sn. O 2 Гидратная форма амфотерный гидроксид. Классификация солеобразующих оксидов
Солеобразующие оксиды Основные: К 2 О, Са. О, Cu. O, Mn. O. Гидратная форма –основание. К 2 О — КОН, Са. О — Са(ОН) 2 , Cu. O — Cu(OH) 2 , Mn. O — Mn(OH) 2 Кислотные: СО 2 , SO 3 , Cr. O 3, Mn 2 O 7 Гидратная форма -кислота. СО 2 — H 2 CO 3 , SO 3 — H 2 SO 4 , Cr. O 3 — HCr. O 4 , Mn 2 O 7 — HMn. O 4 Амфотерные: Be. O, Zn. O, Pb. O, Sn. O, Al 2 O 3 , Cr 2 O 3 , Pb. O 2 , Sn. O 2 Гидратная форма амфотерный гидроксид. Классификация солеобразующих оксидов
 Основные оксиды. • Эти оксиды образуют только металлы в невысоких степенях окисления +1; +2 • В воде растворимы только оксиды щелочных ( IA- Li, Na, K, Rb, Cs) и щелочноземельных металлов (IIA – Са, Sr, Ba)
Основные оксиды. • Эти оксиды образуют только металлы в невысоких степенях окисления +1; +2 • В воде растворимы только оксиды щелочных ( IA- Li, Na, K, Rb, Cs) и щелочноземельных металлов (IIA – Са, Sr, Ba)
 Кислотные оксиды. Это оксиды неметаллов и металлов в высшей степени окисления.
Кислотные оксиды. Это оксиды неметаллов и металлов в высшей степени окисления.
 Соли. Определение Соли – это сложные вещества, состоящие из катионов металла и анионов кислотного остатка
Соли. Определение Соли – это сложные вещества, состоящие из катионов металла и анионов кислотного остатка
 Общая формула • M m +n X n — m • M — металл ; X – анион кислотного остатка ; • n – степень окисления металла ; • m – заряд кислотного остатка
Общая формула • M m +n X n — m • M — металл ; X – анион кислотного остатка ; • n – степень окисления металла ; • m – заряд кислотного остатка
 Классификация солей. Номенклатура солей 1. Средние (нормальные) – продукт полной нейтрализации кислоты основанием (продукт полного замещения ионов водорода Н + в кислоте ионами металла.
Классификация солей. Номенклатура солей 1. Средние (нормальные) – продукт полной нейтрализации кислоты основанием (продукт полного замещения ионов водорода Н + в кислоте ионами металла.
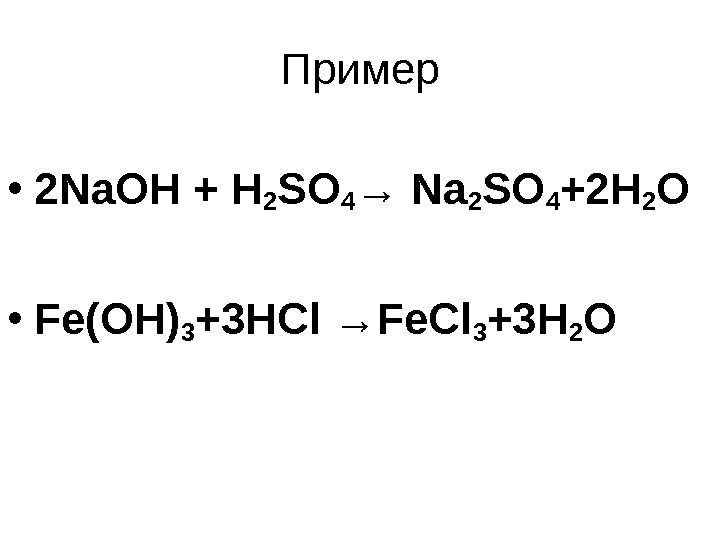
 Пример • 2 Na. OH + H 2 SO 4 → Na 2 SO 4 +2 H 2 O • Fe(OH) 3 +3 HCl →Fe. Cl 3 +3 H 2 O
Пример • 2 Na. OH + H 2 SO 4 → Na 2 SO 4 +2 H 2 O • Fe(OH) 3 +3 HCl →Fe. Cl 3 +3 H 2 O
 Номенклатура средних солей Названия средних солей составляют из названия аниона кислотного остатка в именительном падеже и названия катиона в родительном падеже.
Номенклатура средних солей Названия средних солей составляют из названия аниона кислотного остатка в именительном падеже и названия катиона в родительном падеже.
 Пример • Cr. Cl 3 – хлорид хрома (III) • K 2 S – сульфид калия • Ca(NO 3 ) 2 – нитрат кальция • В a(NO 2 ) 2 – нитрит бария • Fe. SO 4 – сульфат железа ( II) • Na 2 SO 3 – сульфит натрия
Пример • Cr. Cl 3 – хлорид хрома (III) • K 2 S – сульфид калия • Ca(NO 3 ) 2 – нитрат кальция • В a(NO 2 ) 2 – нитрит бария • Fe. SO 4 – сульфат железа ( II) • Na 2 SO 3 – сульфит натрия
 2. Кислые соли продукт неполной нейтрализации кислоты основанием ( продукт неполного замещения ионов водорода в кислоте ионами металла).
2. Кислые соли продукт неполной нейтрализации кислоты основанием ( продукт неполного замещения ионов водорода в кислоте ионами металла).
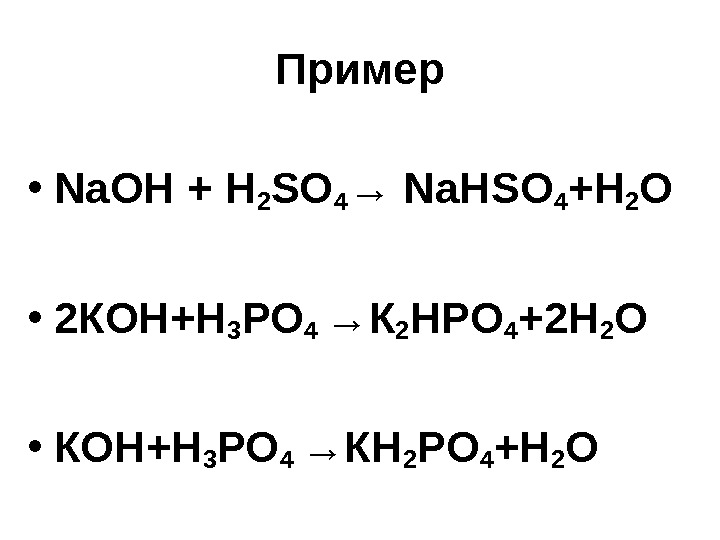
 Пример • Na. OH + H 2 SO 4 → Na Н SO 4 +H 2 O • 2 КОН+Н 3 РО 4 → К 2 НР O 4 + 2 H 2 O • КОН+Н 3 РО 4 → КН 2 Р O 4 +H 2 O
Пример • Na. OH + H 2 SO 4 → Na Н SO 4 +H 2 O • 2 КОН+Н 3 РО 4 → К 2 НР O 4 + 2 H 2 O • КОН+Н 3 РО 4 → КН 2 Р O 4 +H 2 O
 Номенклатура кислых солей Названия кислых солей: «гидро» +название аниона в именительном падеже+название металла в родительном падеже.
Номенклатура кислых солей Названия кислых солей: «гидро» +название аниона в именительном падеже+название металла в родительном падеже.
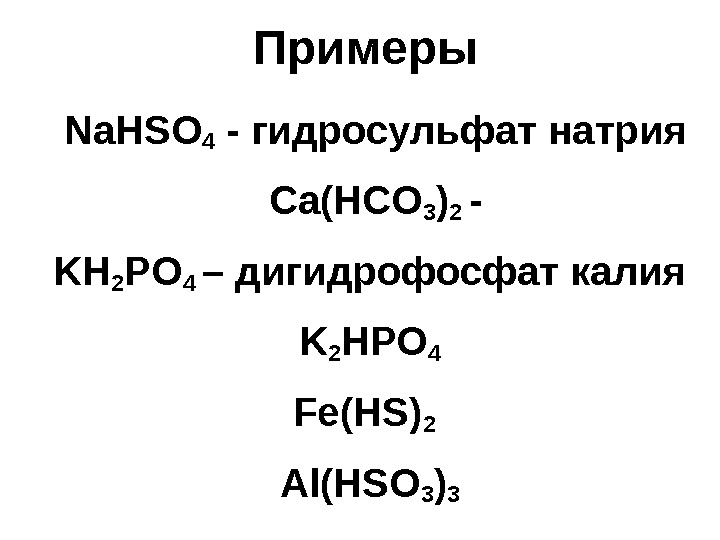
 Примеры Na. HSO 4 — гидросульфат натрия Ca(HCO 3 ) 2 — KH 2 PO 4 – дигидрофосфат калия K 2 HPO 4 Fe(HS) 2 Al(HSO 3 )
Примеры Na. HSO 4 — гидросульфат натрия Ca(HCO 3 ) 2 — KH 2 PO 4 – дигидрофосфат калия K 2 HPO 4 Fe(HS) 2 Al(HSO 3 )
 3. Основные соли — продукт неполной нейтрализации основания кислотой ( не все гидроксильные группы замещены на кислотный остаток).
3. Основные соли — продукт неполной нейтрализации основания кислотой ( не все гидроксильные группы замещены на кислотный остаток).
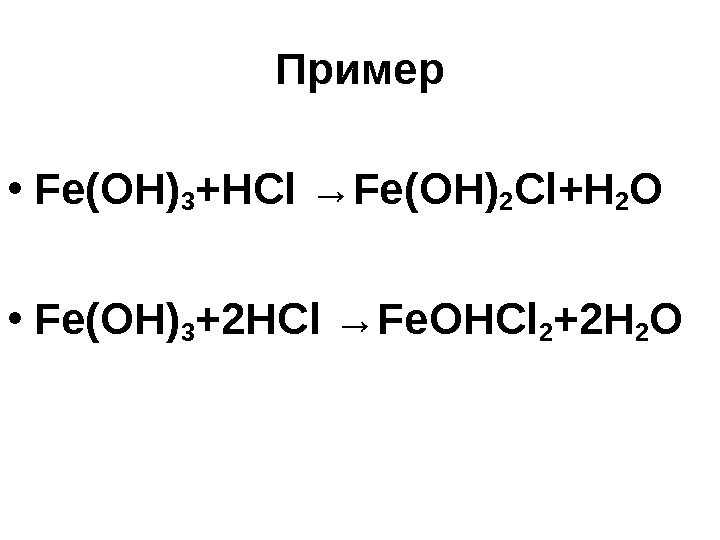
 Пример • Fe(OH) 3 +HCl →Fe (ОН) 2 Cl+H 2 O • Fe(OH) 3 + 2 HCl →Fe ОН Cl 2 + 2 H 2 O
Пример • Fe(OH) 3 +HCl →Fe (ОН) 2 Cl+H 2 O • Fe(OH) 3 + 2 HCl →Fe ОН Cl 2 + 2 H 2 O
 Номенклатура основных солей Названия основных солей: название аниона кислотного остатка в именительном падеже + «гидроксо» +название металла в родительном падеже
Номенклатура основных солей Названия основных солей: название аниона кислотного остатка в именительном падеже + «гидроксо» +название металла в родительном падеже
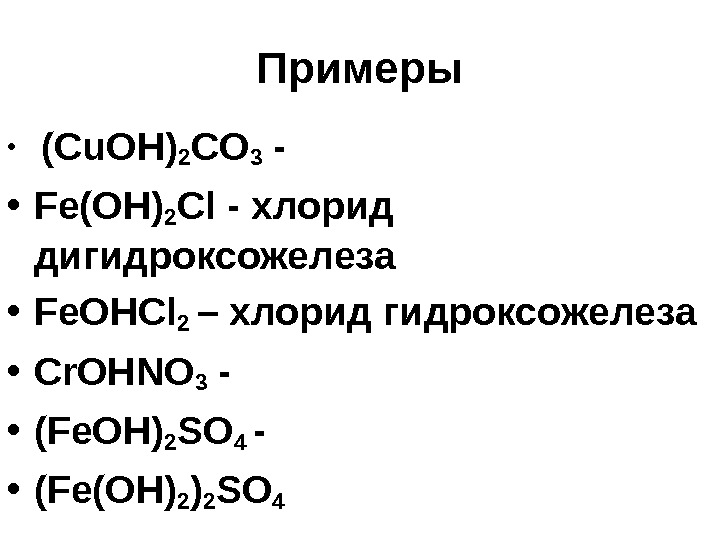
 Примеры • (Cu. OH) 2 CO 3 — • Fe(OH) 2 Cl — хлорид дигидроксожелеза • Fe. OHCl 2 – хлорид гидроксожелеза • Cr. OHNO 3 — • (Fe. OH) 2 SO 4 — • (Fe(OH) 2 SO
Примеры • (Cu. OH) 2 CO 3 — • Fe(OH) 2 Cl — хлорид дигидроксожелеза • Fe. OHCl 2 – хлорид гидроксожелеза • Cr. OHNO 3 — • (Fe. OH) 2 SO 4 — • (Fe(OH) 2 SO
 4. Двойные соли — соли, образующиеся при замещении ионов водорода в кислоте катионами двух разных металлов.
4. Двойные соли — соли, образующиеся при замещении ионов водорода в кислоте катионами двух разных металлов.
 Примеры • KAl(SO 4 ) 2 – сульфат алюминия калия или алюмокалиевые квасцы • NH 4 Cr(SO 4 ) 2 – сульфат хрома аммония или хромаммониевые квасцы
Примеры • KAl(SO 4 ) 2 – сульфат алюминия калия или алюмокалиевые квасцы • NH 4 Cr(SO 4 ) 2 – сульфат хрома аммония или хромаммониевые квасцы
 Соли кристаллогидраты — соли, содержащие в своем составе кристаллизационную воду.
Соли кристаллогидраты — соли, содержащие в своем составе кристаллизационную воду.
 Примеры • Cu. SO 4 × 5 H 2 O – пентагидрат сульфата меди или пятиводный сульфат меди • Mg. SO 4 × 7 H 2 O – семиводный сульфат магния • Na 2 CO 3 × 10 H 2 O — десятиводный карбонат натрия
Примеры • Cu. SO 4 × 5 H 2 O – пентагидрат сульфата меди или пятиводный сульфат меди • Mg. SO 4 × 7 H 2 O – семиводный сульфат магния • Na 2 CO 3 × 10 H 2 O — десятиводный карбонат натрия
 5. Комплексные соли — сложные соединения, состоящие из внешней и внутренней сферы.
5. Комплексные соли — сложные соединения, состоящие из внешней и внутренней сферы.
![Примеры: • Na 3 [Al(OH) 6 ] – гексагидроксоалюминат натрия • K Примеры: • Na 3 [Al(OH) 6 ] – гексагидроксоалюминат натрия • K](http://present5.com/presentbyword/20161219/l_1-4_osnovnye_opredelenia_i_klassy_ch1-1_images/l_1-4_osnovnye_opredelenia_i_klassy_ch1-1_131.jpg) Примеры: • Na 3 [Al(OH) 6 ] – гексагидроксоалюминат натрия • K 2 [Fe(CN) 4 ] – тетрацианоферрат(П) калия • [Cu(NH 3 ) 4 ](OH) 2 – гидроксид тетрааммин меди • [Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
Примеры: • Na 3 [Al(OH) 6 ] – гексагидроксоалюминат натрия • K 2 [Fe(CN) 4 ] – тетрацианоферрат(П) калия • [Cu(NH 3 ) 4 ](OH) 2 – гидроксид тетрааммин меди • [Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
 Химические свойства оксидов Основные оксиды. • Оксид + вода=основание (щелочь). • Растворимы в воде только оксиды щелочных и щелочноземельных металлов.
Химические свойства оксидов Основные оксиды. • Оксид + вода=основание (щелочь). • Растворимы в воде только оксиды щелочных и щелочноземельных металлов.
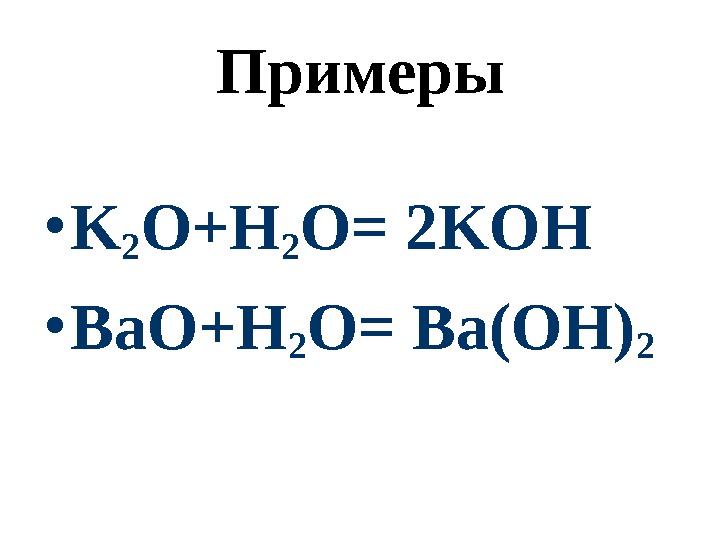
 Примеры • K 2 O+H 2 O= 2 KOH • Ba. O+H 2 O= Ba(OH)
Примеры • K 2 O+H 2 O= 2 KOH • Ba. O+H 2 O= Ba(OH)
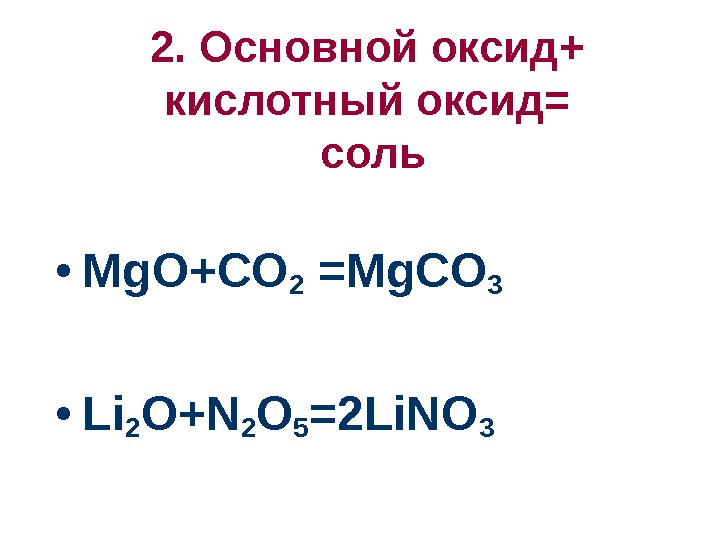
 2. Основной оксид+ кислотный оксид= соль • Mg. O+CO 2 =Mg. CO 3 • Li 2 O+N 2 O 5 =2 Li. NO
2. Основной оксид+ кислотный оксид= соль • Mg. O+CO 2 =Mg. CO 3 • Li 2 O+N 2 O 5 =2 Li. NO
 3. Основной оксид + кислота= соль+вода • Cu. O+H 2 SO 4 = Cu. SO 4 +H 2 O • Fe. O+2 HCl=Fe. Cl 2 + H 2 O
3. Основной оксид + кислота= соль+вода • Cu. O+H 2 SO 4 = Cu. SO 4 +H 2 O • Fe. O+2 HCl=Fe. Cl 2 + H 2 O
 Свойства кислотных оксидов 1. Кислотный оксид +вода = кислота. • В воде растворяются все кислотные оксиды кроме Si. O 2. • SO 3 +H 2 O =H 2 SO 4 , • N 2 O 5 +H 2 O =2 HNO 3 • Cr. O 3 + H 2 O= H 2 Cr. O 4 , • Mn 2 O 7 +H 2 O= 2 HMn. O
Свойства кислотных оксидов 1. Кислотный оксид +вода = кислота. • В воде растворяются все кислотные оксиды кроме Si. O 2. • SO 3 +H 2 O =H 2 SO 4 , • N 2 O 5 +H 2 O =2 HNO 3 • Cr. O 3 + H 2 O= H 2 Cr. O 4 , • Mn 2 O 7 +H 2 O= 2 HMn. O
 2. Кислотный оксид +основной=соль • Приведите примеры.
2. Кислотный оксид +основной=соль • Приведите примеры.
 3. Кислотный оксид +основание=соль+вода • Si. O 2 +2 KOH=K 2 Si. O 3 +H 2 O • N 2 O 5 +Ca(OH) 2 = Ca(NO 3 ) 2 +H 2 O
3. Кислотный оксид +основание=соль+вода • Si. O 2 +2 KOH=K 2 Si. O 3 +H 2 O • N 2 O 5 +Ca(OH) 2 = Ca(NO 3 ) 2 +H 2 O
 Оксиды металлов, которые в зависимости от условий могут проявлять свойства либо кислотных , либо основных оксидов. Ве. О, Zn. O, Pb. O, Sn. O, Al 2 O 3 , Cr 2 O 3 , Pb. O 2 , Sn. O 2 Свойства амфотерных оксидов Амфотерные оксиды.
Оксиды металлов, которые в зависимости от условий могут проявлять свойства либо кислотных , либо основных оксидов. Ве. О, Zn. O, Pb. O, Sn. O, Al 2 O 3 , Cr 2 O 3 , Pb. O 2 , Sn. O 2 Свойства амфотерных оксидов Амфотерные оксиды.
 Свойства • В воде нерастворимы. • могут растворяться как в кислотах (проявляют основные свойства ), так и в щелочах (проявляют кислотные свойства ).
Свойства • В воде нерастворимы. • могут растворяться как в кислотах (проявляют основные свойства ), так и в щелочах (проявляют кислотные свойства ).
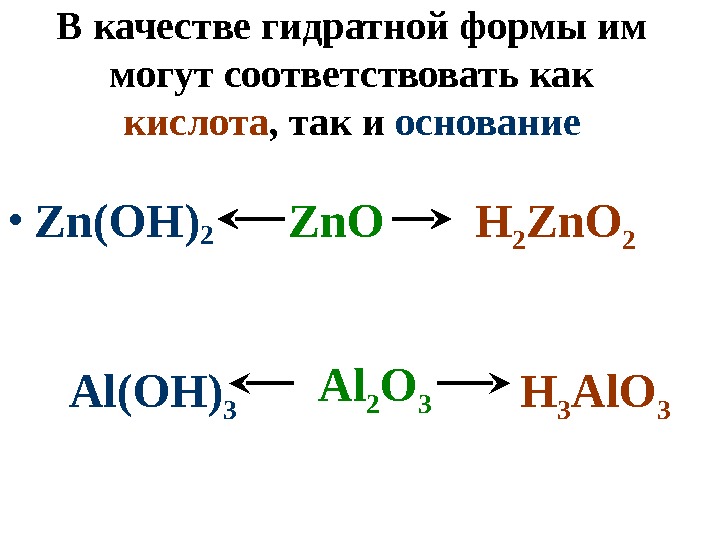
 В качестве гидратной формы им могут соответствовать как кислота , так и основание • Zn(OH) 2 Zn. O Al(OH) 3 H 3 Al. O 3 Al 2 O 3 H 2 Zn. O
В качестве гидратной формы им могут соответствовать как кислота , так и основание • Zn(OH) 2 Zn. O Al(OH) 3 H 3 Al. O 3 Al 2 O 3 H 2 Zn. O
 Свойства амфотерных оксидов. Амфотерный оксид + Основной оксид = соль • Be. O + K 2 O =K 2 Be. O 2 сплавление
Свойства амфотерных оксидов. Амфотерный оксид + Основной оксид = соль • Be. O + K 2 O =K 2 Be. O 2 сплавление
 2. Амфотерный оксид+щелочь= соль + вода • Al 2 O 3 + Na. OH ( тв. ) =Na. Al. O 2 +H 2 O сплавление • Cr 2 O 3 + 6 Na. OH (р-р) +3 H 2 O = 2 Na 3 [Cr(OH) 6 ] Na. Al. O 2 — метаалюминат натрия Na 3 [Al(OH) 6 ] -гексагидроксоалюминат натрия
2. Амфотерный оксид+щелочь= соль + вода • Al 2 O 3 + Na. OH ( тв. ) =Na. Al. O 2 +H 2 O сплавление • Cr 2 O 3 + 6 Na. OH (р-р) +3 H 2 O = 2 Na 3 [Cr(OH) 6 ] Na. Al. O 2 — метаалюминат натрия Na 3 [Al(OH) 6 ] -гексагидроксоалюминат натрия
 3. Амфотерный оксид+кислотный оксид=соль • Zn. O + SO 3 =Zn. SO 4 4. Амфотерный оксид+кислота=соль+вода • Al 2 O 3 + 6 HCl = 2 Al. Cl 3 +3 H 2 O
3. Амфотерный оксид+кислотный оксид=соль • Zn. O + SO 3 =Zn. SO 4 4. Амфотерный оксид+кислота=соль+вода • Al 2 O 3 + 6 HCl = 2 Al. Cl 3 +3 H 2 O
 Получение оксидов Взаимодействие простых веществ с кислородом. • S+O 2 =SO 2 , • Mg+O 2 =2 Mg. O ( нагревание)
Получение оксидов Взаимодействие простых веществ с кислородом. • S+O 2 =SO 2 , • Mg+O 2 =2 Mg. O ( нагревание)
 2. Горение сложных веществ в кислороде. • CH 4 +O 2 =CO 2 +2 H 2 O • 4 NH 3 +O 2 =4 NO+6 H 2 O • 2 H 2 S+3 O 2 =2 SO 2 +2 H 2 O
2. Горение сложных веществ в кислороде. • CH 4 +O 2 =CO 2 +2 H 2 O • 4 NH 3 +O 2 =4 NO+6 H 2 O • 2 H 2 S+3 O 2 =2 SO 2 +2 H 2 O
 3. Разложение сложных веществ. • Са. СО 3 =Са. О+СО 2 ; • Cu(OH) 2 = Cu. O+H 2 O – нагревание • (NH 4 ) 2 Cr 2 O 7 =Cr 2 O 3 +N 2 0 +4 H 2 O (тепловой импульс)
3. Разложение сложных веществ. • Са. СО 3 =Са. О+СО 2 ; • Cu(OH) 2 = Cu. O+H 2 O – нагревание • (NH 4 ) 2 Cr 2 O 7 =Cr 2 O 3 +N 2 0 +4 H 2 O (тепловой импульс)
 4. Взаимодействие оксида металла с другим металлом. • Al + Cr 2 O 3 =Cr +Al 2 O 3 (нагревание)
4. Взаимодействие оксида металла с другим металлом. • Al + Cr 2 O 3 =Cr +Al 2 O 3 (нагревание)
 Классы неорганических соединений Лекция
Классы неорганических соединений Лекция
 Химические свойства оснований Амфотерные гидроксиды • Амфотерные гидроксид + кислота → соль + вода Zn(OH) 2 + 2 HCl → Zn. Cl 2 +2 H 2 O
Химические свойства оснований Амфотерные гидроксиды • Амфотерные гидроксид + кислота → соль + вода Zn(OH) 2 + 2 HCl → Zn. Cl 2 +2 H 2 O
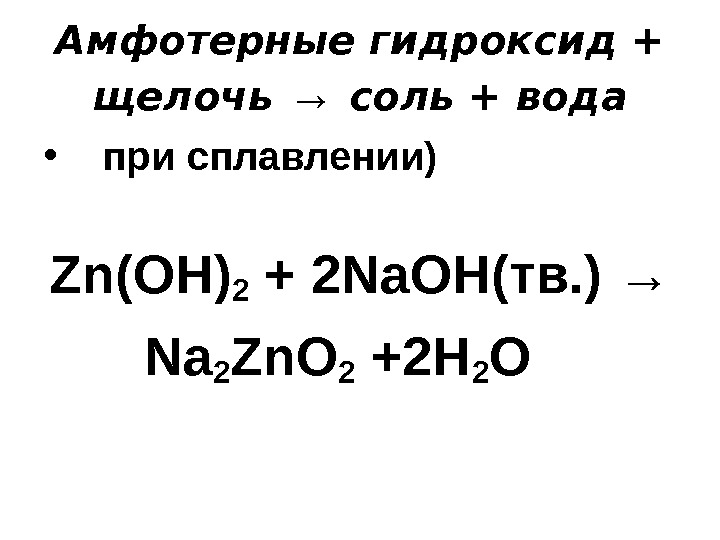
 Амфотерные гидроксид + щелочь → соль + вода • при сплавлении) Zn(OH) 2 + 2 Na. OH( тв. ) → Na 2 Zn. O 2 +2 H 2 O
Амфотерные гидроксид + щелочь → соль + вода • при сплавлении) Zn(OH) 2 + 2 Na. OH( тв. ) → Na 2 Zn. O 2 +2 H 2 O
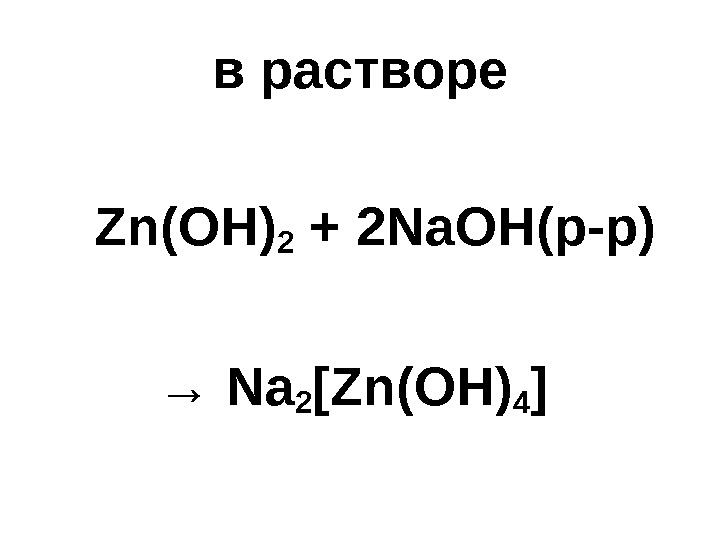
 в растворе Zn(OH) 2 + 2 Na. OH( р-р) → Na 2 [Zn(OH) 4 ]
в растворе Zn(OH) 2 + 2 Na. OH( р-р) → Na 2 [Zn(OH) 4 ]
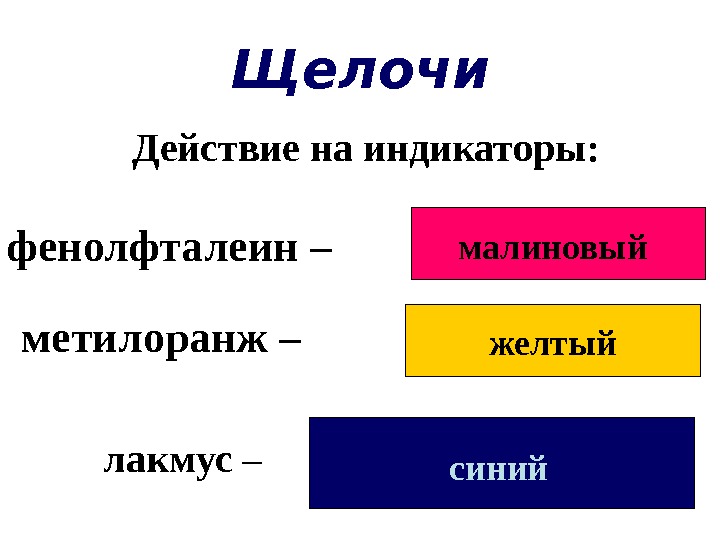
 Щелочи малиновый желтый синий. Действие на индикаторы: фенолфталеин – метилоранж – лакмус –
Щелочи малиновый желтый синий. Действие на индикаторы: фенолфталеин – метилоранж – лакмус –
 2. Щелочь + кислота =соль + вода 2 KOH +2 HCl = 2 KCl + H 2 O Реакция нейтрализации
2. Щелочь + кислота =соль + вода 2 KOH +2 HCl = 2 KCl + H 2 O Реакция нейтрализации
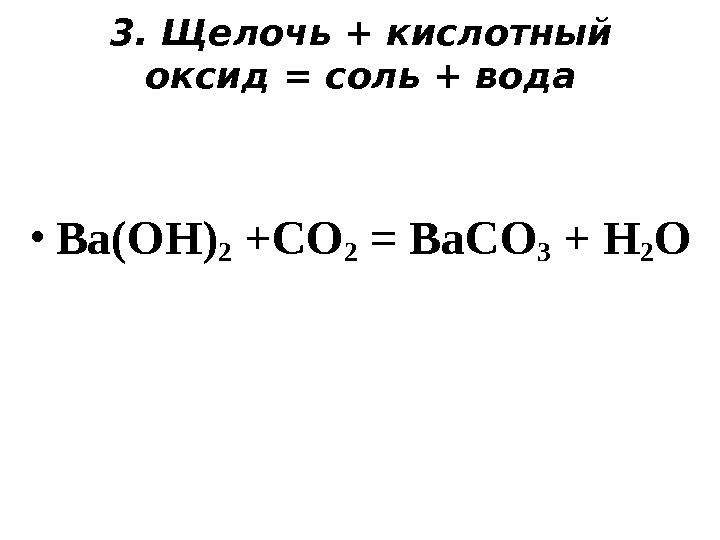
 3. Щелочь + кислотный оксид = соль + вода • Ba(OH) 2 +CO 2 = Ba. CO 3 + H 2 O
3. Щелочь + кислотный оксид = соль + вода • Ba(OH) 2 +CO 2 = Ba. CO 3 + H 2 O
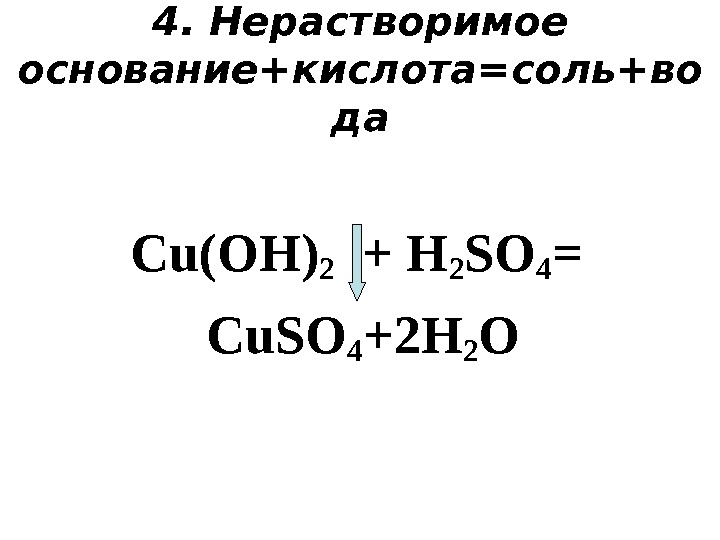
 4. Нерастворимое основание+кислота=соль+во да С u(OH) 2 + H 2 SO 4 = Cu. SO 4 +2 H 2 O
4. Нерастворимое основание+кислота=соль+во да С u(OH) 2 + H 2 SO 4 = Cu. SO 4 +2 H 2 O
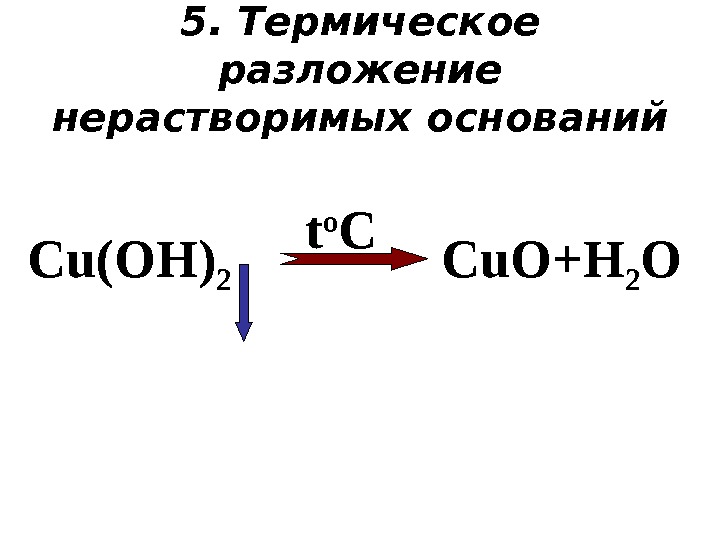
 5. Термическое разложение нерастворимых оснований t o C Cu. O+H 2 OС u(OH)
5. Термическое разложение нерастворимых оснований t o C Cu. O+H 2 OС u(OH)
 Получение оснований • Активный металл+вода → щелочь+водород • Металлы только щелочные и щелочноземельные Li, Na, K, Rb, Cs 2 Na +2 H 2 O → 2 Na. OH+H
Получение оснований • Активный металл+вода → щелочь+водород • Металлы только щелочные и щелочноземельные Li, Na, K, Rb, Cs 2 Na +2 H 2 O → 2 Na. OH+H
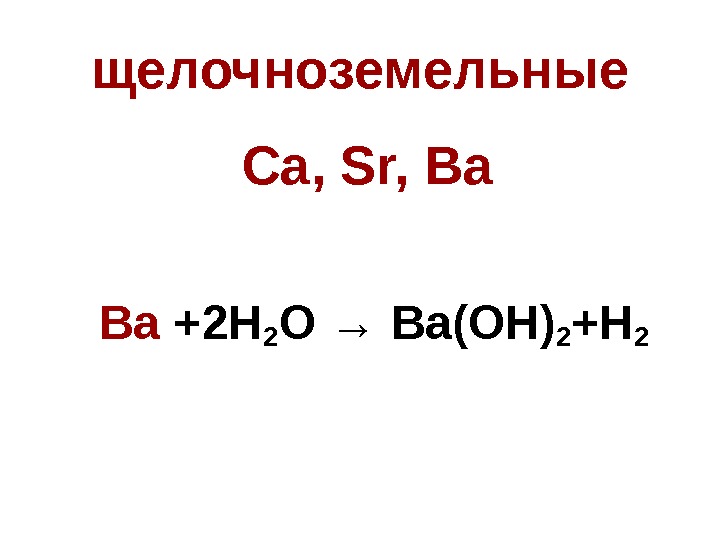
 щелочноземельные Ca, Sr, Ba Ba +2 H 2 O → Ba(OH) 2 +H
щелочноземельные Ca, Sr, Ba Ba +2 H 2 O → Ba(OH) 2 +H
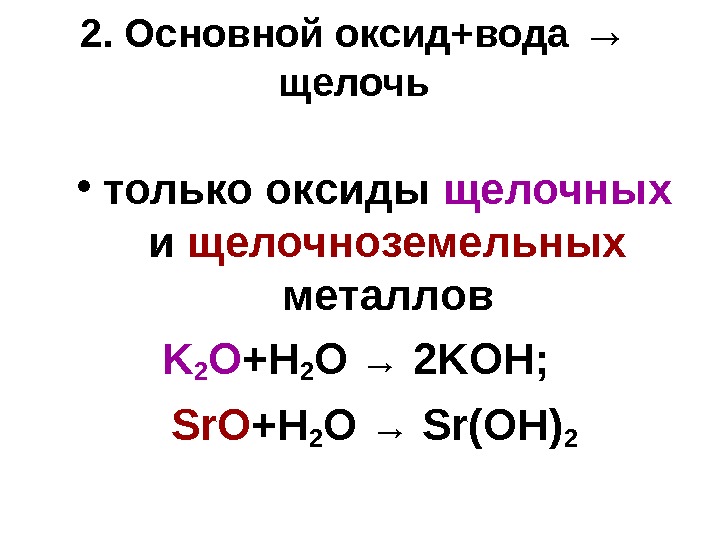
 2. Основной оксид+вода → щелочь • только оксиды щелочных и щелочноземельных металлов K 2 O +H 2 O → 2 KOH; Sr. O +H 2 O → Sr(OH)
2. Основной оксид+вода → щелочь • только оксиды щелочных и щелочноземельных металлов K 2 O +H 2 O → 2 KOH; Sr. O +H 2 O → Sr(OH)
 3. Соль 1(р-р)+основание 1(р-р) → соль2(р-р)+нерастворимое основание 2 • Fe. Cl 3 ( р )+ 3 KOH( р ) → 3 KCl( р )+Fe(OH) 3 ↓ цвет ржавчины • Zn. SO 4 ( р )+NH 4 OH( р ) → (NH 4 ) 2 SO 4 ( р )+Zn (OH) 2 ↓ белый
3. Соль 1(р-р)+основание 1(р-р) → соль2(р-р)+нерастворимое основание 2 • Fe. Cl 3 ( р )+ 3 KOH( р ) → 3 KCl( р )+Fe(OH) 3 ↓ цвет ржавчины • Zn. SO 4 ( р )+NH 4 OH( р ) → (NH 4 ) 2 SO 4 ( р )+Zn (OH) 2 ↓ белый
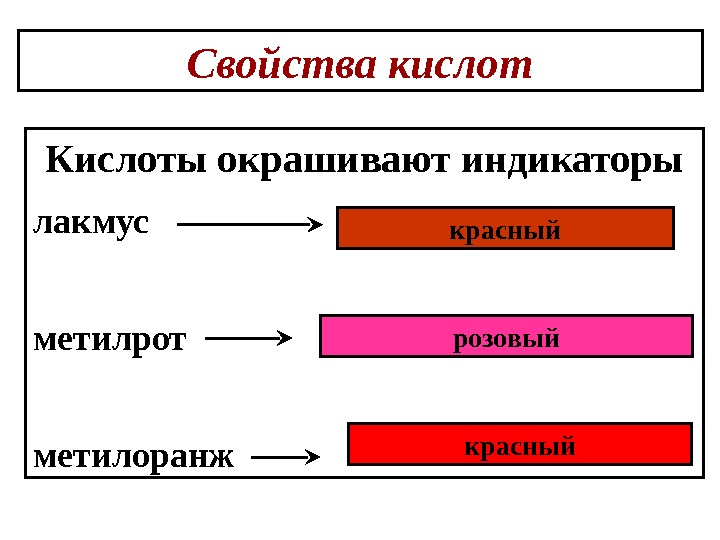
 Свойства кислот Кислоты окрашивают индикаторы лакмус метилрот метилоранж красный розовый красный
Свойства кислот Кислоты окрашивают индикаторы лакмус метилрот метилоранж красный розовый красный
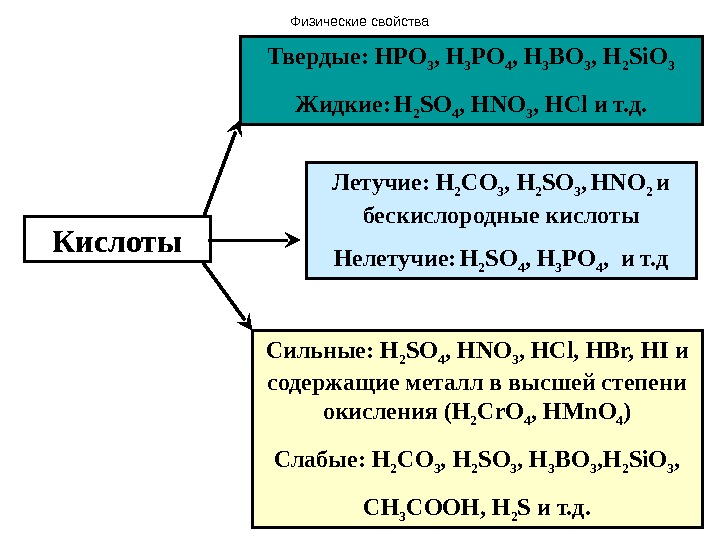
 Кислоты Летучие: H 2 С O 3 , H 2 SO 3 , HNO 2 и бескислородные кислоты Нелетучие: H 2 SO 4 , H 3 PO 4 , и т. д. Твердые: HPO 3 , H 3 PO 4 , H 3 BO 3 , H 2 Si. O 3 Жидкие: H 2 SO 4 , HNO 3 , HCl и т. д. Сильные: H 2 SO 4 , HNO 3 , HCl , HBr, HI и содержащие металл в высшей степени окисления ( H 2 Cr. O 4 , HMn. O 4 ) Слабые: H 2 С O 3 , H 2 SO 3 , H 3 BO 3 , H 2 Si. O 3 , СН 3 СООН, H 2 S и т. д. Физические свойства
Кислоты Летучие: H 2 С O 3 , H 2 SO 3 , HNO 2 и бескислородные кислоты Нелетучие: H 2 SO 4 , H 3 PO 4 , и т. д. Твердые: HPO 3 , H 3 PO 4 , H 3 BO 3 , H 2 Si. O 3 Жидкие: H 2 SO 4 , HNO 3 , HCl и т. д. Сильные: H 2 SO 4 , HNO 3 , HCl , HBr, HI и содержащие металл в высшей степени окисления ( H 2 Cr. O 4 , HMn. O 4 ) Слабые: H 2 С O 3 , H 2 SO 3 , H 3 BO 3 , H 2 Si. O 3 , СН 3 СООН, H 2 S и т. д. Физические свойства
 Химические свойства кислот 1. Кислота+ основной оксид → соль + вода • 2 HNO 3 +Na 2 O → 2 Na. NO 3 +H 2 O
Химические свойства кислот 1. Кислота+ основной оксид → соль + вода • 2 HNO 3 +Na 2 O → 2 Na. NO 3 +H 2 O
 2. Кислота+ основание → соль + вода • Реакция нейтрализации • H 2 SO 4 + 2 Na. OH → Na 2 SO 4 +2 H 2 O • 2 HCl + Cu(OH) 2 ↓ → Cu. Cl 2 +2 H 2 O
2. Кислота+ основание → соль + вода • Реакция нейтрализации • H 2 SO 4 + 2 Na. OH → Na 2 SO 4 +2 H 2 O • 2 HCl + Cu(OH) 2 ↓ → Cu. Cl 2 +2 H 2 O
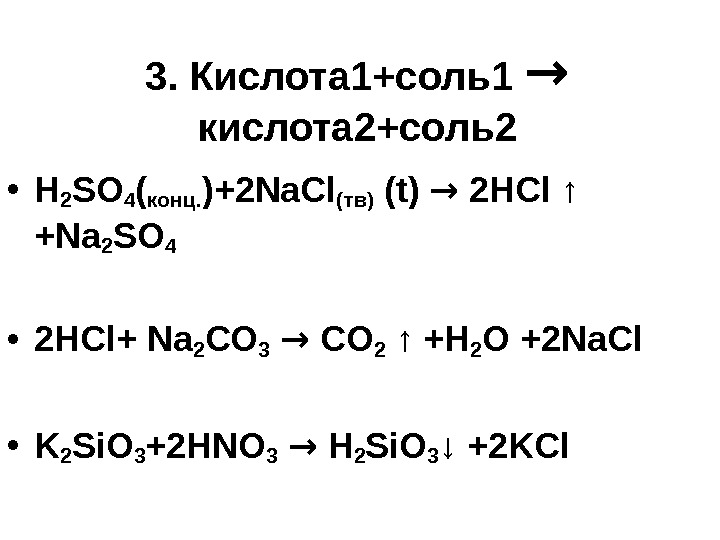
 3. Кислота 1+соль1 → кислота 2+соль2 • H 2 SO 4 (конц. )+ 2 Na. Cl(тв) ( t ) → 2 HCl ↑ +Na 2 SO 4 • 2 HCl + Na 2 С O 3 → CO 2 ↑ +H 2 O + 2 Na С l • K 2 Si. O 3 +2 HNO 3 → H 2 Si. O 3 ↓ +2 KCl
3. Кислота 1+соль1 → кислота 2+соль2 • H 2 SO 4 (конц. )+ 2 Na. Cl(тв) ( t ) → 2 HCl ↑ +Na 2 SO 4 • 2 HCl + Na 2 С O 3 → CO 2 ↑ +H 2 O + 2 Na С l • K 2 Si. O 3 +2 HNO 3 → H 2 Si. O 3 ↓ +2 KCl
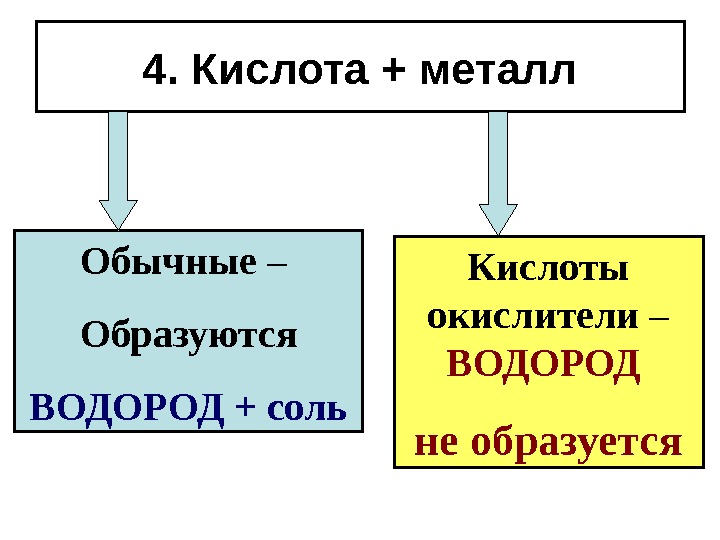
 4. Кислота + металл Обычные – Образуются ВОДОРОД + соль Кислоты окислители – ВОДОРОД не образуется
4. Кислота + металл Обычные – Образуются ВОДОРОД + соль Кислоты окислители – ВОДОРОД не образуется
 Кислоты окислители • H 2 SO 4 концентрированная, • HNO 3 любой концентрации
Кислоты окислители • H 2 SO 4 концентрированная, • HNO 3 любой концентрации
 продолжени • при нагревании реагируют со всеми металлами кроме благородных ( Au, Pt) и неметаллами. • Холодные концентрированные кислоты пассивируют Fe, Cr, Al.
продолжени • при нагревании реагируют со всеми металлами кроме благородных ( Au, Pt) и неметаллами. • Холодные концентрированные кислоты пассивируют Fe, Cr, Al.
 Водород из этих кислот не выделяется ! Продукты восстановления кислотообразующего элемента зависят от концентрации кислоты и активности металла
Водород из этих кислот не выделяется ! Продукты восстановления кислотообразующего элемента зависят от концентрации кислоты и активности металла
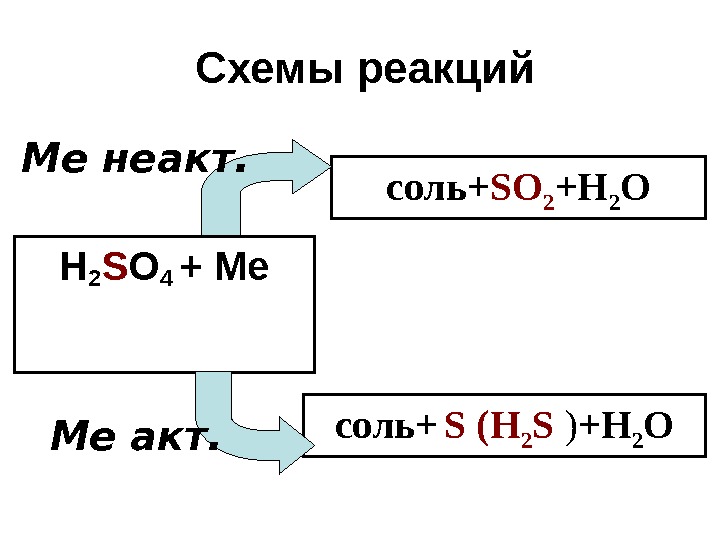
 Схемы реакций Н 2 S O 4 + Ме соль+ S О 2 +Н 2 О соль+ S (Н 2 S ) +Н 2 О Ме акт. Ме неакт.
Схемы реакций Н 2 S O 4 + Ме соль+ S О 2 +Н 2 О соль+ S (Н 2 S ) +Н 2 О Ме акт. Ме неакт.
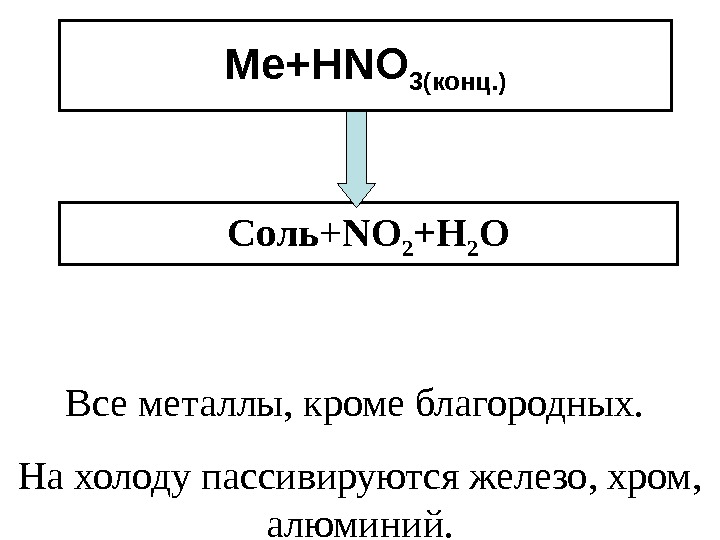
 Ме+ HNO 3 (конц. ) Соль + NO 2 +Н 2 О Все металлы, кроме благородных. На холоду пассивируются железо, хром, алюминий.
Ме+ HNO 3 (конц. ) Соль + NO 2 +Н 2 О Все металлы, кроме благородных. На холоду пассивируются железо, хром, алюминий.
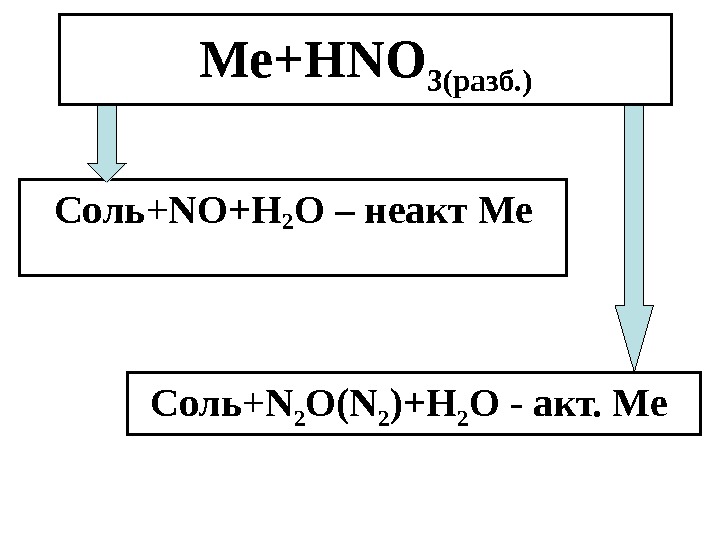
 Ме+ HNO 3 (разб. ) Соль + NO +Н 2 О – неакт Ме Соль + N 2 O ( N 2 )+Н 2 О — акт. Ме
Ме+ HNO 3 (разб. ) Соль + NO +Н 2 О – неакт Ме Соль + N 2 O ( N 2 )+Н 2 О — акт. Ме
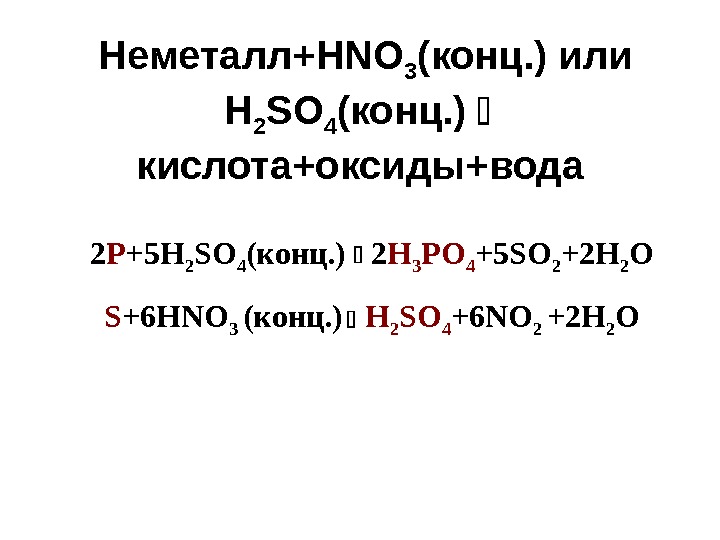
 Неметалл+ HNO 3 (конц. ) или H 2 SO 4 ( конц. ) кислота+оксиды+вода 2 P +5 H 2 SO 4 ( конц. ) 2 H 3 PO 4 +5 SO 2 +2 H 2 O S +6 HNO 3 ( конц. ) H 2 SO 4 +6 NO 2 +2 H 2 O
Неметалл+ HNO 3 (конц. ) или H 2 SO 4 ( конц. ) кислота+оксиды+вода 2 P +5 H 2 SO 4 ( конц. ) 2 H 3 PO 4 +5 SO 2 +2 H 2 O S +6 HNO 3 ( конц. ) H 2 SO 4 +6 NO 2 +2 H 2 O
 б) обычные кислоты • все кроме HNO 3 , H 2 SO 4 концентрированной • H 2 SO 4 разбавленная, H 3 Р O 4 , H С l….
б) обычные кислоты • все кроме HNO 3 , H 2 SO 4 концентрированной • H 2 SO 4 разбавленная, H 3 Р O 4 , H С l….
 Образуются соль и ВОДОРОД! Fe+H 2 SO 4 = Fe. SO 4 +H 2 Реагируют со всеми металлами (кроме свинца), стоящими в ряду напряжений до водорода.
Образуются соль и ВОДОРОД! Fe+H 2 SO 4 = Fe. SO 4 +H 2 Реагируют со всеми металлами (кроме свинца), стоящими в ряду напряжений до водорода.
 Получение кислот 1. Кислотный оксид + вода кислота. SO 3 +H 2 O H 2 SO 4 – серная кислота P 2 O 5 + 3 H 2 O 2 H 3 PO 4 – ортофосфорная кислота Mn 2 O 7 + H 2 O 2 HMn. O 4 – марганцовая кислота В воде растворимы все кислотные оксиды кроме оксида кремния ( IV).
Получение кислот 1. Кислотный оксид + вода кислота. SO 3 +H 2 O H 2 SO 4 – серная кислота P 2 O 5 + 3 H 2 O 2 H 3 PO 4 – ортофосфорная кислота Mn 2 O 7 + H 2 O 2 HMn. O 4 – марганцовая кислота В воде растворимы все кислотные оксиды кроме оксида кремния ( IV).
 2. Соль1+кислота 1 соль2+кислота 2 Кислородосодержащие: Ca. Cl 2 +3 H 2 SO 4 Ca. SO 4 +2 H Cl Na 2 Si. O 3 +2 HCl 2 Na. Cl+ H 2 Si. O 3 Бескислородные 2 Na. Cl( тв. )+H 2 SO 4 ( конц. ) 2 Na 2 SO 4 +2 HCl ↑ Fe. S( тв. )+2 HCl ( конц. ) Fe. Cl 2 + H 2 S ↑
2. Соль1+кислота 1 соль2+кислота 2 Кислородосодержащие: Ca. Cl 2 +3 H 2 SO 4 Ca. SO 4 +2 H Cl Na 2 Si. O 3 +2 HCl 2 Na. Cl+ H 2 Si. O 3 Бескислородные 2 Na. Cl( тв. )+H 2 SO 4 ( конц. ) 2 Na 2 SO 4 +2 HCl ↑ Fe. S( тв. )+2 HCl ( конц. ) Fe. Cl 2 + H 2 S ↑
 3. Синтез из простых веществ Водород+неметалл газ Газ пропускают в воду раствор бескислородной кислоты H 2 +Cl 2 2 HCl (газ хлороводород) ; H 2 + S H 2 S (газ сероводород) ;
3. Синтез из простых веществ Водород+неметалл газ Газ пропускают в воду раствор бескислородной кислоты H 2 +Cl 2 2 HCl (газ хлороводород) ; H 2 + S H 2 S (газ сероводород) ;
 Кислоты , особенно концентрированные, разрушают кожу и ткани! Кислоты требуют осторожного обращения! При попадании на кожу или одежду нейтрализовать раствором соды, а затем обильно смыть водой.
Кислоты , особенно концентрированные, разрушают кожу и ткани! Кислоты требуют осторожного обращения! При попадании на кожу или одежду нейтрализовать раствором соды, а затем обильно смыть водой.
 Свойства солей Некоторые физические свойства: все соли – твердые кристаллические вещества. Соли имеют различную окраску. Каждая индивидуальная соль характеризуется строго определенными физическими константами (например температура плавления)
Свойства солей Некоторые физические свойства: все соли – твердые кристаллические вещества. Соли имеют различную окраску. Каждая индивидуальная соль характеризуется строго определенными физическими константами (например температура плавления)
 По растворимости в воде • 1) растворимые. Это соли щелочных металлов, соли аммония, нитраты и ацетаты, сульфиды бария и магния
По растворимости в воде • 1) растворимые. Это соли щелочных металлов, соли аммония, нитраты и ацетаты, сульфиды бария и магния
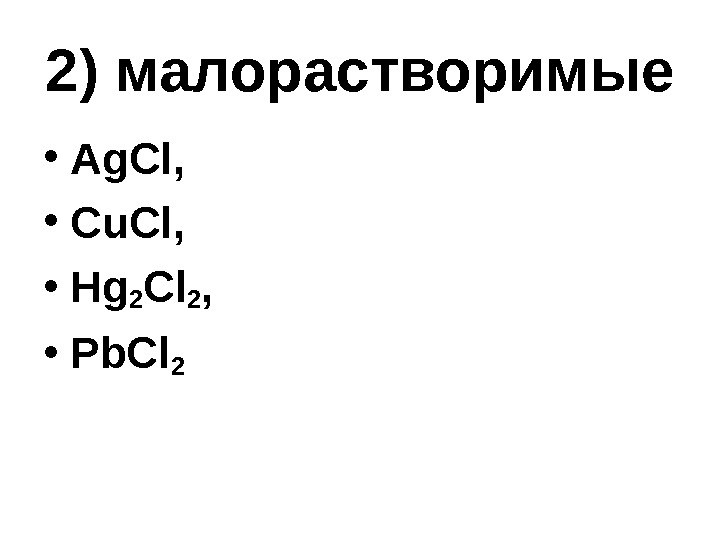
 2) малорастворимые • Ag. Cl, • Cu. Cl, • Hg 2 Cl 2 , • Pb. Cl
2) малорастворимые • Ag. Cl, • Cu. Cl, • Hg 2 Cl 2 , • Pb. Cl
 3) Нерастворимые • все сульфиды, карбонаты, сульфиты, силикаты, фосфаты (кроме солей аммония, щелочных металлов, сульфидов магния и бария)
3) Нерастворимые • все сульфиды, карбонаты, сульфиты, силикаты, фосфаты (кроме солей аммония, щелочных металлов, сульфидов магния и бария)
 Химические свойства средних солей 1. Соль1+кислота 1 соль2+кислота 2 Ряд кислот: HNO 3 , H 2 SO 4 , HCl, H 3 PO 4 , H 2 SO 3 , H 2 CO 3 , H 2 Si. O 3 каждая предыдущая кислота вытесняет из соли следующую
Химические свойства средних солей 1. Соль1+кислота 1 соль2+кислота 2 Ряд кислот: HNO 3 , H 2 SO 4 , HCl, H 3 PO 4 , H 2 SO 3 , H 2 CO 3 , H 2 Si. O 3 каждая предыдущая кислота вытесняет из соли следующую
 Закончить уравнения • Na 2 Si. O 3 +HCl …; • Na 2 CO 3 + H 2 SO 4 …; • Cu. S+ H 2 SO 4 (p) …
Закончить уравнения • Na 2 Si. O 3 +HCl …; • Na 2 CO 3 + H 2 SO 4 …; • Cu. S+ H 2 SO 4 (p) …
 2. Соль1+щелочь соль2+нерастворимое основание Mg(NO 3 ) 2 +KOH …; Fe 2 (SO 4 ) 3 +Na. OH …
2. Соль1+щелочь соль2+нерастворимое основание Mg(NO 3 ) 2 +KOH …; Fe 2 (SO 4 ) 3 +Na. OH …
 3. соль1+металл 1 соль2+металл 2 • Cu. SO 4 +Zn …; • Hg(NO 3 ) 2 +Cu … • Каждый левостоящий металл вытесняет из соли правостоящий.
3. соль1+металл 1 соль2+металл 2 • Cu. SO 4 +Zn …; • Hg(NO 3 ) 2 +Cu … • Каждый левостоящий металл вытесняет из соли правостоящий.
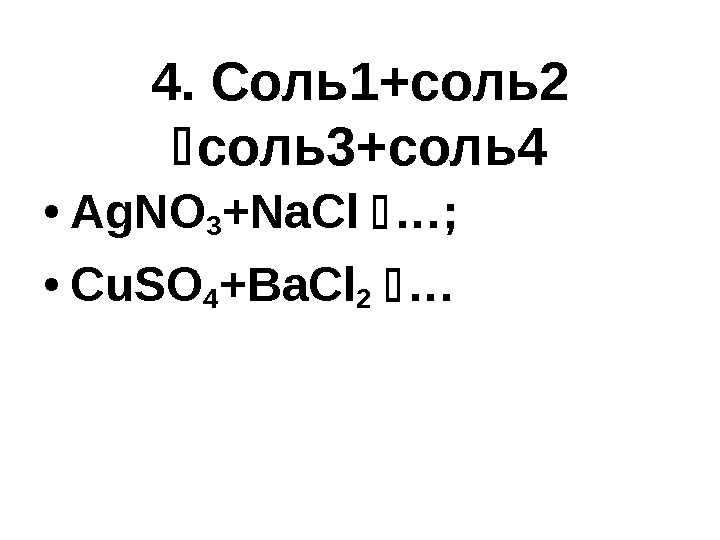
 4. Соль1+соль2 соль3+соль4 • Ag. NO 3 +Na. Cl …; • Cu. SO 4 +Ba. Cl 2 …
4. Соль1+соль2 соль3+соль4 • Ag. NO 3 +Na. Cl …; • Cu. SO 4 +Ba. Cl 2 …
 Получение солей Средние соли. 1. Металл+неметалл: 2 Fe+3 Cl 2 2 Fe. Cl
Получение солей Средние соли. 1. Металл+неметалл: 2 Fe+3 Cl 2 2 Fe. Cl
 2. Металл+кислота соль +водород • : Mg+2 HCl Mg. Cl 2 +H
2. Металл+кислота соль +водород • : Mg+2 HCl Mg. Cl 2 +H
 3. Металл+соль Zn+Cu. SO 4 Cu+Zn. SO
3. Металл+соль Zn+Cu. SO 4 Cu+Zn. SO
 4. Основной оксид+ кислотный оксид • Ca. O+CO 2 Ca. CO
4. Основной оксид+ кислотный оксид • Ca. O+CO 2 Ca. CO
 5. Основной оксид+кислота Cu. O+H 2 SO 4 Cu. SO 4+H 2 O
5. Основной оксид+кислота Cu. O+H 2 SO 4 Cu. SO 4+H 2 O
 6. Основание+кислотный оксид • Ba(OH)2+N 2 O 5 Ba(NO 3)2+2 H 2 O
6. Основание+кислотный оксид • Ba(OH)2+N 2 O 5 Ba(NO 3)2+2 H 2 O
 7. Основание+кислота • . Fe(OH)3+3 HCl Fe. Cl 3+3 H 2 O
7. Основание+кислота • . Fe(OH)3+3 HCl Fe. Cl 3+3 H 2 O
 8. Щелочь+соль • 2 Na. OH+Mg(NO 3)2 2 Na. NO 3+Mg(OH)
8. Щелочь+соль • 2 Na. OH+Mg(NO 3)2 2 Na. NO 3+Mg(OH)
 9. Соль+кислота • Ca. CO 3+2 HCl Ca. Cl 2+CO 2+H 2 O
9. Соль+кислота • Ca. CO 3+2 HCl Ca. Cl 2+CO 2+H 2 O
 10. Соль1+соль2 • Na 2 SO 4+Ag. NO 3 2 Na. NO 3+Ag 2 SO
10. Соль1+соль2 • Na 2 SO 4+Ag. NO 3 2 Na. NO 3+Ag 2 SO
 При написании уравнений реакций следует помнить 1) Реакция возможна, если в результате реакции образуется • а)осадок, • б) газ, • в)слабый электролит
При написании уравнений реакций следует помнить 1) Реакция возможна, если в результате реакции образуется • а)осадок, • б) газ, • в)слабый электролит
 продолжение • 2) Водород из кислот (кроме азотной и концентрированной серной) вытесняют только металлы, стоящте левее водорода в ряду напряжений
продолжение • 2) Водород из кислот (кроме азотной и концентрированной серной) вытесняют только металлы, стоящте левее водорода в ряду напряжений
 продолжение • 3) Каждый левостоящий металл (в ряду напряжений) может вытеснять правостоящий из раствора его соли
продолжение • 3) Каждый левостоящий металл (в ряду напряжений) может вытеснять правостоящий из раствора его соли
 Получение кислых солей 1. Неполная нейтрализация кислоты основанием. В реакции участвует избыток кислоты и недостаток основания. H 3 PO 4 +KOH KH 2 PO 4 +H 2 O H 3 PO 4 +2 KOH K 2 HPO 4 +2 H 2 O
Получение кислых солей 1. Неполная нейтрализация кислоты основанием. В реакции участвует избыток кислоты и недостаток основания. H 3 PO 4 +KOH KH 2 PO 4 +H 2 O H 3 PO 4 +2 KOH K 2 HPO 4 +2 H 2 O
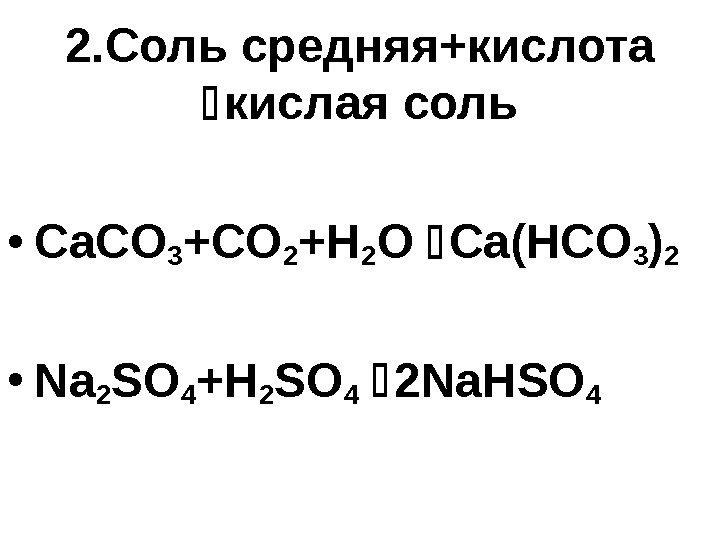
 2. Соль средняя+кислота кислая соль • Ca. CO 3 +CO 2 +H 2 O Ca(HCO 3 ) 2 • Na 2 SO 4 +H 2 SO 4 2 Na. HSO
2. Соль средняя+кислота кислая соль • Ca. CO 3 +CO 2 +H 2 O Ca(HCO 3 ) 2 • Na 2 SO 4 +H 2 SO 4 2 Na. HSO
 Получение основных солей 1. Неполная нейтрализация основания кислотой (избыток основания+недостаток кислоты основная соль). Fe(OH) 3 +HCl Fe(OH) 2 Cl Fe(OH) 3 +2 HCl Fe. OHCl+2 H 2 O
Получение основных солей 1. Неполная нейтрализация основания кислотой (избыток основания+недостаток кислоты основная соль). Fe(OH) 3 +HCl Fe(OH) 2 Cl Fe(OH) 3 +2 HCl Fe. OHCl+2 H 2 O
 2. Средняя соль1+щелочь основная соль+средняя соль2 • Fe. Cl 2 +KOH Fe. OHCl+KCl
2. Средняя соль1+щелочь основная соль+средняя соль2 • Fe. Cl 2 +KOH Fe. OHCl+KCl
 3. Средняя соль+одноименное основание основная соль • Ca. SO 4 +C а (OH) 2 (Ca. OH) 2 SO
3. Средняя соль+одноименное основание основная соль • Ca. SO 4 +C а (OH) 2 (Ca. OH) 2 SO
 Взаимосвязь средних, кислых, основных солей Кислая соль+основание средняя соль + вода Na. HSO 3 +Na. OH Na 2 SO 4 +H 2 O KH 2 PO 4 +2 KOH K 3 PO 4 +2 H 2 O
Взаимосвязь средних, кислых, основных солей Кислая соль+основание средняя соль + вода Na. HSO 3 +Na. OH Na 2 SO 4 +H 2 O KH 2 PO 4 +2 KOH K 3 PO 4 +2 H 2 O
 Основная соль+кислота средняя соль+вода • Ca. OHNO 3 +HNO 3 Ca(NO 3 ) 2 +H 2 O • Cr(OH) 2 Cl+2 HCl Cr. Cl 3 +2 H 2 O
Основная соль+кислота средняя соль+вода • Ca. OHNO 3 +HNO 3 Ca(NO 3 ) 2 +H 2 O • Cr(OH) 2 Cl+2 HCl Cr. Cl 3 +2 H 2 O
 Осуществить цепочку превращений 1. Fe Fe. O Fe. SO 4 Fe(OH) 2 Fe(OH)Cl Fe. Cl 2 1) 2 Fe+O 2 2 Fe. O; 2) Fe. O+H 2 SO 4 Fe. SO 4 +H 2 O;
Осуществить цепочку превращений 1. Fe Fe. O Fe. SO 4 Fe(OH) 2 Fe(OH)Cl Fe. Cl 2 1) 2 Fe+O 2 2 Fe. O; 2) Fe. O+H 2 SO 4 Fe. SO 4 +H 2 O;
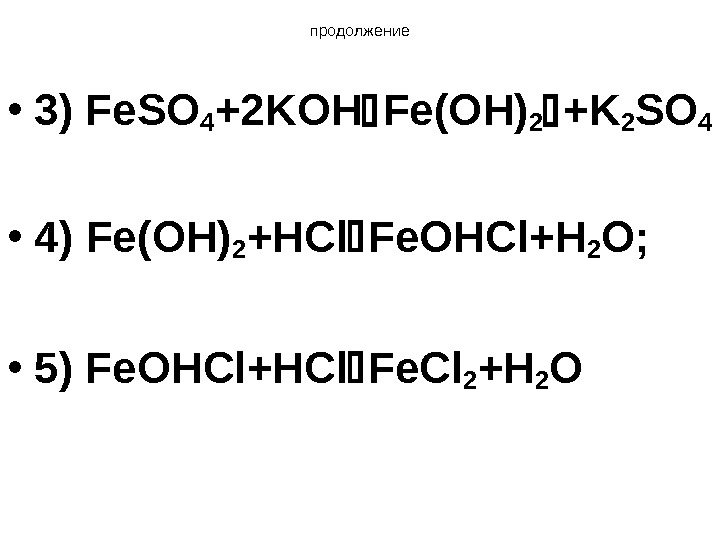
 продолжение • 3) Fe. SO 4 +2 KOH Fe(OH) 2 +K 2 SO 4 • 4) Fe(OH) 2 +HCl Fe. OHCl+H 2 O; • 5) Fe. OHCl+HCl Fe. Cl 2 +H 2 O
продолжение • 3) Fe. SO 4 +2 KOH Fe(OH) 2 +K 2 SO 4 • 4) Fe(OH) 2 +HCl Fe. OHCl+H 2 O; • 5) Fe. OHCl+HCl Fe. Cl 2 +H 2 O
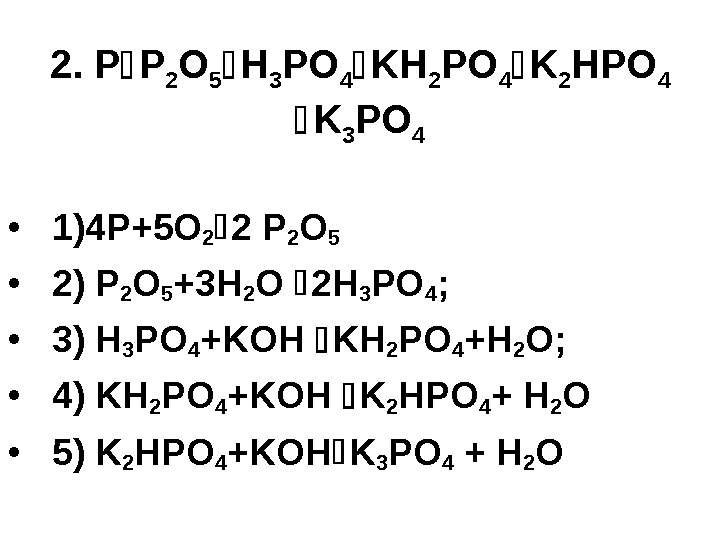
 2. P P 2 O 5 H 3 PO 4 KH 2 PO 4 K 2 HPO 4 K 3 PO 4 • 1) 4 P+5 O 2 2 P 2 O 5 • 2) P 2 O 5 +3 H 2 O 2 H 3 PO 4 ; • 3) H 3 PO 4 +KOH KH 2 PO 4 +H 2 O; • 4) KH 2 PO 4 +KOH K 2 HPO 4 + H 2 O • 5) K 2 HPO 4 +KOH K 3 PO 4 + H 2 O
2. P P 2 O 5 H 3 PO 4 KH 2 PO 4 K 2 HPO 4 K 3 PO 4 • 1) 4 P+5 O 2 2 P 2 O 5 • 2) P 2 O 5 +3 H 2 O 2 H 3 PO 4 ; • 3) H 3 PO 4 +KOH KH 2 PO 4 +H 2 O; • 4) KH 2 PO 4 +KOH K 2 HPO 4 + H 2 O • 5) K 2 HPO 4 +KOH K 3 PO 4 + H 2 O
 Применение неорганических соединений. Множество неорганических соединений являются природными, существуют и их аналоги — синтезированные соединения. Вот некоторые примеры природных соединений, некоторые драгоценные камни: изумруд – минерал берилл содержит примеси соединений хрома(Ш) и ванадия (Ш). Рубин – прозрачная разновидность минерала корунда (оксид алюминия и соли хрома, титана, железа). Сапфир также минерал корунд, содержит примеси солей железа, хрома, титана, ванадия и др. Жемчуг – 86% карбоната кальция (ромбический арагонит), 12% конхиолин (органическое вещество), 2% воды. Коралл – карбонат кальция (кальцит). Бирюза — водный фосфат меди и алюминия Cu. Al 6 [PO 4 ] 4 (OH) 8 *4 H 2 O. Малахит- основной карбонат меди (Cu. OH) 2 CO 3.
Применение неорганических соединений. Множество неорганических соединений являются природными, существуют и их аналоги — синтезированные соединения. Вот некоторые примеры природных соединений, некоторые драгоценные камни: изумруд – минерал берилл содержит примеси соединений хрома(Ш) и ванадия (Ш). Рубин – прозрачная разновидность минерала корунда (оксид алюминия и соли хрома, титана, железа). Сапфир также минерал корунд, содержит примеси солей железа, хрома, титана, ванадия и др. Жемчуг – 86% карбоната кальция (ромбический арагонит), 12% конхиолин (органическое вещество), 2% воды. Коралл – карбонат кальция (кальцит). Бирюза — водный фосфат меди и алюминия Cu. Al 6 [PO 4 ] 4 (OH) 8 *4 H 2 O. Малахит- основной карбонат меди (Cu. OH) 2 CO 3.
 He которые области применение оксидов. Некоторые оксиды представляют собой природные минералы и служат для получения металлов: боксит Al 2 O 3 *n. H 2 O; гематит Fe 2 O 3 ; магнетит Fe. O*Fe 2 O 3 ; кассетерит Sn. O 2 ; пиролюзит Mn. O 2 ; рутил Ti. O 2. Минерал корунд ( Al 2 O 3 )– абразивный материал, обладает высокой прчностью. Негашеная известь (Са. О) широко применяется в строительстве, сельском хозяйстве, как реагент для буровых растворов. Оксиды железа Fe. O, Fe 3 O 4 используются при бурении нефтяных скважин в качестве утяжелителей и реагентов нейтрализаторов сероводорода. Оксид кремния ( Si. O 2 ) в виде кварцевого песка широко используется в производстве стекла, цемента и эмалей, при гидроразрыве нефтяных и газовых скважин
He которые области применение оксидов. Некоторые оксиды представляют собой природные минералы и служат для получения металлов: боксит Al 2 O 3 *n. H 2 O; гематит Fe 2 O 3 ; магнетит Fe. O*Fe 2 O 3 ; кассетерит Sn. O 2 ; пиролюзит Mn. O 2 ; рутил Ti. O 2. Минерал корунд ( Al 2 O 3 )– абразивный материал, обладает высокой прчностью. Негашеная известь (Са. О) широко применяется в строительстве, сельском хозяйстве, как реагент для буровых растворов. Оксиды железа Fe. O, Fe 3 O 4 используются при бурении нефтяных скважин в качестве утяжелителей и реагентов нейтрализаторов сероводорода. Оксид кремния ( Si. O 2 ) в виде кварцевого песка широко используется в производстве стекла, цемента и эмалей, при гидроразрыве нефтяных и газовых скважин
 нефтяных и газовых скважин, в виде эффективного пеногасителя буровых растворов (в виде аэрозоля), наполнителя при производстве резинотехнических изделий. Ряд оксидов и их композиций применяются в качестве катализаторов в современных химических производствах ( Al 2 O 3 оксид алюминия, V 2 O 5 — ванадия ( V ), Cu. O — оксид меди и др. ) Оксид углерода ( IV ) или углекислый газ (CO 2 ) — продукт сгорания угля, нефти и нефтепродуктов. Используется для закачки в продуктивные пласты с целью повышения их нефтеотдачи, также углекислый газ применяется для заполнения огнетушителей и газирования воды. Оксид хрома (Ш) Cr 2 O 3 и смешанный оксид свинца 2 Pb. O*Pb. O 2 (сурик) применяются для пр o изводства антикоррозионных красочных составов. Оксиды азота NO NO 2 , а также серы SO 2 , SO 3 – промежуточные продукты в производстве азотной и серной кислот. Наряду с оксидом углерода (II ) CO (угарный газ) являются продуктами, которые образуются при нарушении режима сгорания топлива и загрязняют атмосферу. Их содержание в должно строго контролироваться, а также должна производится их нейтрализация.
нефтяных и газовых скважин, в виде эффективного пеногасителя буровых растворов (в виде аэрозоля), наполнителя при производстве резинотехнических изделий. Ряд оксидов и их композиций применяются в качестве катализаторов в современных химических производствах ( Al 2 O 3 оксид алюминия, V 2 O 5 — ванадия ( V ), Cu. O — оксид меди и др. ) Оксид углерода ( IV ) или углекислый газ (CO 2 ) — продукт сгорания угля, нефти и нефтепродуктов. Используется для закачки в продуктивные пласты с целью повышения их нефтеотдачи, также углекислый газ применяется для заполнения огнетушителей и газирования воды. Оксид хрома (Ш) Cr 2 O 3 и смешанный оксид свинца 2 Pb. O*Pb. O 2 (сурик) применяются для пр o изводства антикоррозионных красочных составов. Оксиды азота NO NO 2 , а также серы SO 2 , SO 3 – промежуточные продукты в производстве азотной и серной кислот. Наряду с оксидом углерода (II ) CO (угарный газ) являются продуктами, которые образуются при нарушении режима сгорания топлива и загрязняют атмосферу. Их содержание в должно строго контролироваться, а также должна производится их нейтрализация.
 Некоторые области применеия оснований Гидроксиды натрия и калия получают в помышленности. Эти гидроксиды находят широкое применение в различных областях: для очистки нефтепродуктов, в производстве мыла, искусственного шелка, бумаги, в текстильной и кожевенной промышленности. Щелочи также входят в состав растворов для обезжиривания поверхности некоторых металлов (цветных и черных) перед нанесением декоративных и защитных покрытий. Гидроксиды калия, кальция и бария применяются в нефтяной промышленности для приготовления ингибированных буровых растворов, позволяющих разбуривать неустойчивые горные породы. Закачка растворов щелочей в пласт позволяет повысить нефтеотдачу.
Некоторые области применеия оснований Гидроксиды натрия и калия получают в помышленности. Эти гидроксиды находят широкое применение в различных областях: для очистки нефтепродуктов, в производстве мыла, искусственного шелка, бумаги, в текстильной и кожевенной промышленности. Щелочи также входят в состав растворов для обезжиривания поверхности некоторых металлов (цветных и черных) перед нанесением декоративных и защитных покрытий. Гидроксиды калия, кальция и бария применяются в нефтяной промышленности для приготовления ингибированных буровых растворов, позволяющих разбуривать неустойчивые горные породы. Закачка растворов щелочей в пласт позволяет повысить нефтеотдачу.
 Гидроксиды натрия, кальция, железа ( III) используются в качестве реагентов для очистки газов от сероводорода. Гидроксид кальция (гашеная известь) применяется в качестве ингбитора коррозии металла под действием морской воды, в качечтве реагента для устранения жесткости воды, для очистки мазута, идущего для приготовления смазочных масел. Гидроксиды алюминия и железа (Ш) применяются в качечтве флокуляторов для очистки воды, для приготовления буровых растворов.
Гидроксиды натрия, кальция, железа ( III) используются в качестве реагентов для очистки газов от сероводорода. Гидроксид кальция (гашеная известь) применяется в качестве ингбитора коррозии металла под действием морской воды, в качечтве реагента для устранения жесткости воды, для очистки мазута, идущего для приготовления смазочных масел. Гидроксиды алюминия и железа (Ш) применяются в качечтве флокуляторов для очистки воды, для приготовления буровых растворов.
 Некоторые области применения кислот Азотная кислота широко используется в производстве удобрений, Красителей, лаков, пластмасс, лекарственных препаратов, химических волокон, взрывчатых веществ. Серная кислота в больших количествах используется в производстве минеральных удобрений, красителей, химических волокон, пластмасс, лекарственных препаратов. Используется для извлечения металлов из руд, заполнения кислотных аккумуляторов. В нефтяной промышленности для очистки нефтепродуктов. Фосфорная кислота входит в составы для обезжиривания металлических поверхностей перед нанесением защитных покрытий, входит в состав композиций для удаления ржавчины перед покраской, применяется для защиты трубопроводов от коррозии прокачке морской воды.
Некоторые области применения кислот Азотная кислота широко используется в производстве удобрений, Красителей, лаков, пластмасс, лекарственных препаратов, химических волокон, взрывчатых веществ. Серная кислота в больших количествах используется в производстве минеральных удобрений, красителей, химических волокон, пластмасс, лекарственных препаратов. Используется для извлечения металлов из руд, заполнения кислотных аккумуляторов. В нефтяной промышленности для очистки нефтепродуктов. Фосфорная кислота входит в составы для обезжиривания металлических поверхностей перед нанесением защитных покрытий, входит в состав композиций для удаления ржавчины перед покраской, применяется для защиты трубопроводов от коррозии прокачке морской воды.
 Соляная кислота широко применяется в нефтяной промышленности для обработки призабойных зон скважин с целью увеличения нефтеотдачи пластов. Используется в составе травильных растворов для удаления ржавчины и отложений в трубопроводах и скважинах, а также как отвердительфенол-формальдегидной смолы.
Соляная кислота широко применяется в нефтяной промышленности для обработки призабойных зон скважин с целью увеличения нефтеотдачи пластов. Используется в составе травильных растворов для удаления ржавчины и отложений в трубопроводах и скважинах, а также как отвердительфенол-формальдегидной смолы.
 Некоторые области применения солей Ряд солей (соли натрия, кальция, а также соли, содержащие элементы азот, фосфор) необходимы для жизнеобеспечения живых и растительных организмов. Хлорид натрия – природный минерал. Добыча его в мире более 200 млн. т. Широко применяется в пищевой промышленности, сырье для получения хлора, соляной кислоты, гидроксида натрия, карбоната натрия. В нефтяной промышленности как добавка в буровые растворы для предупреждения образования каверн при бурении скважин; как регулятор сроков схватывания цементных тампонирующих составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
Некоторые области применения солей Ряд солей (соли натрия, кальция, а также соли, содержащие элементы азот, фосфор) необходимы для жизнеобеспечения живых и растительных организмов. Хлорид натрия – природный минерал. Добыча его в мире более 200 млн. т. Широко применяется в пищевой промышленности, сырье для получения хлора, соляной кислоты, гидроксида натрия, карбоната натрия. В нефтяной промышленности как добавка в буровые растворы для предупреждения образования каверн при бурении скважин; как регулятор сроков схватывания цементных тампонирующих составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
 Хлорид калия – входит в состав буровых растворов, способствующих сохранению устойчивости скважин в глинистых породах. Карбонат натрия (сода)- входит в сотав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к пользованию (например в котлах), широко используется для очистки природного газа от сероводорода и для производства буровых и тампонажных растворов. Сульфат алюминия – компонент буровых растворов, коагулянт для очистки воды от токодисперсных взвешенных частиц, компонент вязко-упругих смесей для изоляции зон поглощения нефтяных и газовых скважин.
Хлорид калия – входит в состав буровых растворов, способствующих сохранению устойчивости скважин в глинистых породах. Карбонат натрия (сода)- входит в сотав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к пользованию (например в котлах), широко используется для очистки природного газа от сероводорода и для производства буровых и тампонажных растворов. Сульфат алюминия – компонент буровых растворов, коагулянт для очистки воды от токодисперсных взвешенных частиц, компонент вязко-упругих смесей для изоляции зон поглощения нефтяных и газовых скважин.
 Тетраборат натрия , бура ( Na 2 B 4 O 7 ) – замедлитель схватывания цементных растворов, ингибитор термоокислительной деструкции защитных реагентоа на основе эфиров целлюлозы. Сульфат бария, барит, тяжелый шпат – используется в качестве утяжелителя буровых растворов. Сульфат железа ( II ) , железный купорос – используется для приготовления феррохромлигносульфоната – реагента- стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе. Хлорид железа ( III) – в сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачкив сероводородсодержащие пласты с целью снижения их проницаемости; как добавка в цементы с целью повышения их сероводородостойкости, для очистки воды от взвешенных частиц.
Тетраборат натрия , бура ( Na 2 B 4 O 7 ) – замедлитель схватывания цементных растворов, ингибитор термоокислительной деструкции защитных реагентоа на основе эфиров целлюлозы. Сульфат бария, барит, тяжелый шпат – используется в качестве утяжелителя буровых растворов. Сульфат железа ( II ) , железный купорос – используется для приготовления феррохромлигносульфоната – реагента- стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе. Хлорид железа ( III) – в сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачкив сероводородсодержащие пласты с целью снижения их проницаемости; как добавка в цементы с целью повышения их сероводородостойкости, для очистки воды от взвешенных частиц.
 Карбонат кальция – природные материалы мрамор, известняк в строительстве, отделочных работах, получения мела. Сырье для производства негашеной извести (Са. О), в металлургии. Применяется в бурении как уеяжелитель и наполнитель буровых растворов. Сульфат кальция – алебастр 2 Ca. SO 4 *H 2 O широко используется в строительстве, входит в состав быстротвердеющих вяжущих средств для изоляции зон поглощений. При добавлении в виде ангидрита Ca. SO 4 или гипса Ca. SO 4 *2 H 2 O придает устойчивость разбуриваемым глинистым породам. Хлорид кальция – используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород, сильно снижает температуру замерзания растворов (антифриз), для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
Карбонат кальция – природные материалы мрамор, известняк в строительстве, отделочных работах, получения мела. Сырье для производства негашеной извести (Са. О), в металлургии. Применяется в бурении как уеяжелитель и наполнитель буровых растворов. Сульфат кальция – алебастр 2 Ca. SO 4 *H 2 O широко используется в строительстве, входит в состав быстротвердеющих вяжущих средств для изоляции зон поглощений. При добавлении в виде ангидрита Ca. SO 4 или гипса Ca. SO 4 *2 H 2 O придает устойчивость разбуриваемым глинистым породам. Хлорид кальция – используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород, сильно снижает температуру замерзания растворов (антифриз), для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
 Силикат натрия Na 2 Si. O 3 – используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощения, ингибитор коррозии металлов, компонент некоторых буровых, тампонажных и буферных растворов. Нитрат серебра – используется для химического анализа, в том числе пластовых вод, фильтратов буровых растворов на содержание хлорид-ионов. Сульфит натрия – используется для химического удаления кислорода (деаэрация) из воды в целяз борьбы с коррозией при закачке сточных вод. Для ингибирования термоокислительной деструкции защитных реагентов. Бихромат натрия Na 2 Cr 2 O 7 – используется для приготовления ряда реагентов, в нефтяной промышленности для высокотемпературного снижения вязкости буровых растворов, ингибитора корроззии алюминия.
Силикат натрия Na 2 Si. O 3 – используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощения, ингибитор коррозии металлов, компонент некоторых буровых, тампонажных и буферных растворов. Нитрат серебра – используется для химического анализа, в том числе пластовых вод, фильтратов буровых растворов на содержание хлорид-ионов. Сульфит натрия – используется для химического удаления кислорода (деаэрация) из воды в целяз борьбы с коррозией при закачке сточных вод. Для ингибирования термоокислительной деструкции защитных реагентов. Бихромат натрия Na 2 Cr 2 O 7 – используется для приготовления ряда реагентов, в нефтяной промышленности для высокотемпературного снижения вязкости буровых растворов, ингибитора корроззии алюминия.
