Демонстрация опухолеспецифического иммунного ответа. Иммунизация облученными опухолевыми клетками
























lecture-11.ppt
- Размер: 4.4 Мб
- Автор:
- Количество слайдов: 34
Описание презентации Демонстрация опухолеспецифического иммунного ответа. Иммунизация облученными опухолевыми клетками по слайдам
 Демонстрация опухолеспецифического иммунного ответа. Иммунизация облученными опухолевыми клетками индуцирует иммунитет к клеткам той же опухоли и ее отторжение, но не отменяет рост посторонней опухоли другого клеточного типа.
Демонстрация опухолеспецифического иммунного ответа. Иммунизация облученными опухолевыми клетками индуцирует иммунитет к клеткам той же опухоли и ее отторжение, но не отменяет рост посторонней опухоли другого клеточного типа.
 Противоопухолевыми вакцинами называют широкий ряд агентов, в основе механизма действия которых лежит формирование специфического иммунного ответа на антигены опухолей. Их следует отличать от профилактических вакцин против онкогенных вирусов (вируса папилломы, вируса гепатита B и др. ), которые эффективно предотвра- щают некоторые онкологические заболевания, но противоопухолевой активностью не обладают. В отличие от вакцин, применяемых для профилактики инфекционных заболеваний (профилактические вакцины), противоопухолевые вакцины используют для усиления иммунного ответа на уже существующую опухоль (терапевтические вакцины). В силу множественности причин, уникальности свойств и непредсказуемости появления злокачественных опухолей профилактическое использование противоопухолевых вакцин нецелесообразно.
Противоопухолевыми вакцинами называют широкий ряд агентов, в основе механизма действия которых лежит формирование специфического иммунного ответа на антигены опухолей. Их следует отличать от профилактических вакцин против онкогенных вирусов (вируса папилломы, вируса гепатита B и др. ), которые эффективно предотвра- щают некоторые онкологические заболевания, но противоопухолевой активностью не обладают. В отличие от вакцин, применяемых для профилактики инфекционных заболеваний (профилактические вакцины), противоопухолевые вакцины используют для усиления иммунного ответа на уже существующую опухоль (терапевтические вакцины). В силу множественности причин, уникальности свойств и непредсказуемости появления злокачественных опухолей профилактическое использование противоопухолевых вакцин нецелесообразно.
 На ноябрь 2006 г. : Количество публикаций по проблеме — 4918 Клинические испытания — 574 Третья фаза клинических испытаний — 24 Клинически значимые результаты — 5 Противоопухолевые вакцины Эта статистика заставляет задать вопрос, не является ли деятельность по разработке противоопухолевых вакцин борьбой с законами природы?
На ноябрь 2006 г. : Количество публикаций по проблеме — 4918 Клинические испытания — 574 Третья фаза клинических испытаний — 24 Клинически значимые результаты — 5 Противоопухолевые вакцины Эта статистика заставляет задать вопрос, не является ли деятельность по разработке противоопухолевых вакцин борьбой с законами природы?
 Антигены опухолей, которые распознаются цитотоксическими Т-лимфоцитами, выделенными из перечисленных типов опухолей
Антигены опухолей, которые распознаются цитотоксическими Т-лимфоцитами, выделенными из перечисленных типов опухолей
 Антигены опухолей Опухолеспецифические — это классические антигены, в основе возникновения которых лежит генетическая модификация клетки (в результате мутаций, инфициро- вания вирусами, хромосомных транс- локаций и пр. ) Примеры: модифицированные -катенин, CDK 4, P 53, белки вирусов папилломы, герпеса, Эпштейна-Барр, гепатита B , слитые антигены bc r -abl, abl-bcr, pml-RAR и пр. Опухолеассоциированные — нормальные (немутантные) белки, экспрессированные «не в то время и не в том месте» преимущественно на опухолевых клетках. Примеры: дифференцировочные антигены меланом (тирозиназа, gp 100, MART-1/Melan-A, TRP), антигены простаты (PSA/PSMA), муцин ( MUC 1) , HER -2/neu, CEA , — фетопротеин, антигены тестиса и плаценты. Редко являются мишенями противоопухолевых иммунных ответов. Подавляющее большинство антиге-нов, идентифицированных в противо-опухолевых иммунных ответах отно-сятся к этой группе, но иммунный ответ на них получить очень сложно.
Антигены опухолей Опухолеспецифические — это классические антигены, в основе возникновения которых лежит генетическая модификация клетки (в результате мутаций, инфициро- вания вирусами, хромосомных транс- локаций и пр. ) Примеры: модифицированные -катенин, CDK 4, P 53, белки вирусов папилломы, герпеса, Эпштейна-Барр, гепатита B , слитые антигены bc r -abl, abl-bcr, pml-RAR и пр. Опухолеассоциированные — нормальные (немутантные) белки, экспрессированные «не в то время и не в том месте» преимущественно на опухолевых клетках. Примеры: дифференцировочные антигены меланом (тирозиназа, gp 100, MART-1/Melan-A, TRP), антигены простаты (PSA/PSMA), муцин ( MUC 1) , HER -2/neu, CEA , — фетопротеин, антигены тестиса и плаценты. Редко являются мишенями противоопухолевых иммунных ответов. Подавляющее большинство антиге-нов, идентифицированных в противо-опухолевых иммунных ответах отно-сятся к этой группе, но иммунный ответ на них получить очень сложно.
 Чтобы «увидеть» мутантный или аберрантно экспрессированный белок, иммунная система должна иметь возможность «заглянуть» внутрь клетки. Эту функцию выполняют молекулы MHC, способные прочно связаться с пептидами и вынести их на поверхность клетки. Единственными клетками иммунной системы, способными распознать такие комплексы, являются Т-лимфоциты. Их антигенспецифические рецепторы (TCR) реагируют с комплексами молекул MHC и пептидов. Способность TCR реагировать с молекулами MHC является его врожденным свойством.
Чтобы «увидеть» мутантный или аберрантно экспрессированный белок, иммунная система должна иметь возможность «заглянуть» внутрь клетки. Эту функцию выполняют молекулы MHC, способные прочно связаться с пептидами и вынести их на поверхность клетки. Единственными клетками иммунной системы, способными распознать такие комплексы, являются Т-лимфоциты. Их антигенспецифические рецепторы (TCR) реагируют с комплексами молекул MHC и пептидов. Способность TCR реагировать с молекулами MHC является его врожденным свойством.
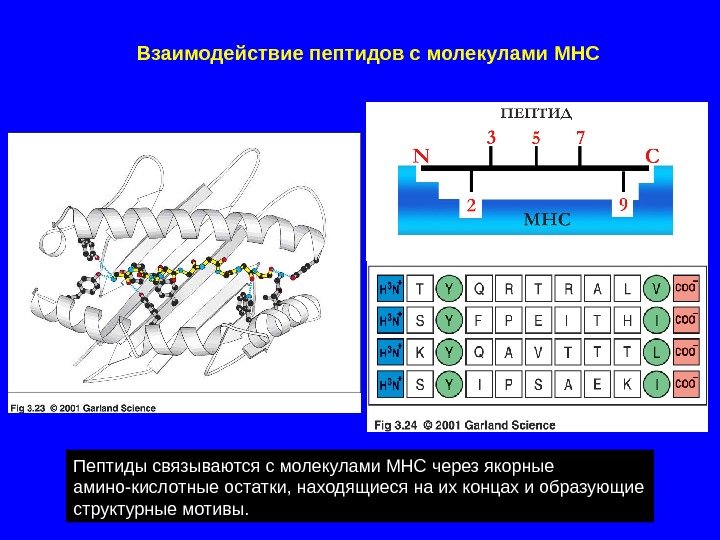
 Пептиды связываются с молекулами MHC через якорные амино-кислотные остатки, находящиеся на их концах и образующие структурные мотивы. Взаимодействие пептидов с молекулами MH
Пептиды связываются с молекулами MHC через якорные амино-кислотные остатки, находящиеся на их концах и образующие структурные мотивы. Взаимодействие пептидов с молекулами MH
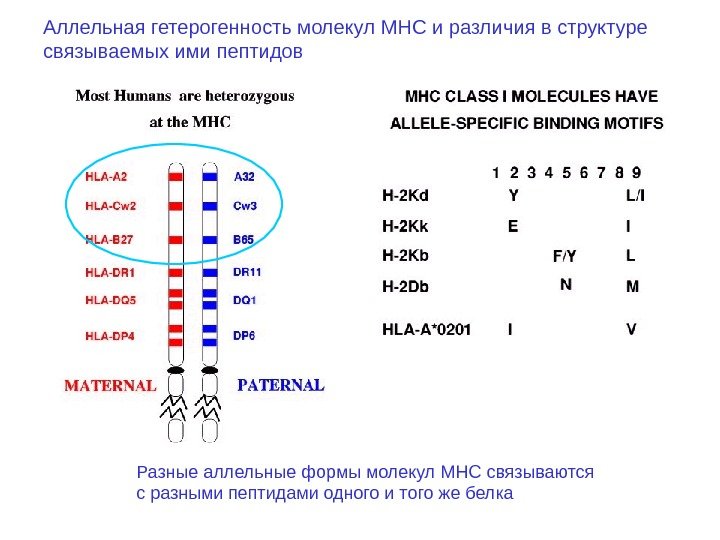
 Разные аллельные формы молекул MHC связываются с разными пептидами одного и того же белка. Аллельная гетерогенность молекул MHC и различия в структуре связываемых ими пептидов
Разные аллельные формы молекул MHC связываются с разными пептидами одного и того же белка. Аллельная гетерогенность молекул MHC и различия в структуре связываемых ими пептидов
 Презентация опухолеспецифических антигенов
Презентация опухолеспецифических антигенов

 MHC- связывающие мотивы в структуре антигенных пептидов показывают центральный механизм генетического ограничения иммунного ответа Не все пептидные эпитопы белковых молекул могут эффективно связаться с молекулами MHC. Это означает, что далеко не все мутации могут быть «видны» иммунной системе, что дает возможность трансформированной клетке ускользнуть от иммунного ответа. Этот же механизм объясняет неэффективность иммунного ответа на некоторые инфекционные патогены, хронизацию и развитие носительства у части популяции. Он же лежит в основе неотвечаемости на вакцины, в особенности на монокомпонентные и пептидные вакцины. Модификация пептидных эпитопов и исчезновение структурных мотивов в результате мутаций неоднократно показаны в исследованиях взаимо- действия вирусов с иммунной системой хозяина.
MHC- связывающие мотивы в структуре антигенных пептидов показывают центральный механизм генетического ограничения иммунного ответа Не все пептидные эпитопы белковых молекул могут эффективно связаться с молекулами MHC. Это означает, что далеко не все мутации могут быть «видны» иммунной системе, что дает возможность трансформированной клетке ускользнуть от иммунного ответа. Этот же механизм объясняет неэффективность иммунного ответа на некоторые инфекционные патогены, хронизацию и развитие носительства у части популяции. Он же лежит в основе неотвечаемости на вакцины, в особенности на монокомпонентные и пептидные вакцины. Модификация пептидных эпитопов и исчезновение структурных мотивов в результате мутаций неоднократно показаны в исследованиях взаимо- действия вирусов с иммунной системой хозяина.
 MCA Опухоли. Иммунологический надзор — селекция неиммуногенных вариантов опухолей
MCA Опухоли. Иммунологический надзор — селекция неиммуногенных вариантов опухолей
 Dunn G. P. Et al. ,
Dunn G. P. Et al. ,
 Иммунологический надзор у человека Свидетельства в пользу существования иммунологического надзора у человека: 1) Пациенты с иммуносупрессией 2) Пациенты с первичными иммунодефицитами 3) Пациенты с трансплантированными органами 4) Есть положительная корредяция между количеством TIL в опухолях и выживаним пациентов
Иммунологический надзор у человека Свидетельства в пользу существования иммунологического надзора у человека: 1) Пациенты с иммуносупрессией 2) Пациенты с первичными иммунодефицитами 3) Пациенты с трансплантированными органами 4) Есть положительная корредяция между количеством TIL в опухолях и выживаним пациентов
 Множество путей, которыми опухолевые клетки избегают отторжения
Множество путей, которыми опухолевые клетки избегают отторжения
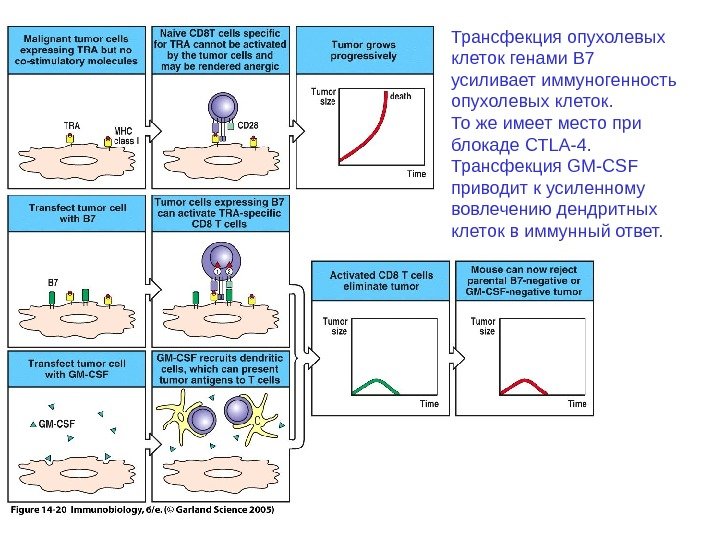
 Трансфекция опухолевых клеток генами B 7 усиливает иммуногенность опухолевых клеток. То же имеет место при блокаде CTLA-4. Трансфекция GM-CSF приводит к усиленному вовлечению дендритных клеток в иммунный ответ.
Трансфекция опухолевых клеток генами B 7 усиливает иммуногенность опухолевых клеток. То же имеет место при блокаде CTLA-4. Трансфекция GM-CSF приводит к усиленному вовлечению дендритных клеток в иммунный ответ.
 Утрата экспрессии молекул MHC клетками рака простаты
Утрата экспрессии молекул MHC клетками рака простаты
 Опухолевые клетки, утратившие экспрессию молекул MHC класса I, чтобы обойти иммунный надзор, становятся более чувствительными к лизису NK- клетками.
Опухолевые клетки, утратившие экспрессию молекул MHC класса I, чтобы обойти иммунный надзор, становятся более чувствительными к лизису NK- клетками.
 Селекция опухолевых клеток делает иммунологический надзор неэффективным Dunn G. P. Et al. ,
Селекция опухолевых клеток делает иммунологический надзор неэффективным Dunn G. P. Et al. ,
 “ Antitumor immunity is beneficial autoimmunity” (Hans Stauss, 2004)Подавляющее большинство идентифицированных опухолевых антигенов происходит из нормальных немутантных белков организма.
“ Antitumor immunity is beneficial autoimmunity” (Hans Stauss, 2004)Подавляющее большинство идентифицированных опухолевых антигенов происходит из нормальных немутантных белков организма.
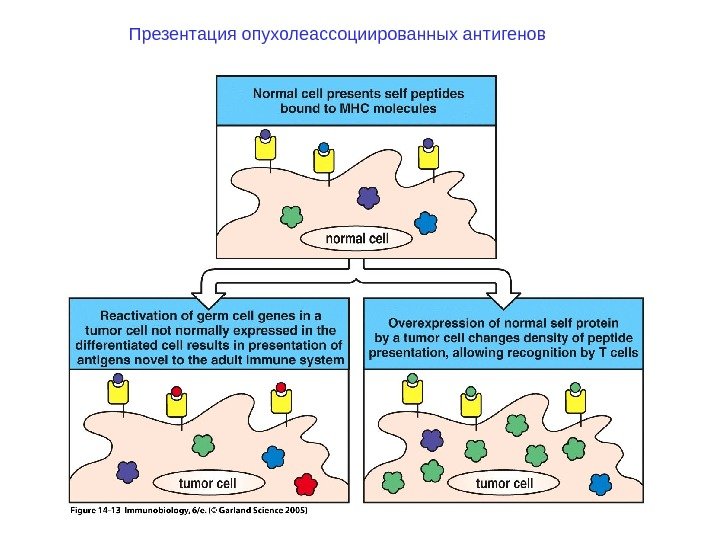
 Презентация опухолеассоциированных антигенов
Презентация опухолеассоциированных антигенов
 Ген AIRE — регулятор аутоиммунитета — протеин с м. м. 58 k. Da , регулирует экспрессию ~ 1200 генов. Экспрессируется в клетках медуллярного эпителия тимуса, репродуктивных органах и периферической лимфоидной ткани. У животных с мутантным AIRE развивается характерный синдром — аутоиммунная полиэндокринопатия. У человека — аутоиммунный полигландулярный синдром типа 1 (АПГС) с характерной триадой — надпочечниковая недостаточность, слизисто-кожный кандидоз и гипопаратиреоз, которой часто сопутствуют патологии других органов и систем. В клетках медуллярного эпителия тимуса AIRE вызывает неразборчивую автономную экспрессию широкого ряда тканеспецифических и стадиоспецифических белков, включая некоторые известные опухолеассоциированные антигены. Эта экспрессия необходима для устранения аутореактивных клонов Т-клеток и формирует иммунологическую толерантность к «своему» .
Ген AIRE — регулятор аутоиммунитета — протеин с м. м. 58 k. Da , регулирует экспрессию ~ 1200 генов. Экспрессируется в клетках медуллярного эпителия тимуса, репродуктивных органах и периферической лимфоидной ткани. У животных с мутантным AIRE развивается характерный синдром — аутоиммунная полиэндокринопатия. У человека — аутоиммунный полигландулярный синдром типа 1 (АПГС) с характерной триадой — надпочечниковая недостаточность, слизисто-кожный кандидоз и гипопаратиреоз, которой часто сопутствуют патологии других органов и систем. В клетках медуллярного эпителия тимуса AIRE вызывает неразборчивую автономную экспрессию широкого ряда тканеспецифических и стадиоспецифических белков, включая некоторые известные опухолеассоциированные антигены. Эта экспрессия необходима для устранения аутореактивных клонов Т-клеток и формирует иммунологическую толерантность к «своему» .
 Первая и, возможно, наиболее важная задача, которая стоит перед иммунной системой – это задача разрешить трансплантационный конфликт с организмом, в котором она развивается. Сегрегация потенциально разрушительного иммунного ответа на нескольких типах молекул (классических молекул MHC), презентирующих антигены в виде коротких пептидов, позволила «вывести из-под удара» иммунной системы функциональные конформационные эпитопы жизненно важных белков организма и избавило ее от необходимости формирования толерантности ко всему их разнообразию. Способность TCR реагировать с молекулами MHC- рестриктированное распознавание являются его врожденными свойствами, которые обеспечивают эффективную делецию аутореактивных Т-лимфоцитов и индукцию толерантности. «Побочным» эффектом является феномен аллореактивности — способности репертуара усиленно реагировать с чужеродными молекулами MHC.
Первая и, возможно, наиболее важная задача, которая стоит перед иммунной системой – это задача разрешить трансплантационный конфликт с организмом, в котором она развивается. Сегрегация потенциально разрушительного иммунного ответа на нескольких типах молекул (классических молекул MHC), презентирующих антигены в виде коротких пептидов, позволила «вывести из-под удара» иммунной системы функциональные конформационные эпитопы жизненно важных белков организма и избавило ее от необходимости формирования толерантности ко всему их разнообразию. Способность TCR реагировать с молекулами MHC- рестриктированное распознавание являются его врожденными свойствами, которые обеспечивают эффективную делецию аутореактивных Т-лимфоцитов и индукцию толерантности. «Побочным» эффектом является феномен аллореактивности — способности репертуара усиленно реагировать с чужеродными молекулами MHC.
 Зависимость выживания Т-лимфоцитов от интенсивности сигнала, получаемого в ходе развития внутри тимуса
Зависимость выживания Т-лимфоцитов от интенсивности сигнала, получаемого в ходе развития внутри тимуса
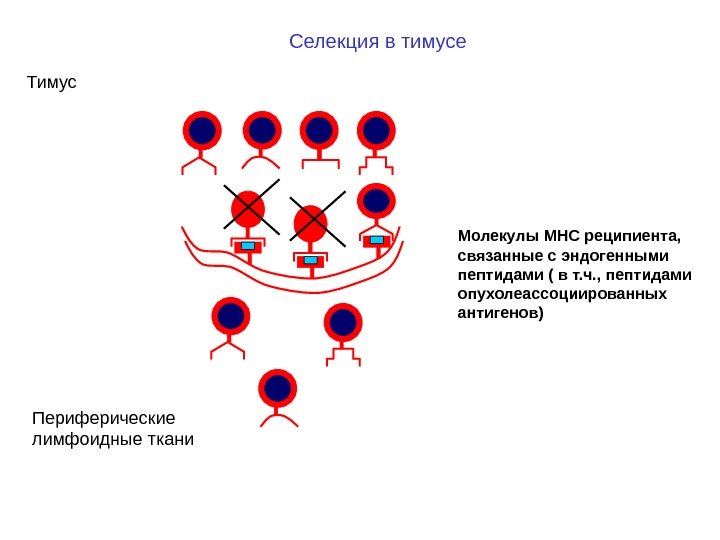
 Тимус Периферические лимфоидные ткани Молекулы MHC реципиента, связанные с эндогенными пептидами ( в т. ч. , пептидами опухолеассоциированных антигенов)Селекция в тимусе
Тимус Периферические лимфоидные ткани Молекулы MHC реципиента, связанные с эндогенными пептидами ( в т. ч. , пептидами опухолеассоциированных антигенов)Селекция в тимусе
 Тимус Периферические лимфоидные ткани Как должны работать противоопухолевые вакцины Так это пытаются делать сейчас: Как это должно быть: опухолевые клетки
Тимус Периферические лимфоидные ткани Как должны работать противоопухолевые вакцины Так это пытаются делать сейчас: Как это должно быть: опухолевые клетки
 Причины малой эффективности существующих методов иммунотерапии опухолей 1. Иммунологический надзор устраняет иммуногенные варианты опухолевых клеток, которые иммунная система может увидеть как “чужие”. Поэтому, стимулируя противоопухолевый иммунитет на опухолеспецифические антигены, мы пытаемся “выиграть в сражении”, которое иммунологический надзор уже “проиграл”. Мы пытаемся выстрелить в отсутствующую мишень — опухолевые клетки, экспрессирующие истинные мутантные антигены. 2. Внутритимусная селекция устраняет клоны Т-лимфоцитов, специфичные к нормальным немутантным белкам организма, включая опухолеассоциированные антигены. Поэтому, стимулируя противоопухолевый иммунитет на опухолеассоциированные антигены, мы пытаемся выстрелить из незаряженного оружия и стимулировать ответ Т-лимфоцитов, специфичных к “своему” , которых в организме нет. Возможные пути преодоления: 1) перенос пациенту Т-лимфоцитов нужной специфичности 2) трансдукция Т-лимфоцитов пациента Т-рецепторами нужной специфичности 3) подавление негативной селекции нужных Т-лимфоцитов
Причины малой эффективности существующих методов иммунотерапии опухолей 1. Иммунологический надзор устраняет иммуногенные варианты опухолевых клеток, которые иммунная система может увидеть как “чужие”. Поэтому, стимулируя противоопухолевый иммунитет на опухолеспецифические антигены, мы пытаемся “выиграть в сражении”, которое иммунологический надзор уже “проиграл”. Мы пытаемся выстрелить в отсутствующую мишень — опухолевые клетки, экспрессирующие истинные мутантные антигены. 2. Внутритимусная селекция устраняет клоны Т-лимфоцитов, специфичные к нормальным немутантным белкам организма, включая опухолеассоциированные антигены. Поэтому, стимулируя противоопухолевый иммунитет на опухолеассоциированные антигены, мы пытаемся выстрелить из незаряженного оружия и стимулировать ответ Т-лимфоцитов, специфичных к “своему” , которых в организме нет. Возможные пути преодоления: 1) перенос пациенту Т-лимфоцитов нужной специфичности 2) трансдукция Т-лимфоцитов пациента Т-рецепторами нужной специфичности 3) подавление негативной селекции нужных Т-лимфоцитов
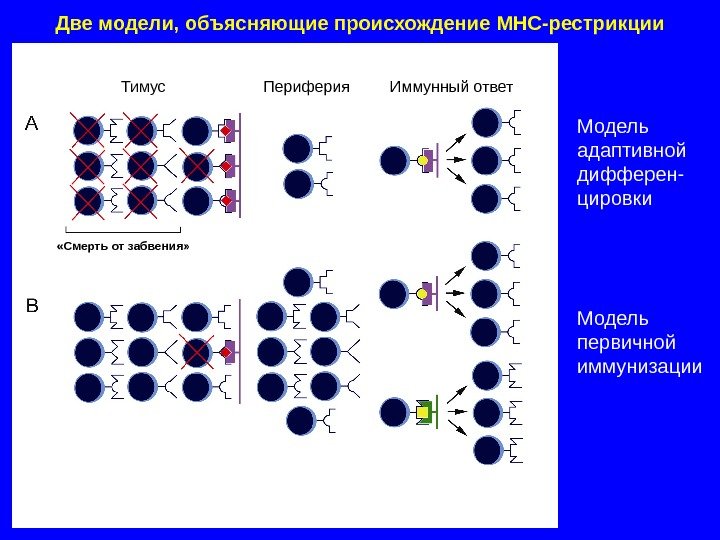
 Две модели, объясняющие происхождение MHC- рестрикции Модель адаптивной дифферен- цировки Модель первичной иммунизации. Тимус Периферия Иммунный ответ «Смерть от забвения»
Две модели, объясняющие происхождение MHC- рестрикции Модель адаптивной дифферен- цировки Модель первичной иммунизации. Тимус Периферия Иммунный ответ «Смерть от забвения»
 Принцип аллорестриктированного распознавания Периферические лимфоидные ткани 1 опухолевые клетки 1 Тимус 1 Периферические лимфоидные ткани 2 Тимус
Принцип аллорестриктированного распознавания Периферические лимфоидные ткани 1 опухолевые клетки 1 Тимус 1 Периферические лимфоидные ткани 2 Тимус
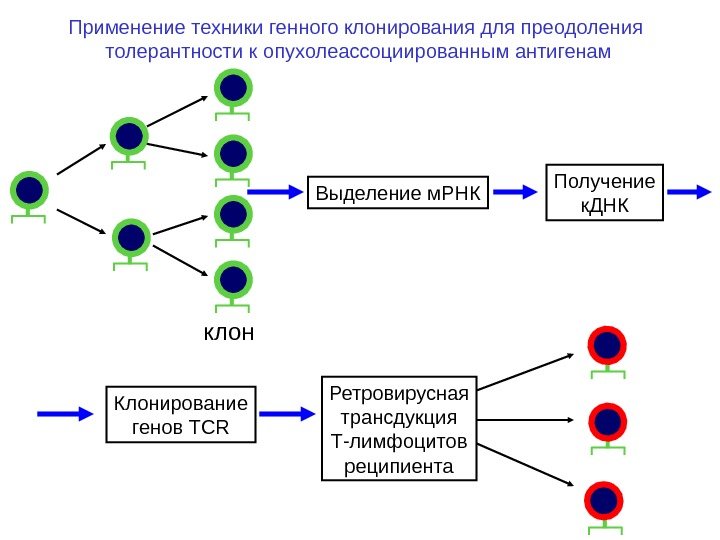
 клон Выделение м. РНК Получение к. ДНК Клонирование генов TCR Ретровирусная трансдукция Т-лимфоцитов реципиента. Применение техники генного клонирования для преодоления толерантности к опухолеассоциированным антигенам
клон Выделение м. РНК Получение к. ДНК Клонирование генов TCR Ретровирусная трансдукция Т-лимфоцитов реципиента. Применение техники генного клонирования для преодоления толерантности к опухолеассоциированным антигенам
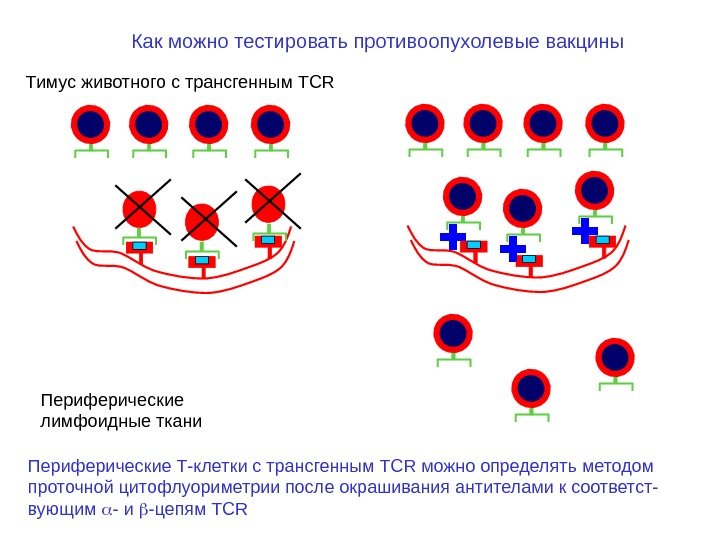
 Тимус животного с трансгенным TCR Периферические лимфоидные ткани Как можно тестировать противоопухолевые вакцины Периферические Т-клетки с трансгенным TCR можно определять методом проточной цитофлуориметрии после окрашивания антителами к соответст- вующим — и — цепям TCR
Тимус животного с трансгенным TCR Периферические лимфоидные ткани Как можно тестировать противоопухолевые вакцины Периферические Т-клетки с трансгенным TCR можно определять методом проточной цитофлуориметрии после окрашивания антителами к соответст- вующим — и — цепям TCR
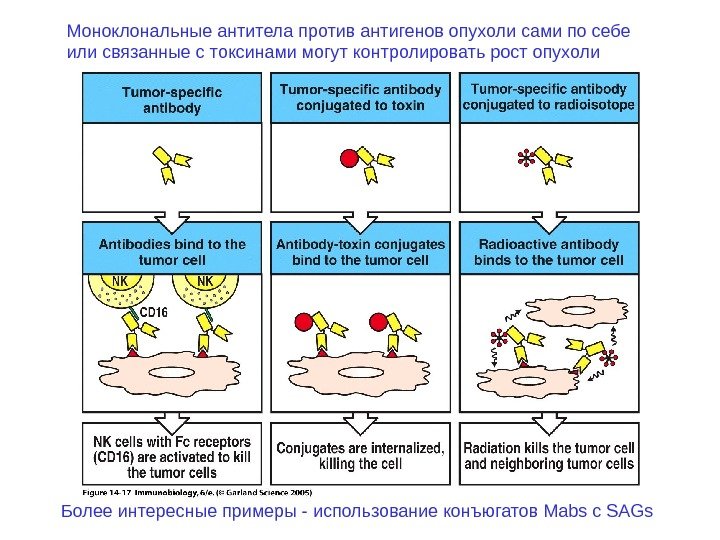
 Моноклональные антитела против антигенов опухоли сами по себе или связанные с токсинами могут контролировать рост опухоли Более интересные примеры — использование конъюгатов Mabs с SAGs
Моноклональные антитела против антигенов опухоли сами по себе или связанные с токсинами могут контролировать рост опухоли Более интересные примеры — использование конъюгатов Mabs с SAGs
 Опухолевые антигены, являющиеся подходящими мишенями для терапии моноклональными антителами
Опухолевые антигены, являющиеся подходящими мишенями для терапии моноклональными антителами
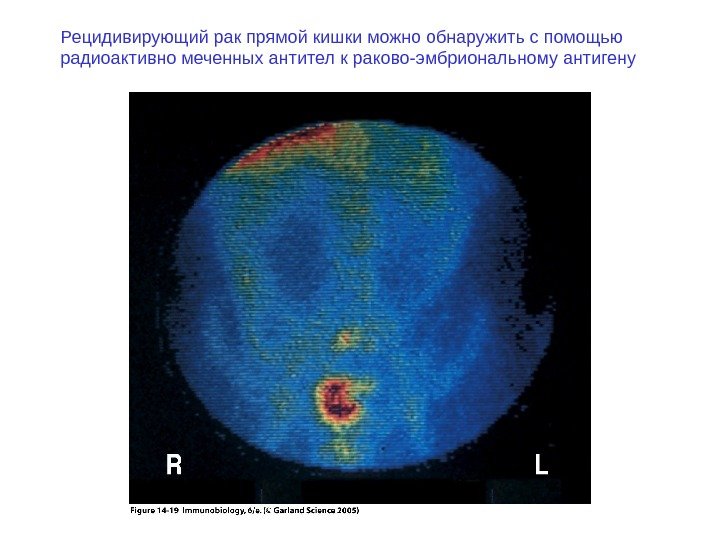
 Рецидивирующий рак прямой кишки можно обнаружить с помощью радиоактивно меченных антител к раково-эмбриональному антигену
Рецидивирующий рак прямой кишки можно обнаружить с помощью радиоактивно меченных антител к раково-эмбриональному антигену
