Лекция 14 Литий-ионные источники тока.ppt
- Количество слайдов: 52
 Cовременное состояние и тенденции развития литий-ионных аккумуляторов Н. В. Косова Институт химии твердого тела и механохимии СО РАН
Cовременное состояние и тенденции развития литий-ионных аккумуляторов Н. В. Косова Институт химии твердого тела и механохимии СО РАН
 Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
 Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
 Химические источники тока. Историческая справка Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Дэниеля» . Вольтов столб В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) Mn. O 2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
Химические источники тока. Историческая справка Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Дэниеля» . Вольтов столб В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) Mn. O 2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
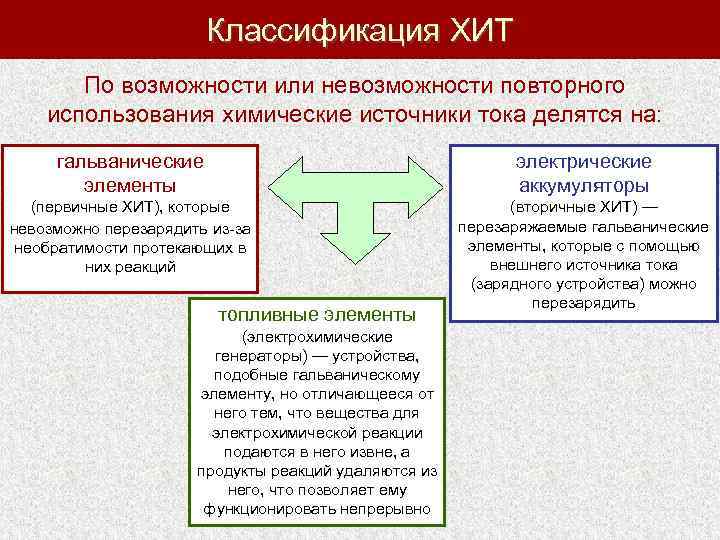 Классификация ХИТ По возможности или невозможности повторного использования химические источники тока делятся на: гальванические элементы электрические аккумуляторы (первичные ХИТ), которые невозможно перезарядить из-за необратимости протекающих в них реакций (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно
Классификация ХИТ По возможности или невозможности повторного использования химические источники тока делятся на: гальванические элементы электрические аккумуляторы (первичные ХИТ), которые невозможно перезарядить из-за необратимости протекающих в них реакций (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно
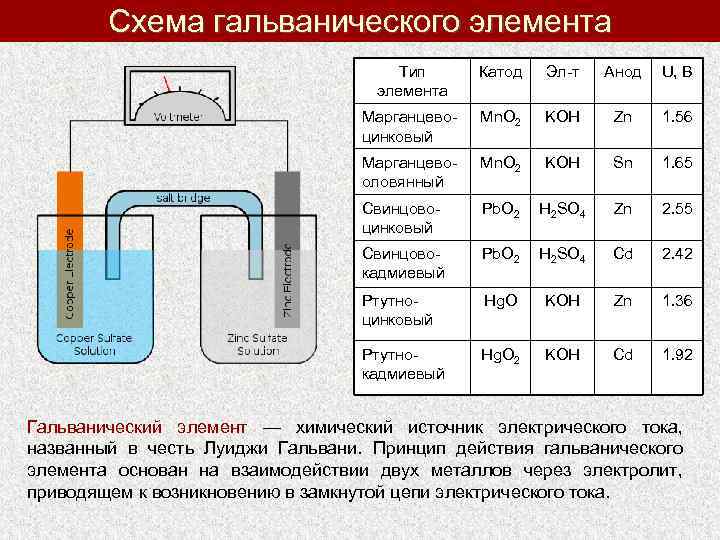 Схема гальванического элемента Тип элемента Катод Эл-т Анод U, В Марганцевоцинковый Mn. O 2 KOH Zn 1. 56 Марганцевооловянный Mn. O 2 KOH Sn 1. 65 Свинцовоцинковый Pb. O 2 H 2 SO 4 Zn 2. 55 Свинцовокадмиевый Pb. O 2 H 2 SO 4 Cd 2. 42 Ртутноцинковый Hg. O KOH Zn 1. 36 Ртутнокадмиевый Hg. O 2 KOH Cd 1. 92 Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
Схема гальванического элемента Тип элемента Катод Эл-т Анод U, В Марганцевоцинковый Mn. O 2 KOH Zn 1. 56 Марганцевооловянный Mn. O 2 KOH Sn 1. 65 Свинцовоцинковый Pb. O 2 H 2 SO 4 Zn 2. 55 Свинцовокадмиевый Pb. O 2 H 2 SO 4 Cd 2. 42 Ртутноцинковый Hg. O KOH Zn 1. 36 Ртутнокадмиевый Hg. O 2 KOH Cd 1. 92 Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
 Электрические аккумуляторы Тип Реакция ЭДС (В) Свинцово-кислотные (Lead Acid) Pb. O 2+Pb+2 H 2 SO 4 ↔ 2 Pb. SO 4+2 H 2 O 2, 1 1/2 Cd+Ni. OH+H 2 O ↔ 1/2 Cd(OH)2+Ni(OH)2 Троллейбусы, трамваи, воздушные суда, автомобили, мотоциклы, электропогрузчики, электротягачи, аварийное электроснабжение, источники бесперебойного питания 1, 2 Замена стандартного гальванического элемента, строительные электроинструменты, троллейбусы, воздушные суда 1, 2 Замена стандартного гальванического элемента, электромобили 3, 7 Мобильные устройства, строительные электроинструменты, электромобили 3, 7 Мобильные устройства, электромобили Никель-кадмиевые (Ni. Cd) Никель-металлгидридные (Ni. MH) Литий-ионные (Li‑ion) Литий-полимерные (Li‑pol) Ni. OOH+MH ↔ Ni(OH)2+M Li. Co. O 2+6 C ↔ Li. C 6+Co. O 2 Область применения Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
Электрические аккумуляторы Тип Реакция ЭДС (В) Свинцово-кислотные (Lead Acid) Pb. O 2+Pb+2 H 2 SO 4 ↔ 2 Pb. SO 4+2 H 2 O 2, 1 1/2 Cd+Ni. OH+H 2 O ↔ 1/2 Cd(OH)2+Ni(OH)2 Троллейбусы, трамваи, воздушные суда, автомобили, мотоциклы, электропогрузчики, электротягачи, аварийное электроснабжение, источники бесперебойного питания 1, 2 Замена стандартного гальванического элемента, строительные электроинструменты, троллейбусы, воздушные суда 1, 2 Замена стандартного гальванического элемента, электромобили 3, 7 Мобильные устройства, строительные электроинструменты, электромобили 3, 7 Мобильные устройства, электромобили Никель-кадмиевые (Ni. Cd) Никель-металлгидридные (Ni. MH) Литий-ионные (Li‑ion) Литий-полимерные (Li‑pol) Ni. OOH+MH ↔ Ni(OH)2+M Li. Co. O 2+6 C ↔ Li. C 6+Co. O 2 Область применения Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
 Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
 Литий • Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li, Na)[Si 4 Al. O 10], а затем в сподумене Li. Al[Si 2 O 6] и в лепидолите KLi 1. 5 Al 1. 5[Si 3 Al. O 10](F, OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году. • Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион» , современное название было предложено Берцелиусом. Г. Дэви Литиевые гальванические элементы с апротонным электролитом появились в 1970 -х годах. Была реализована давняя идея исследователей – создать ХИТ с наиболее активным восстановителем – щелочным металлом. Это позволило резко увеличить как рабочее напряжение ХИТ, так и его удельную энергию.
Литий • Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li, Na)[Si 4 Al. O 10], а затем в сподумене Li. Al[Si 2 O 6] и в лепидолите KLi 1. 5 Al 1. 5[Si 3 Al. O 10](F, OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году. • Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион» , современное название было предложено Берцелиусом. Г. Дэви Литиевые гальванические элементы с апротонным электролитом появились в 1970 -х годах. Была реализована давняя идея исследователей – создать ХИТ с наиболее активным восстановителем – щелочным металлом. Это позволило резко увеличить как рабочее напряжение ХИТ, так и его удельную энергию.
 Литий-ионные аккумуляторы
Литий-ионные аккумуляторы
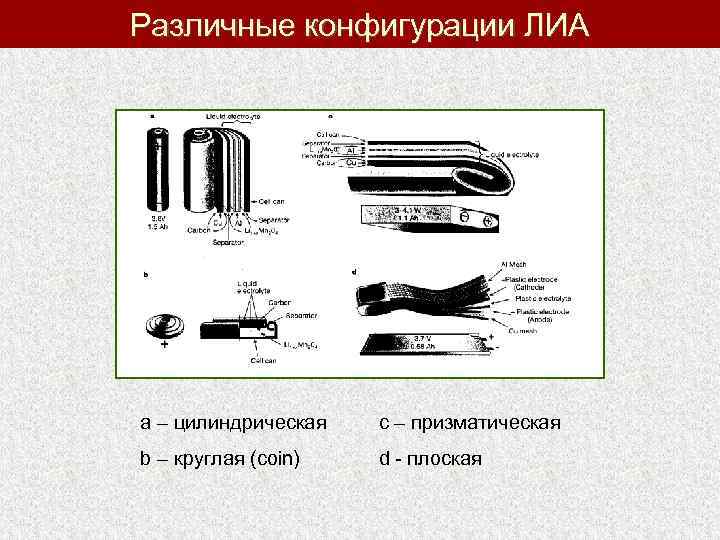 Различные конфигурации ЛИА a – цилиндрическая с – призматическая b – круглая (coin) d - плоская
Различные конфигурации ЛИА a – цилиндрическая с – призматическая b – круглая (coin) d - плоская
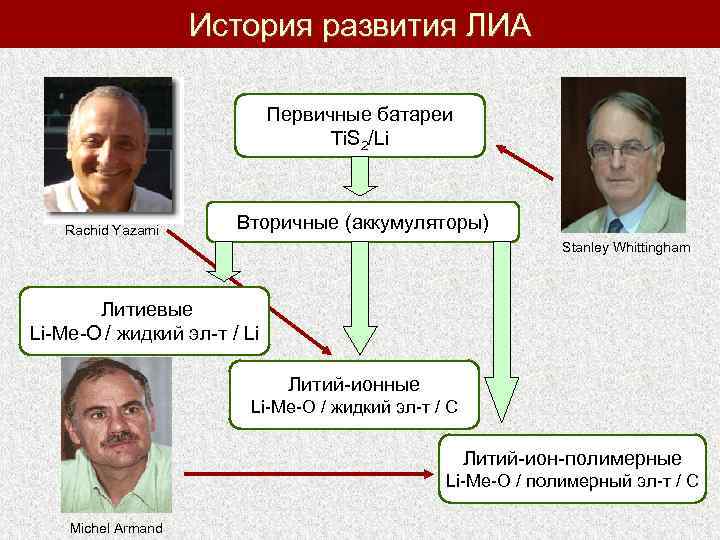 История развития ЛИА Первичные батареи Ti. S 2/Li Rachid Yazami Вторичные (аккумуляторы) Stanley Whittingham Литиевые Li-Me-O / жидкий эл-т / Li Литий-ионные Li-Me-O / жидкий эл-т / С Литий-ион-полимерные Li-Me-O / полимерный эл-т / С Michel Armand
История развития ЛИА Первичные батареи Ti. S 2/Li Rachid Yazami Вторичные (аккумуляторы) Stanley Whittingham Литиевые Li-Me-O / жидкий эл-т / Li Литий-ионные Li-Me-O / жидкий эл-т / С Литий-ион-полимерные Li-Me-O / полимерный эл-т / С Michel Armand
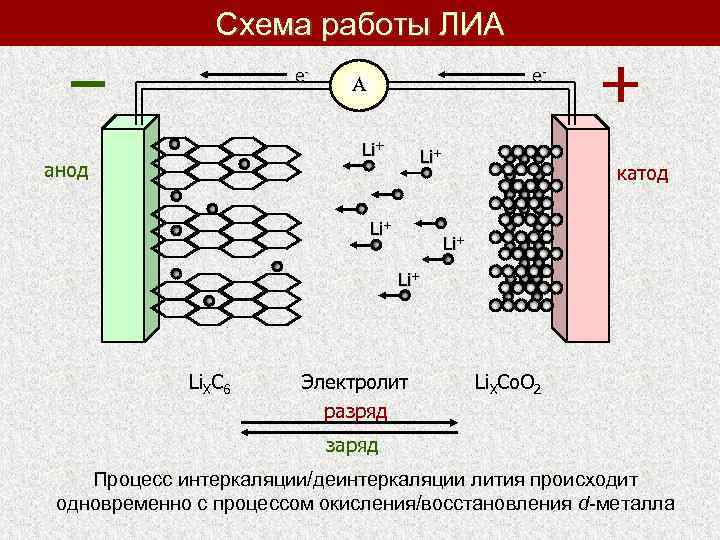 Схема работы ЛИА е- е- А Li+ анод Li+ катод Li+ Li. XC 6 Электролит разряд Li. XCo. O 2 заряд Процесс интеркаляции/деинтеркаляции лития происходит одновременно с процессом окисления/восстановления d-металла
Схема работы ЛИА е- е- А Li+ анод Li+ катод Li+ Li. XC 6 Электролит разряд Li. XCo. O 2 заряд Процесс интеркаляции/деинтеркаляции лития происходит одновременно с процессом окисления/восстановления d-металла
 Электрохимическая интеркаляция – обратимое внедрение ионов или молекул ( «гостей» ) в вещества ( «хозяева» ), имеющие слоистую, туннельную или канальную структуру, происходящее под действием электрического тока. Заряд: деинтеркаляция ионов Li из катода с образованием вакансий + окисление d-ионов Напряжение разомкнутой цепи UНРЗ = φкатода – φанода При протекании тока (I = const) U = UНРЗ + ΔU I = const Li. Co. O 2+6 C ↔ Li. C 6+Co. O 2 ΔU – поляризация ячейки (поляризация катода + поляризация анода + омическое сопротивление, обусловленное вкладом электролита – SEI) Электрохимическая емкость: Q = z. Fm/M, F=96500 А*сек / мол z – величина переносимого заряда F – число Фарадея Разряд: интеркаляция ионов Li в катод + восстановление d-ионов m – масса вещества M – молярная масса вещества
Электрохимическая интеркаляция – обратимое внедрение ионов или молекул ( «гостей» ) в вещества ( «хозяева» ), имеющие слоистую, туннельную или канальную структуру, происходящее под действием электрического тока. Заряд: деинтеркаляция ионов Li из катода с образованием вакансий + окисление d-ионов Напряжение разомкнутой цепи UНРЗ = φкатода – φанода При протекании тока (I = const) U = UНРЗ + ΔU I = const Li. Co. O 2+6 C ↔ Li. C 6+Co. O 2 ΔU – поляризация ячейки (поляризация катода + поляризация анода + омическое сопротивление, обусловленное вкладом электролита – SEI) Электрохимическая емкость: Q = z. Fm/M, F=96500 А*сек / мол z – величина переносимого заряда F – число Фарадея Разряд: интеркаляция ионов Li в катод + восстановление d-ионов m – масса вещества M – молярная масса вещества
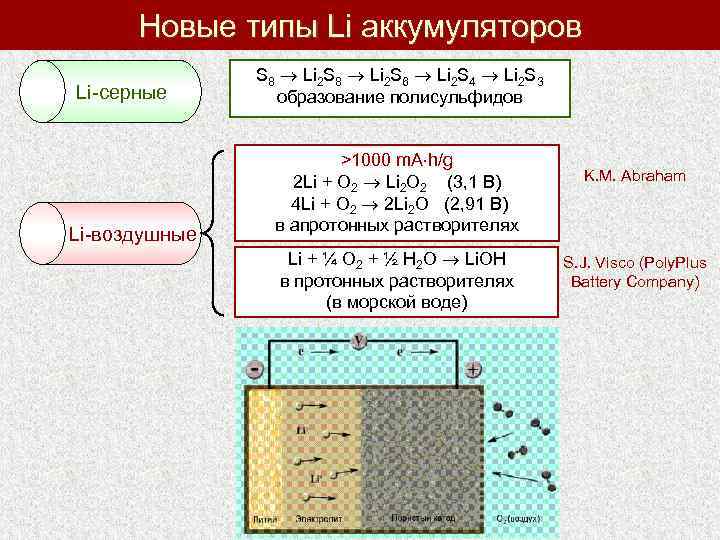 Новые типы Li аккумуляторов Li-серные Li-воздушные S 8 Li 2 S 6 Li 2 S 4 Li 2 S 3 образование полисульфидов >1000 m. A h/g 2 Li + O 2 Li 2 O 2 (3, 1 В) 4 Li + O 2 2 Li 2 O (2, 91 В) в апротонных растворителях Li + ¼ O 2 + ½ H 2 O Li. OH в протонных растворителях (в морской воде) K. M. Abraham S. J. Visco (Poly. Plus Battery Company)
Новые типы Li аккумуляторов Li-серные Li-воздушные S 8 Li 2 S 6 Li 2 S 4 Li 2 S 3 образование полисульфидов >1000 m. A h/g 2 Li + O 2 Li 2 O 2 (3, 1 В) 4 Li + O 2 2 Li 2 O (2, 91 В) в апротонных растворителях Li + ¼ O 2 + ½ H 2 O Li. OH в протонных растворителях (в морской воде) K. M. Abraham S. J. Visco (Poly. Plus Battery Company)
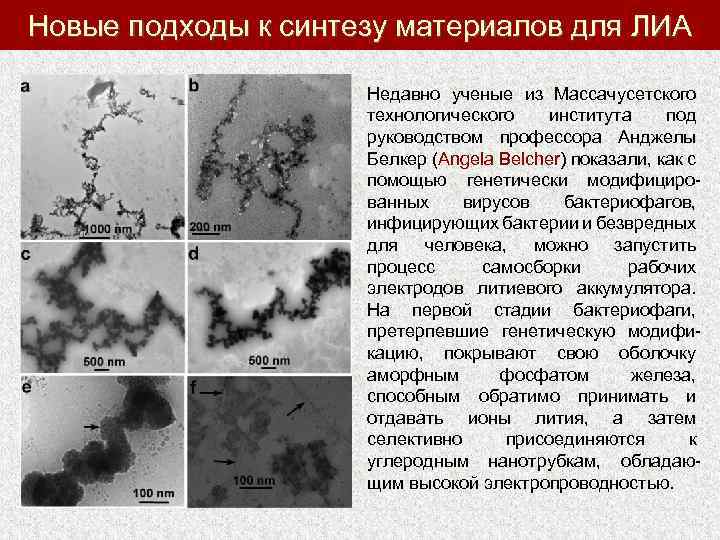 Новые подходы к синтезу материалов для ЛИА Недавно ученые из Массачусетского технологического института под руководством профессора Анджелы Белкер (Angela Belcher) показали, как с помощью генетически модифицированных вирусов бактериофагов, инфицирующих бактерии и безвредных для человека, можно запустить процесс самосборки рабочих электродов литиевого аккумулятора. На первой стадии бактериофаги, претерпевшие генетическую модификацию, покрывают свою оболочку аморфным фосфатом железа, способным обратимо принимать и отдавать ионы лития, а затем селективно присоединяются к углеродным нанотрубкам, обладающим высокой электропроводностью.
Новые подходы к синтезу материалов для ЛИА Недавно ученые из Массачусетского технологического института под руководством профессора Анджелы Белкер (Angela Belcher) показали, как с помощью генетически модифицированных вирусов бактериофагов, инфицирующих бактерии и безвредных для человека, можно запустить процесс самосборки рабочих электродов литиевого аккумулятора. На первой стадии бактериофаги, претерпевшие генетическую модификацию, покрывают свою оболочку аморфным фосфатом железа, способным обратимо принимать и отдавать ионы лития, а затем селективно присоединяются к углеродным нанотрубкам, обладающим высокой электропроводностью.
 Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
 Джон Гуденаф Монографии: • Magnetism and the Chemical Bond • Les oxydes métaux de transition Катодные материалы для ЛИА: Li. Co. O 2: K. Mizushima, P. C. Jones, P. J. Wiceman, J. B. Goodenough // Mater. Res. Bull. 15 (1980) 783. Li. Fe. PO 4: K. Padhi, K. S. Nanjundaswamy, J. B. Goodenough // J. Electrochem. Soc. 144 (1997) 1188.
Джон Гуденаф Монографии: • Magnetism and the Chemical Bond • Les oxydes métaux de transition Катодные материалы для ЛИА: Li. Co. O 2: K. Mizushima, P. C. Jones, P. J. Wiceman, J. B. Goodenough // Mater. Res. Bull. 15 (1980) 783. Li. Fe. PO 4: K. Padhi, K. S. Nanjundaswamy, J. B. Goodenough // J. Electrochem. Soc. 144 (1997) 1188.
 Электродные материалы John Goodenough Michael Thackeray Claude Delmas Li. Co. Mn. O 4 Li. Co. O 2 Li. V 6 O 13 Li 4 Ti 5 O 12 Li. Ni 0. 5 Mn 1. 5 O 4 Li. Mn 2 O 4 Li. Ni. O 2 Li. Fe. PO 4 Li. Fe 2(SO 4)3 катоды Li. XTi. S 2 Li. Al Li. X graphite Li Jean-Marie Tarascon Li. X coke аноды
Электродные материалы John Goodenough Michael Thackeray Claude Delmas Li. Co. Mn. O 4 Li. Co. O 2 Li. V 6 O 13 Li 4 Ti 5 O 12 Li. Ni 0. 5 Mn 1. 5 O 4 Li. Mn 2 O 4 Li. Ni. O 2 Li. Fe. PO 4 Li. Fe 2(SO 4)3 катоды Li. XTi. S 2 Li. Al Li. X graphite Li Jean-Marie Tarascon Li. X coke аноды
 Катодные материалы Катодный материал Li. Co. O 2 Li. Mn 2 O 4 Li. Ni. O 2 Li. Fe. PO 4 Li 2 Fe. PO 4 F Li. Co 1/3 Ni 1/3 Mn 1/3 O 2 Li(Lia. Nix. Mny. Coz)O 2 Среднее напряжение, В Удельная емкость, м. А ч/г Удельная энергия, к. Вт ч/кг 3. 7 4. 0 3. 5 3. 3 3. 6 4. 2 140 100 180 150 115 160 220 0. 518 0. 400 0. 630 0. 495 0. 414 0. 576 0. 920 Энергия аккумулятора (Вт ч) W = U I τ = Q U Мощность аккумулятора (Вт) P = I U
Катодные материалы Катодный материал Li. Co. O 2 Li. Mn 2 O 4 Li. Ni. O 2 Li. Fe. PO 4 Li 2 Fe. PO 4 F Li. Co 1/3 Ni 1/3 Mn 1/3 O 2 Li(Lia. Nix. Mny. Coz)O 2 Среднее напряжение, В Удельная емкость, м. А ч/г Удельная энергия, к. Вт ч/кг 3. 7 4. 0 3. 5 3. 3 3. 6 4. 2 140 100 180 150 115 160 220 0. 518 0. 400 0. 630 0. 495 0. 414 0. 576 0. 920 Энергия аккумулятора (Вт ч) W = U I τ = Q U Мощность аккумулятора (Вт) P = I U
 Требования к электродным материалам • Способность к обратимой интеркаляции ионов лития Li. Co. O 2 Li. Mn 2 O 4 Li. Fe. PO 4 – слоистая структура, 2 D каналы для диффузии лития 2 D – шпинельная структура, 3 D каналы 3 D – каркасная структура, 1 D каналы 1 D • Смешанная электронно-ионная проводимость, обеспечивающая высокую скорость интеркаляции ионов лития Li. Co. O 2 - 10 -2 См/см Li. Mn 2 O 4 - 10 -6 См/см Li. Fe. PO 4 - 10 -9 См/см • Химическая устойчивость при циклировании Li. Co. O 2 - с электролитом с образованием плохопроводящих поверхностных соединений при U>4. 3 В Li. Mn 2 O 4 - растворение в электролите при повышенных температурах Mn 3+ (тв) Mn 4+ (тв) + Mn 2+ (р-р) Li. Fe. PO 4 - высокая химическая устойчивость
Требования к электродным материалам • Способность к обратимой интеркаляции ионов лития Li. Co. O 2 Li. Mn 2 O 4 Li. Fe. PO 4 – слоистая структура, 2 D каналы для диффузии лития 2 D – шпинельная структура, 3 D каналы 3 D – каркасная структура, 1 D каналы 1 D • Смешанная электронно-ионная проводимость, обеспечивающая высокую скорость интеркаляции ионов лития Li. Co. O 2 - 10 -2 См/см Li. Mn 2 O 4 - 10 -6 См/см Li. Fe. PO 4 - 10 -9 См/см • Химическая устойчивость при циклировании Li. Co. O 2 - с электролитом с образованием плохопроводящих поверхностных соединений при U>4. 3 В Li. Mn 2 O 4 - растворение в электролите при повышенных температурах Mn 3+ (тв) Mn 4+ (тв) + Mn 2+ (р-р) Li. Fe. PO 4 - высокая химическая устойчивость
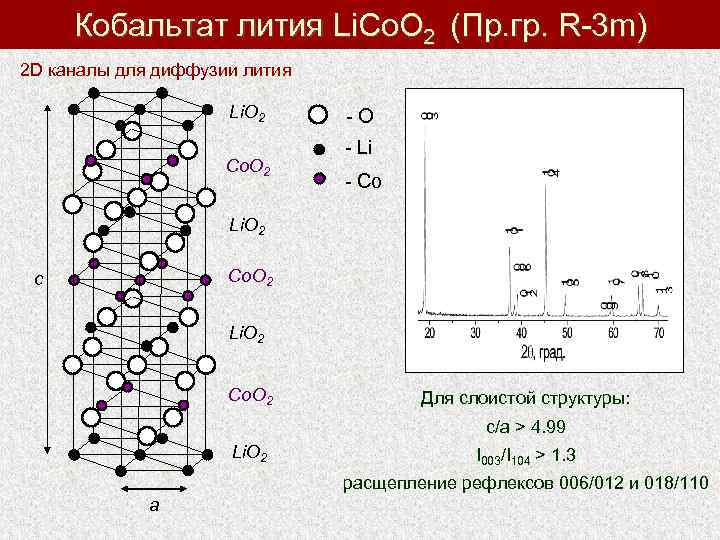 Кобальтат лития Li. Co. O 2 (Пр. гр. R-3 m) 2 D каналы для диффузии лития Li. О 2 Со. О 2 - O - Li - Co Li. О 2 Co. О 2 c Li. О 2 Co. О 2 Для слоистой структуры: с/а > 4. 99 Li. О 2 I 003/I 104 > 1. 3 расщепление рефлексов 006/012 и 018/110 a
Кобальтат лития Li. Co. O 2 (Пр. гр. R-3 m) 2 D каналы для диффузии лития Li. О 2 Со. О 2 - O - Li - Co Li. О 2 Co. О 2 c Li. О 2 Co. О 2 Для слоистой структуры: с/а > 4. 99 Li. О 2 I 003/I 104 > 1. 3 расщепление рефлексов 006/012 и 018/110 a
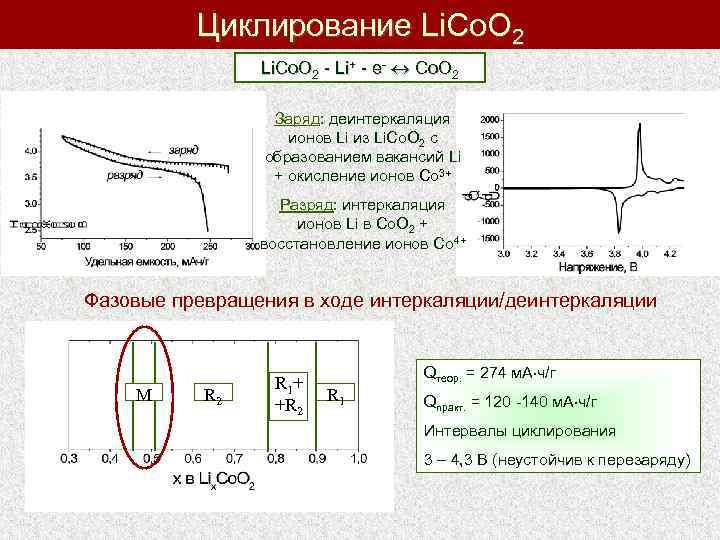 Циклирование Li. Co. O 2 - Li+ - e- Co. O 2 Заряд: деинтеркаляция ионов Li из Li. Co. O 2 с образованием вакансий Li + окисление ионов Co 3+ Разряд: интеркаляция ионов Li в Co. O 2 + восстановление ионов Co 4+ Фазовые превращения в ходе интеркаляции/деинтеркаляции M R 2 R 1 + +R 2 Qтеор. = 274 м. А ч/г R 1 Qпракт. = 120 -140 м. А ч/г Интервалы циклирования 3 – 4, 3 В (неустойчив к перезаряду)
Циклирование Li. Co. O 2 - Li+ - e- Co. O 2 Заряд: деинтеркаляция ионов Li из Li. Co. O 2 с образованием вакансий Li + окисление ионов Co 3+ Разряд: интеркаляция ионов Li в Co. O 2 + восстановление ионов Co 4+ Фазовые превращения в ходе интеркаляции/деинтеркаляции M R 2 R 1 + +R 2 Qтеор. = 274 м. А ч/г R 1 Qпракт. = 120 -140 м. А ч/г Интервалы циклирования 3 – 4, 3 В (неустойчив к перезаряду)
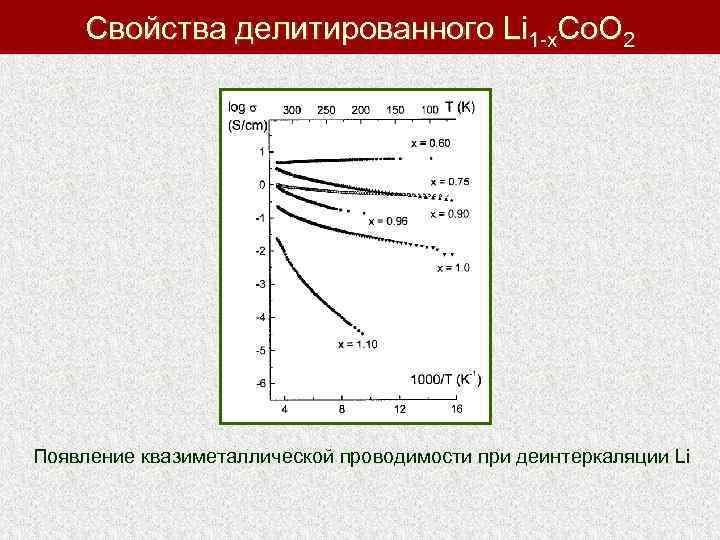 Свойства делитированного Li 1 -x. Co. O 2 Появление квазиметаллической проводимости при деинтеркаляции Li
Свойства делитированного Li 1 -x. Co. O 2 Появление квазиметаллической проводимости при деинтеркаляции Li
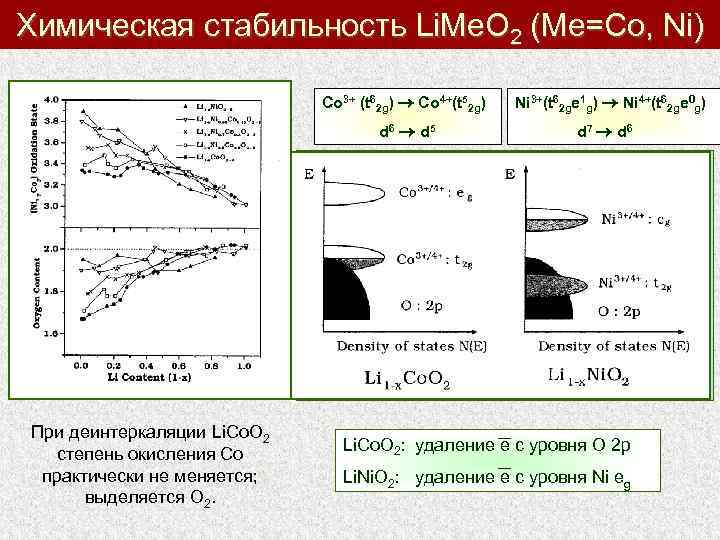 Химическая стабильность Li. Me. O 2 (Me=Co, Ni) Co 3+ (t 62 g) Co 4+(t 52 g) d 6 d 5 При деинтеркаляции Li. Co. O 2 степень окисления Со практически не меняется; выделяется О 2. Ni 3+(t 62 ge 1 g) Ni 4+(t 62 ge 0 g) d 7 d 6 Li. Co. O 2: удаление е с уровня O 2 p Li. Ni. O 2: удаление е с уровня Ni eg
Химическая стабильность Li. Me. O 2 (Me=Co, Ni) Co 3+ (t 62 g) Co 4+(t 52 g) d 6 d 5 При деинтеркаляции Li. Co. O 2 степень окисления Со практически не меняется; выделяется О 2. Ni 3+(t 62 ge 1 g) Ni 4+(t 62 ge 0 g) d 7 d 6 Li. Co. O 2: удаление е с уровня O 2 p Li. Ni. O 2: удаление е с уровня Ni eg
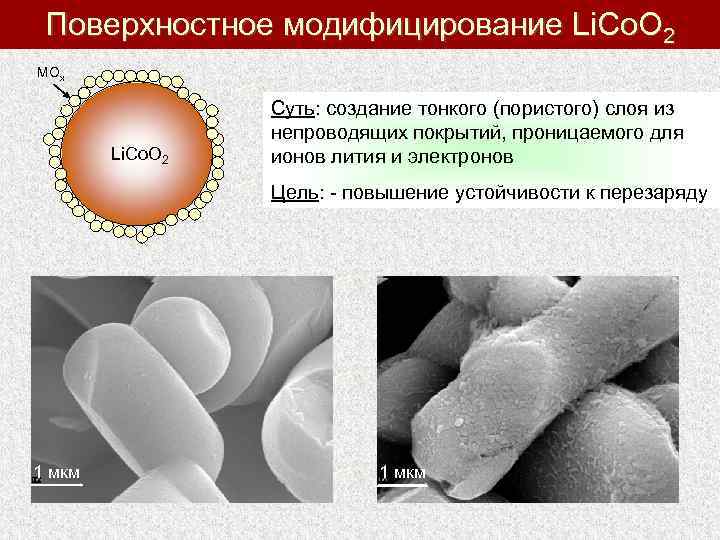 Поверхностное модифицирование Li. Co. O 2 MOx Li. Co. O 2 Суть: создание тонкого (пористого) слоя из непроводящих покрытий, проницаемого для ионов лития и электронов Цель: - повышение устойчивости к перезаряду 1 мкм 10 мкм 1 мкм
Поверхностное модифицирование Li. Co. O 2 MOx Li. Co. O 2 Суть: создание тонкого (пористого) слоя из непроводящих покрытий, проницаемого для ионов лития и электронов Цель: - повышение устойчивости к перезаряду 1 мкм 10 мкм 1 мкм
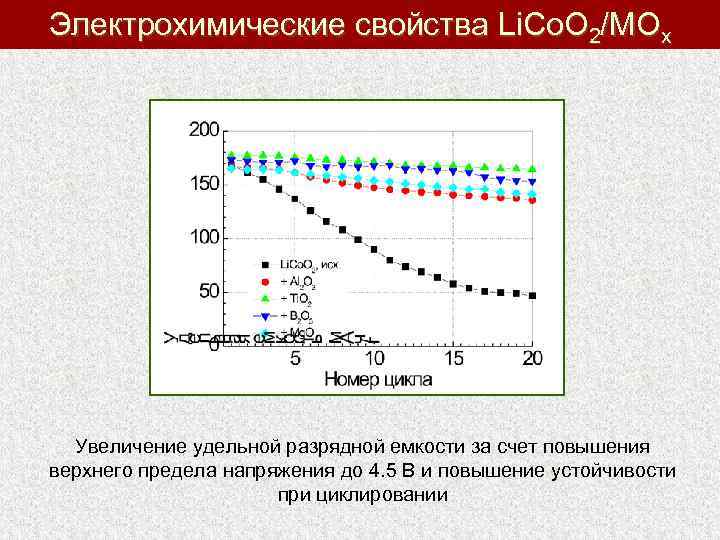 Электрохимические свойства Li. Co. O 2/MOx Увеличение удельной разрядной емкости за счет повышения верхнего предела напряжения до 4. 5 В и повышение устойчивости при циклировании
Электрохимические свойства Li. Co. O 2/MOx Увеличение удельной разрядной емкости за счет повышения верхнего предела напряжения до 4. 5 В и повышение устойчивости при циклировании
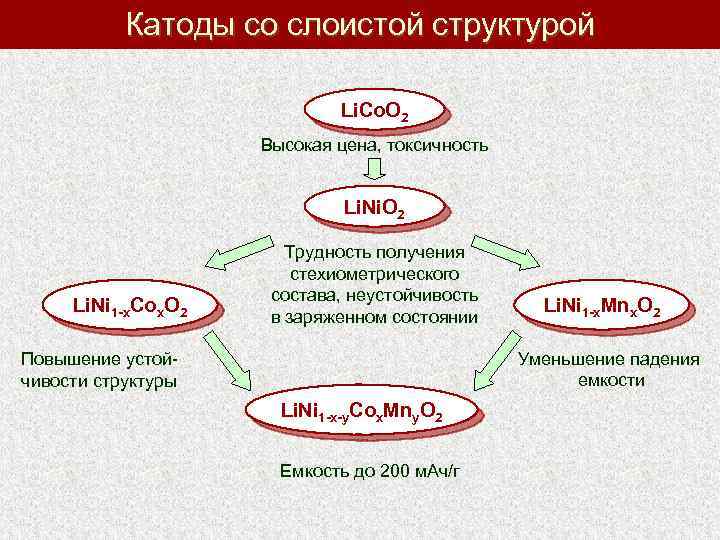 Катоды со слоистой структурой Li. Co. O 2 Высокая цена, токсичность Li. Ni. O 2 Li. Ni 1 -x. Cox. O 2 Трудность получения стехиометрического состава, неустойчивость в заряженном состоянии Li. Ni 1 -x. Mnx. O 2 Уменьшение падения емкости Повышение устойчивости структуры Li. Ni 1 -x-y. Cox. Mny. O 2 Емкость до 200 м. Ач/г
Катоды со слоистой структурой Li. Co. O 2 Высокая цена, токсичность Li. Ni. O 2 Li. Ni 1 -x. Cox. O 2 Трудность получения стехиометрического состава, неустойчивость в заряженном состоянии Li. Ni 1 -x. Mnx. O 2 Уменьшение падения емкости Повышение устойчивости структуры Li. Ni 1 -x-y. Cox. Mny. O 2 Емкость до 200 м. Ач/г
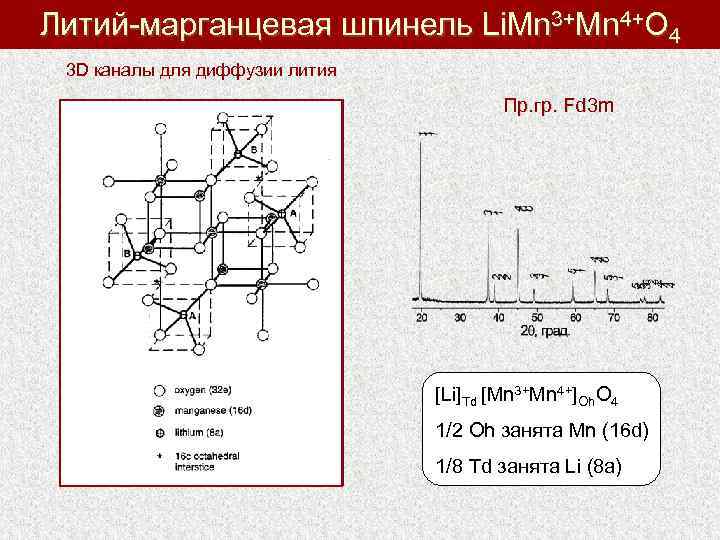 Литий-марганцевая шпинель Li. Mn 3+Mn 4+O 4 3 D каналы для диффузии лития Пр. гр. Fd 3 m [Li]Td [Mn 3+Mn 4+]Oh. O 4 1/2 Oh занята Mn (16 d) 1/8 Td занята Li (8 a)
Литий-марганцевая шпинель Li. Mn 3+Mn 4+O 4 3 D каналы для диффузии лития Пр. гр. Fd 3 m [Li]Td [Mn 3+Mn 4+]Oh. O 4 1/2 Oh занята Mn (16 d) 1/8 Td занята Li (8 a)
 Циклирование Li. Mn 2 O 4 Fd-3 m λ-Mn. O 2 Fd-3 m Li. Mn 2 O 4 I 41/amd Li 2 Mn 2 O 4 Ян-Теллеровское разупорядочение eg Mn 3+ заряд (d 4) t 2 g разряд Mn 4+ +e +e 4+, Mn 3+] -e - e [Mn Mn 3+ V/V = 10 - 16% Теорема Яна-Теллера: Вырожденное электронное состояние всякой нелинейной молекулярной системы является неустойчивым, вследствие чего такая система подвергается некоторому искажению, понижающему ее симметрию и снижающему вырождение.
Циклирование Li. Mn 2 O 4 Fd-3 m λ-Mn. O 2 Fd-3 m Li. Mn 2 O 4 I 41/amd Li 2 Mn 2 O 4 Ян-Теллеровское разупорядочение eg Mn 3+ заряд (d 4) t 2 g разряд Mn 4+ +e +e 4+, Mn 3+] -e - e [Mn Mn 3+ V/V = 10 - 16% Теорема Яна-Теллера: Вырожденное электронное состояние всякой нелинейной молекулярной системы является неустойчивым, вследствие чего такая система подвергается некоторому искажению, понижающему ее симметрию и снижающему вырождение.
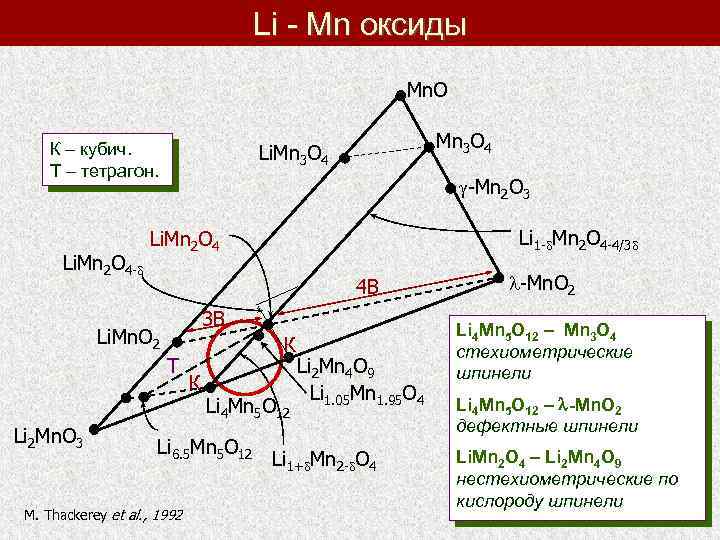 Li - Mn оксиды Mn. O К – кубич. Т – тетрагон. Li. Mn 2 O 4 - -Mn 2 O 3 Li 1 - Mn 2 O 4 -4/3 Li. Mn 2 O 4 4 В 3 В Li. Mn. O 2 Т Li 2 Mn. O 3 Mn 3 O 4 Li. Mn 3 O 4 К К Li 4 Mn 5 O 12 Li 6. 5 Mn 5 O 12 M. Thackerey et al. , 1992 Li 2 Mn 4 O 9 Li 1. 05 Mn 1. 95 O 4 Li 1+ Mn 2 - O 4 -Mn. O 2 Li 4 Mn 5 O 12 – Mn 3 O 4 стехиометрические шпинели Li 4 Mn 5 O 12 – -Mn. O 2 дефектные шпинели Li. Mn 2 O 4 – Li 2 Mn 4 O 9 нестехиометрические по кислороду шпинели
Li - Mn оксиды Mn. O К – кубич. Т – тетрагон. Li. Mn 2 O 4 - -Mn 2 O 3 Li 1 - Mn 2 O 4 -4/3 Li. Mn 2 O 4 4 В 3 В Li. Mn. O 2 Т Li 2 Mn. O 3 Mn 3 O 4 Li. Mn 3 O 4 К К Li 4 Mn 5 O 12 Li 6. 5 Mn 5 O 12 M. Thackerey et al. , 1992 Li 2 Mn 4 O 9 Li 1. 05 Mn 1. 95 O 4 Li 1+ Mn 2 - O 4 -Mn. O 2 Li 4 Mn 5 O 12 – Mn 3 O 4 стехиометрические шпинели Li 4 Mn 5 O 12 – -Mn. O 2 дефектные шпинели Li. Mn 2 O 4 – Li 2 Mn 4 O 9 нестехиометрические по кислороду шпинели
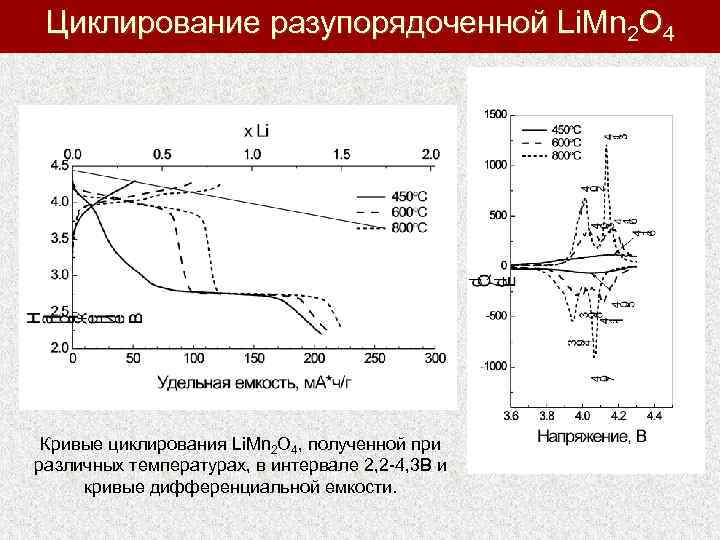 Циклирование разупорядоченной Li. Mn 2 O 4 Кривые циклирования Li. Mn 2 O 4, полученной при различных температурах, в интервале 2, 2 -4, 3 В и кривые дифференциальной емкости.
Циклирование разупорядоченной Li. Mn 2 O 4 Кривые циклирования Li. Mn 2 O 4, полученной при различных температурах, в интервале 2, 2 -4, 3 В и кривые дифференциальной емкости.
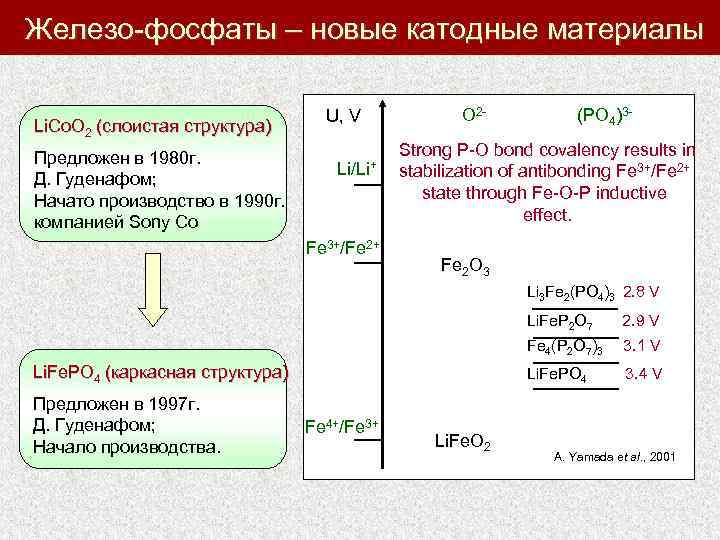 Железо-фосфаты – новые катодные материалы Li. Co. O 2 (слоистая структура) Предложен в 1980 г. Д. Гуденафом; Начато производство в 1990 г. компанией Sony Co U, V Li/Li+ Fe 3+/Fe 2+ O 2 - (PO 4)3 - Strong P-O bond covalency results in stabilization of antibonding Fe 3+/Fe 2+ state through Fe-O-P inductive effect. Fe 2 O 3 Li 3 Fe 2(PO 4)3 2. 8 V Li. Fe. P 2 O 7 2. 9 V Fe 4(P 2 O 7)3 3. 1 V Li. Fe. PO 4 (каркасная структура) Предложен в 1997 г. Д. Гуденафом; Начало производства. Li. Fe. PO 4 3. 4 V Fe 4+/Fe 3+ Li. Fe. O 2 A. Yamada et al. , 2001
Железо-фосфаты – новые катодные материалы Li. Co. O 2 (слоистая структура) Предложен в 1980 г. Д. Гуденафом; Начато производство в 1990 г. компанией Sony Co U, V Li/Li+ Fe 3+/Fe 2+ O 2 - (PO 4)3 - Strong P-O bond covalency results in stabilization of antibonding Fe 3+/Fe 2+ state through Fe-O-P inductive effect. Fe 2 O 3 Li 3 Fe 2(PO 4)3 2. 8 V Li. Fe. P 2 O 7 2. 9 V Fe 4(P 2 O 7)3 3. 1 V Li. Fe. PO 4 (каркасная структура) Предложен в 1997 г. Д. Гуденафом; Начало производства. Li. Fe. PO 4 3. 4 V Fe 4+/Fe 3+ Li. Fe. O 2 A. Yamada et al. , 2001
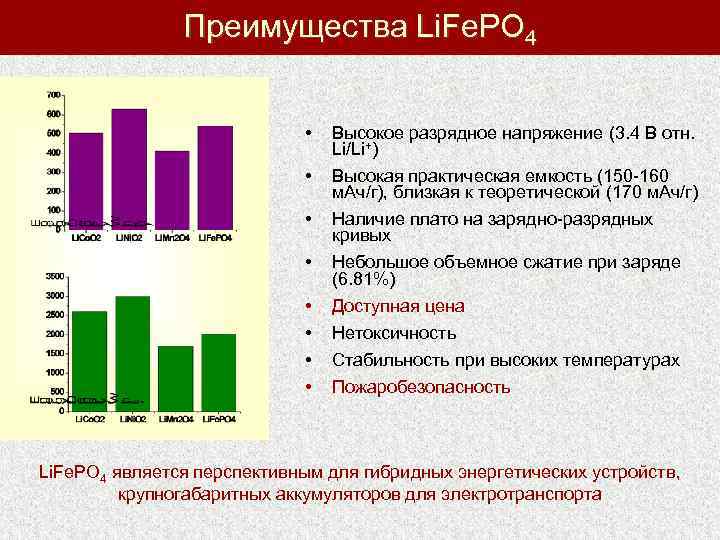 Преимущества Li. Fe. PO 4 • • Высокое разрядное напряжение (3. 4 В отн. Li/Li+) Высокая практическая емкость (150 -160 м. Ач/г), близкая к теоретической (170 м. Ач/г) Наличие плато на зарядно-разрядных кривых Небольшое объемное сжатие при заряде (6. 81%) Доступная цена Нетоксичность Стабильность при высоких температурах Пожаробезопасность Li. Fe. PO 4 является перспективным для гибридных энергетических устройств, крупногабаритных аккумуляторов для электротранспорта
Преимущества Li. Fe. PO 4 • • Высокое разрядное напряжение (3. 4 В отн. Li/Li+) Высокая практическая емкость (150 -160 м. Ач/г), близкая к теоретической (170 м. Ач/г) Наличие плато на зарядно-разрядных кривых Небольшое объемное сжатие при заряде (6. 81%) Доступная цена Нетоксичность Стабильность при высоких температурах Пожаробезопасность Li. Fe. PO 4 является перспективным для гибридных энергетических устройств, крупногабаритных аккумуляторов для электротранспорта
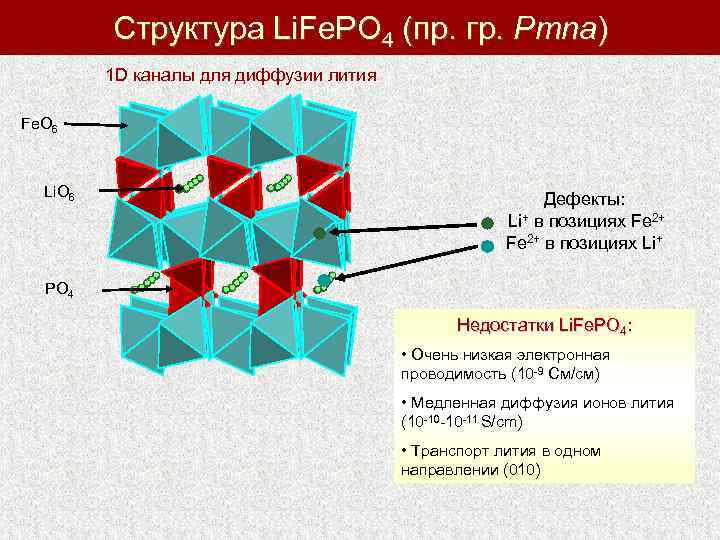 Структура Li. Fe. PO 4 (пр. гр. Pmna) 1 D каналы для диффузии лития Fe. O 6 Li. O 6 Дефекты: Li+ в позициях Fe 2+ в позициях Li+ PO 4 Недостатки Li. Fe. PO 4: • Очень низкая электронная проводимость (10 -9 См/см) • Медленная диффузия ионов лития (10 -10 -10 -11 S/cm) • Транспорт лития в одном направлении (010)
Структура Li. Fe. PO 4 (пр. гр. Pmna) 1 D каналы для диффузии лития Fe. O 6 Li. O 6 Дефекты: Li+ в позициях Fe 2+ в позициях Li+ PO 4 Недостатки Li. Fe. PO 4: • Очень низкая электронная проводимость (10 -9 См/см) • Медленная диффузия ионов лития (10 -10 -10 -11 S/cm) • Транспорт лития в одном направлении (010)
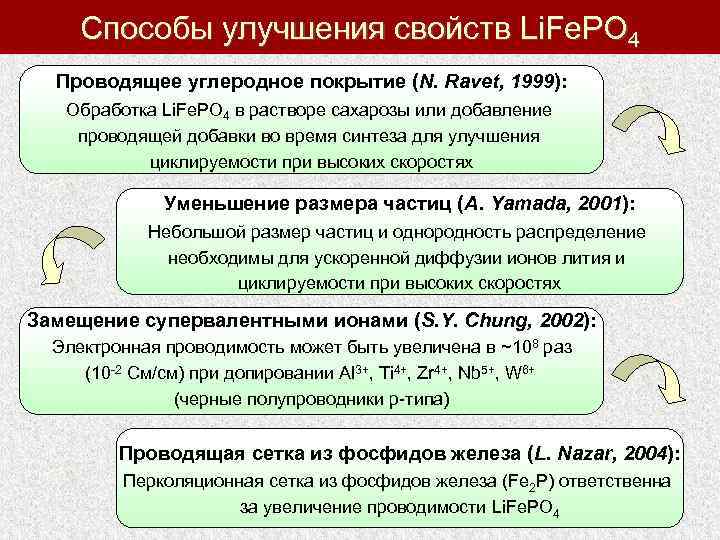 Способы улучшения свойств Li. Fe. PO 4 Проводящее углеродное покрытие (N. Ravet, 1999): Обработка Li. Fe. PO 4 в растворе сахарозы или добавление проводящей добавки во время синтеза для улучшения циклируемости при высоких скоростях Уменьшение размера частиц (A. Yamada, 2001): Небольшой размер частиц и однородность распределение необходимы для ускоренной диффузии ионов лития и циклируемости при высоких скоростях Замещение супервалентными ионами (S. Y. Chung, 2002): Электронная проводимость может быть увеличена в ~108 раз (10 -2 См/см) при допировании Al 3+, Ti 4+, Zr 4+, Nb 5+, W 6+ (черные полупроводники p-типа) Проводящая сетка из фосфидов железа (L. Nazar, 2004): Перколяционная сетка из фосфидов железа (Fe 2 P) ответственна за увеличение проводимости Li. Fe. PO 4
Способы улучшения свойств Li. Fe. PO 4 Проводящее углеродное покрытие (N. Ravet, 1999): Обработка Li. Fe. PO 4 в растворе сахарозы или добавление проводящей добавки во время синтеза для улучшения циклируемости при высоких скоростях Уменьшение размера частиц (A. Yamada, 2001): Небольшой размер частиц и однородность распределение необходимы для ускоренной диффузии ионов лития и циклируемости при высоких скоростях Замещение супервалентными ионами (S. Y. Chung, 2002): Электронная проводимость может быть увеличена в ~108 раз (10 -2 См/см) при допировании Al 3+, Ti 4+, Zr 4+, Nb 5+, W 6+ (черные полупроводники p-типа) Проводящая сетка из фосфидов железа (L. Nazar, 2004): Перколяционная сетка из фосфидов железа (Fe 2 P) ответственна за увеличение проводимости Li. Fe. PO 4
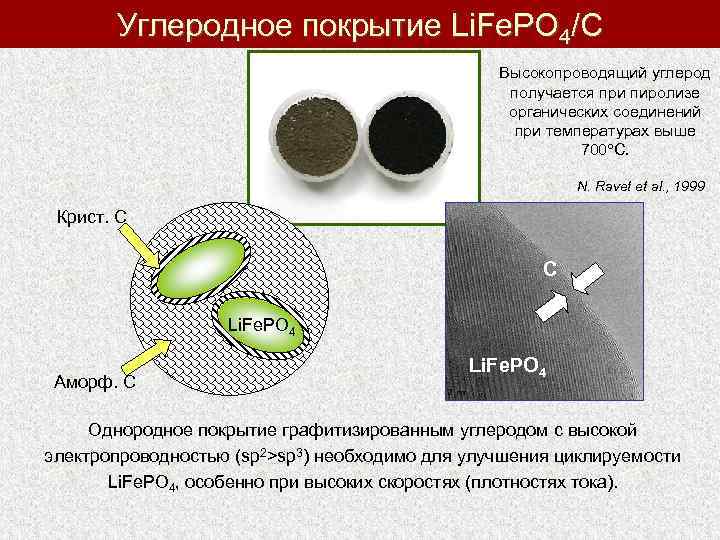 Углеродное покрытие Li. Fe. PO 4/C Высокопроводящий углерод получается при пиролизе органических соединений при температурах выше 700 C. N. Ravet et al. , 1999 Крист. С C Li. Fe. PO 4 Аморф. C Li. Fe. PO 4 Однородное покрытие графитизированным углеродом с высокой электропроводностью (sp 2>sp 3) необходимо для улучшения циклируемости Li. Fe. PO 4, особенно при высоких скоростях (плотностях тока).
Углеродное покрытие Li. Fe. PO 4/C Высокопроводящий углерод получается при пиролизе органических соединений при температурах выше 700 C. N. Ravet et al. , 1999 Крист. С C Li. Fe. PO 4 Аморф. C Li. Fe. PO 4 Однородное покрытие графитизированным углеродом с высокой электропроводностью (sp 2>sp 3) необходимо для улучшения циклируемости Li. Fe. PO 4, особенно при высоких скоростях (плотностях тока).
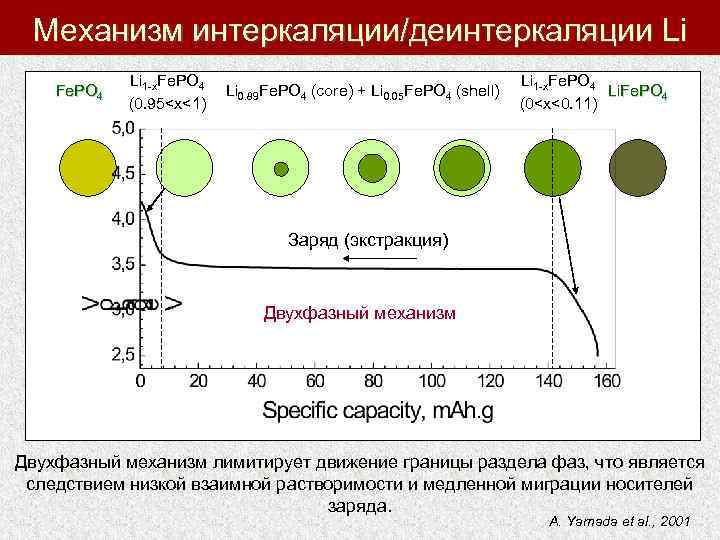 Механизм интеркаляции/деинтеркаляции Li Fe. PO 4 Li 1 -x. Fe. PO 4 (0. 95
Механизм интеркаляции/деинтеркаляции Li Fe. PO 4 Li 1 -x. Fe. PO 4 (0. 95
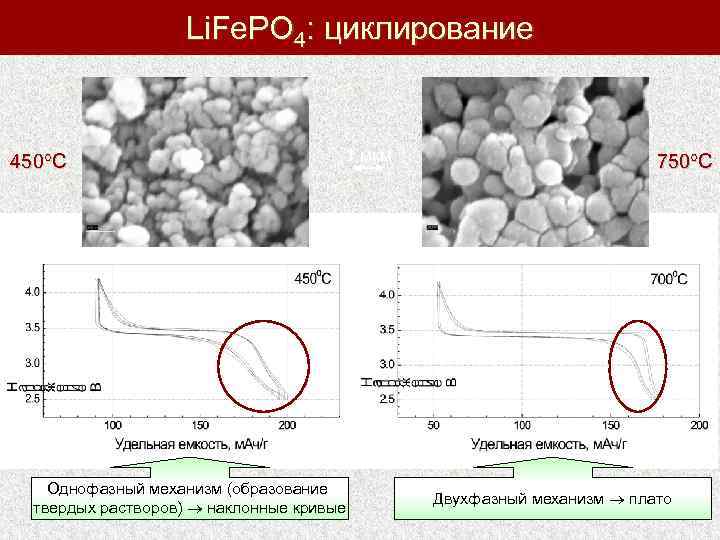 Li. Fe. PO 4: циклирование 450 С 1 мкм Однофазный механизм (образование твердых растворов) наклонные кривые 750 С Двухфазный механизм плато
Li. Fe. PO 4: циклирование 450 С 1 мкм Однофазный механизм (образование твердых растворов) наклонные кривые 750 С Двухфазный механизм плато
 Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
 Анодные материалы Анодный материал Графит (Li. C 6) Титанат (Li 4 Ti 5 O 12) Si (Li 4. 4 Si) Среднее напряжение, В Удельная емкость, м. А ч/г Удельная энергия, к. Вт ч/кг 0. 1 -0. 2 372 0. 0372 -0. 0744 1 -2 175 0. 16 -0. 32 0. 5 -1 4212 2. 106 -4. 212 Наноразмерные аноды • Формирование нанометрических частиц Sn и обратимое образование интерметаллидов с Li: Sn. O 2 + 4 Li+ + 4 e → 2 Li 2 O + Sn (1 разряд) Sn + x Li+ + x e ↔ Lix. Sn (0 ≤ x ≤ 4. 4) (последующие циклы) Li 2 O – инертная матрица • Обратимое формирование и разложение Li 2 O и окисление/восстановление наночастиц Со (conversion): Co. O + 2 Li+ + 2 e → 2 Li 2 O + Co (1 разряд) 2 Li ← 2 Li+ + 2 e Co. O + 2 Li ↔ Li 2 O + Co (последующие циклы) Li 2 O участвует в процессе
Анодные материалы Анодный материал Графит (Li. C 6) Титанат (Li 4 Ti 5 O 12) Si (Li 4. 4 Si) Среднее напряжение, В Удельная емкость, м. А ч/г Удельная энергия, к. Вт ч/кг 0. 1 -0. 2 372 0. 0372 -0. 0744 1 -2 175 0. 16 -0. 32 0. 5 -1 4212 2. 106 -4. 212 Наноразмерные аноды • Формирование нанометрических частиц Sn и обратимое образование интерметаллидов с Li: Sn. O 2 + 4 Li+ + 4 e → 2 Li 2 O + Sn (1 разряд) Sn + x Li+ + x e ↔ Lix. Sn (0 ≤ x ≤ 4. 4) (последующие циклы) Li 2 O – инертная матрица • Обратимое формирование и разложение Li 2 O и окисление/восстановление наночастиц Со (conversion): Co. O + 2 Li+ + 2 e → 2 Li 2 O + Co (1 разряд) 2 Li ← 2 Li+ + 2 e Co. O + 2 Li ↔ Li 2 O + Co (последующие циклы) Li 2 O участвует в процессе
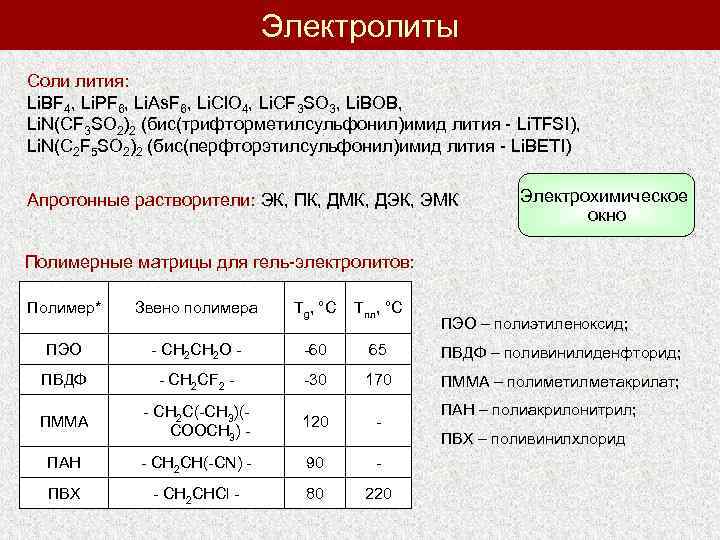 Электролиты Соли лития: Li. BF 4, Li. PF 6, Li. As. F 6, Li. Cl. O 4, Li. CF 3 SO 3, Li. BOB, Li. N(CF 3 SO 2)2 (бис(трифторметилсульфонил)имид лития - Li. TFSI), Li. N(C 2 F 5 SO 2)2 (бис(перфторэтилсульфонил)имид лития - Li. BETI) Апротонные растворители: ЭК, ПК, ДМК, ДЭК, ЭМК Электрохимическое окно Полимерные матрицы для гель-электролитов: Полимер* Звено полимера Tg, °С Tпл, °С ПЭО - CH 2 O - -60 65 ПВДФ – поливинилиденфторид; ПВДФ - CH 2 CF 2 - -30 170 ПММА – полиметилметакрилат; ПММА - CH 2 C(-CH 3)(COOCH 3) - 120 - ПАН - CH 2 CH(-CN) - 90 - ПВХ - CH 2 CHCl - 80 220 ПЭО – полиэтиленоксид; ПАН – полиакрилонитрил; ПВХ – поливинилхлорид
Электролиты Соли лития: Li. BF 4, Li. PF 6, Li. As. F 6, Li. Cl. O 4, Li. CF 3 SO 3, Li. BOB, Li. N(CF 3 SO 2)2 (бис(трифторметилсульфонил)имид лития - Li. TFSI), Li. N(C 2 F 5 SO 2)2 (бис(перфторэтилсульфонил)имид лития - Li. BETI) Апротонные растворители: ЭК, ПК, ДМК, ДЭК, ЭМК Электрохимическое окно Полимерные матрицы для гель-электролитов: Полимер* Звено полимера Tg, °С Tпл, °С ПЭО - CH 2 O - -60 65 ПВДФ – поливинилиденфторид; ПВДФ - CH 2 CF 2 - -30 170 ПММА – полиметилметакрилат; ПММА - CH 2 C(-CH 3)(COOCH 3) - 120 - ПАН - CH 2 CH(-CN) - 90 - ПВХ - CH 2 CHCl - 80 220 ПЭО – полиэтиленоксид; ПАН – полиакрилонитрил; ПВХ – поливинилхлорид
 Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
Содержание • Химические источники тока. Историческая справка • Литий-ионные аккумуляторы. Общие сведения • Катодные материалы - со слоистой структурой - со шпинельной структурой - с каркасной структурой • Анодные материалы • Электролиты • Наноразмерные электродные материалы и механохимический синтез
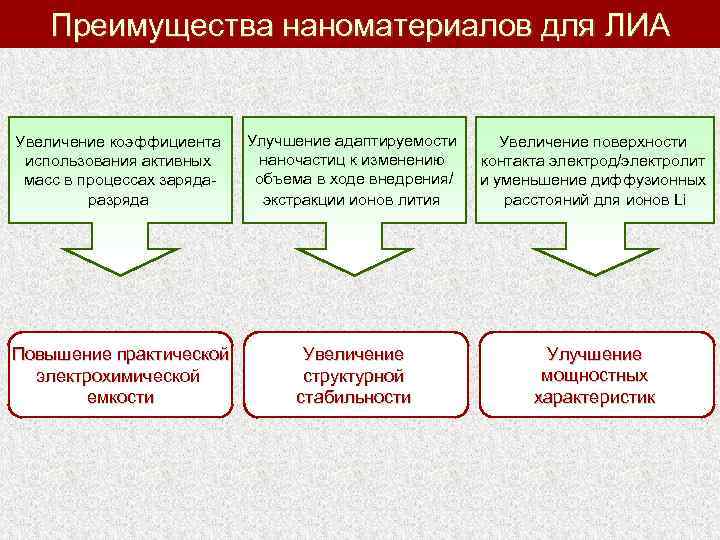 Преимущества наноматериалов для ЛИА Увеличение коэффициента использования активных масс в процессах зарядаразряда Улучшение адаптируемости наночастиц к изменению объема в ходе внедрения/ экстракции ионов лития Увеличение поверхности контакта электрод/электролит и уменьшение диффузионных расстояний для ионов Li Повышение практической электрохимической емкости Увеличение структурной стабильности Улучшение мощностных характеристик
Преимущества наноматериалов для ЛИА Увеличение коэффициента использования активных масс в процессах зарядаразряда Улучшение адаптируемости наночастиц к изменению объема в ходе внедрения/ экстракции ионов лития Увеличение поверхности контакта электрод/электролит и уменьшение диффузионных расстояний для ионов Li Повышение практической электрохимической емкости Увеличение структурной стабильности Улучшение мощностных характеристик
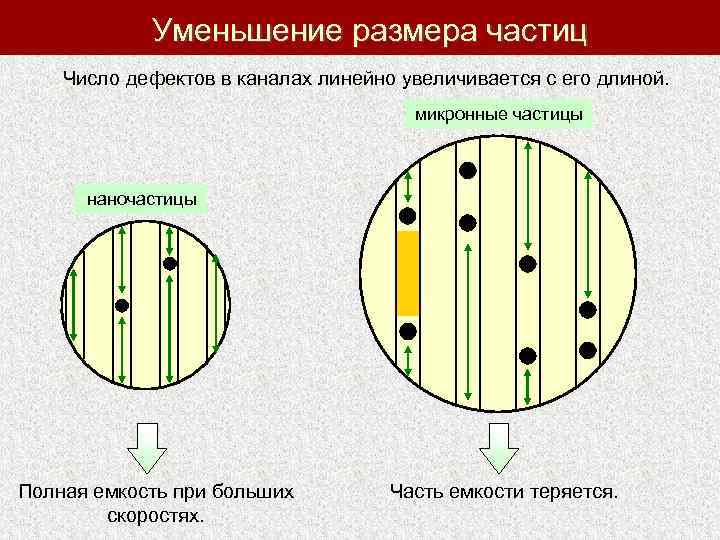 Уменьшение размера частиц Число дефектов в каналах линейно увеличивается с его длиной. микронные частицы наночастицы Полная емкость при больших скоростях. Часть емкости теряется.
Уменьшение размера частиц Число дефектов в каналах линейно увеличивается с его длиной. микронные частицы наночастицы Полная емкость при больших скоростях. Часть емкости теряется.
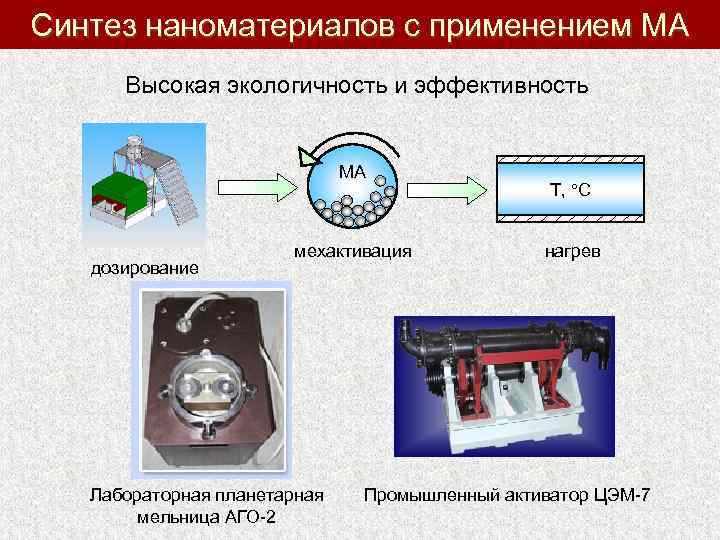 Синтез наноматериалов с применением МА Высокая экологичность и эффективность MA дозирование мехактивация Лабораторная планетарная мельница АГО-2 Т, С нагрев Промышленный активатор ЦЭМ-7
Синтез наноматериалов с применением МА Высокая экологичность и эффективность MA дозирование мехактивация Лабораторная планетарная мельница АГО-2 Т, С нагрев Промышленный активатор ЦЭМ-7
 Синтезированные материалы Слоистая структура • • Li. Co. O 2 Li. Co 1 -x. Mx. O 2 Li. Co. O 2 -Li 2 Mn. O 3 Li. Ni. O 2 Li. Ni 1 -x. Cox. O 2 Li. Ni 1 -x-y. Cox. Mny. O 2 Li. V 3 O 8 Шпинельная структура • • • Li. Mn 2 O 4 Li. Mn 2 -x. Mx. O 4 Li. Mn 1. 5 Ni 0. 5 O 4 (5 В) • Li 4 Ti 5 O 12 (анод) Каркасная структура • • Li. Fe. PO 4 Li. Fe 1 -x. Mnx. PO 4 Li. Fe 1 -x. Mx. PO 4 Li. Mn. PO 4 Li 2 Fe. Si. O 4 Li 2 Co. PO 4 F Li. VPO 4 F Li. Ti 2(PO 4)3 (эл-т)
Синтезированные материалы Слоистая структура • • Li. Co. O 2 Li. Co 1 -x. Mx. O 2 Li. Co. O 2 -Li 2 Mn. O 3 Li. Ni. O 2 Li. Ni 1 -x. Cox. O 2 Li. Ni 1 -x-y. Cox. Mny. O 2 Li. V 3 O 8 Шпинельная структура • • • Li. Mn 2 O 4 Li. Mn 2 -x. Mx. O 4 Li. Mn 1. 5 Ni 0. 5 O 4 (5 В) • Li 4 Ti 5 O 12 (анод) Каркасная структура • • Li. Fe. PO 4 Li. Fe 1 -x. Mnx. PO 4 Li. Fe 1 -x. Mx. PO 4 Li. Mn. PO 4 Li 2 Fe. Si. O 4 Li 2 Co. PO 4 F Li. VPO 4 F Li. Ti 2(PO 4)3 (эл-т)
 Методы исследования Размер и морфология частиц • • • Кристаллическая и локальная структура Электронная структура Электрохимические свойства Рентгенофазовый анализ (РФА) Термический анализ (ДТА и ТГ) Инфракрасная спектроскопия (ИК) Рамановская спектроскопия (КР) Мессбауэровская спектроскопия (ЯГРС) Спектроскопия ядерного магнитного резонанса (ЯМР) Рентгенофотоэлектронная спектроскопия (РФЭС) Сканирующая электронная микроскопия (СЭМ) Просвечивающая электронная микроскопия (ПЭМ) Гальваностатическое циклирование Импедансометрия и др.
Методы исследования Размер и морфология частиц • • • Кристаллическая и локальная структура Электронная структура Электрохимические свойства Рентгенофазовый анализ (РФА) Термический анализ (ДТА и ТГ) Инфракрасная спектроскопия (ИК) Рамановская спектроскопия (КР) Мессбауэровская спектроскопия (ЯГРС) Спектроскопия ядерного магнитного резонанса (ЯМР) Рентгенофотоэлектронная спектроскопия (РФЭС) Сканирующая электронная микроскопия (СЭМ) Просвечивающая электронная микроскопия (ПЭМ) Гальваностатическое циклирование Импедансометрия и др.
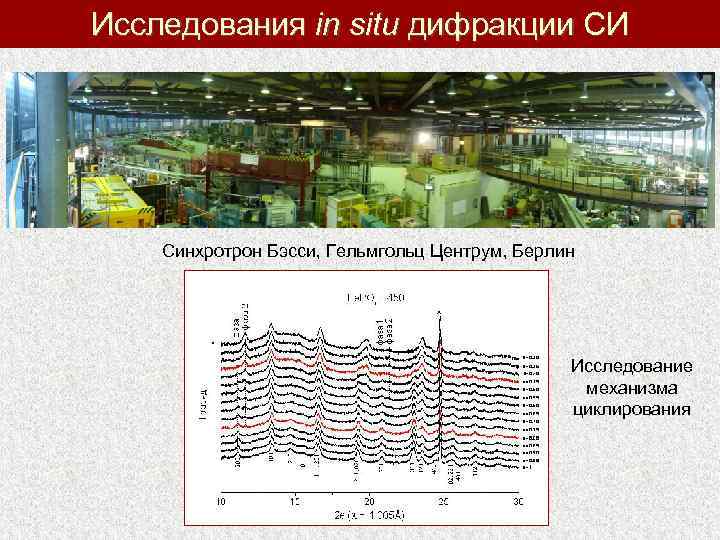 Исследования in situ дифракции СИ Синхротрон Бэсси, Гельмгольц Центрум, Берлин Исследование механизма циклирования
Исследования in situ дифракции СИ Синхротрон Бэсси, Гельмгольц Центрум, Берлин Исследование механизма циклирования
 Нейтронографические исследования
Нейтронографические исследования
 От науки к практике Разработанный метод синтеза Li. Fe. PO 4 лег в основу проекта ОАО Роснано по созданию первого в России производства катодного материала на базе ОАО «Новосибирский завод химконцентратов» . Планируется, что материал будет поставляться по программе импортзамещения в компанию «Лиотех» по выпуску ЛИА для электромобилей. В 2011 г. компания «Лиотех» запустила в Новосибирске первый в России и крупнейший в мире завод по производству ЛИА для электротранспорта. Электробус, работающий на аккумуляторах Thunder Sky Компания «Лиотех» , г. Новосибирск Электроавтобус, работающий на аккумуляторах Thunder Sky
От науки к практике Разработанный метод синтеза Li. Fe. PO 4 лег в основу проекта ОАО Роснано по созданию первого в России производства катодного материала на базе ОАО «Новосибирский завод химконцентратов» . Планируется, что материал будет поставляться по программе импортзамещения в компанию «Лиотех» по выпуску ЛИА для электромобилей. В 2011 г. компания «Лиотех» запустила в Новосибирске первый в России и крупнейший в мире завод по производству ЛИА для электротранспорта. Электробус, работающий на аккумуляторах Thunder Sky Компания «Лиотех» , г. Новосибирск Электроавтобус, работающий на аккумуляторах Thunder Sky
 Спасибо за внимание! Косова Нина Васильевна Институт химии твердого тела и механохимии СО РАН 8 -913 -390 -91 -55
Спасибо за внимание! Косова Нина Васильевна Институт химии твердого тела и механохимии СО РАН 8 -913 -390 -91 -55
