Буферные системы Общие понятия Классификация буферных





![C кислоты [H + ] = К Д -------- моль/л C соли C C кислоты [H + ] = К Д -------- моль/л C соли C](http://present5.com/presentforday2/20170210/bufernye_sistemy_№1_images/bufernye_sistemy_№1_6.jpg)









![Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO 3 - ] p. H = р. Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO 3 - ] p. H = р.](http://present5.com/presentforday2/20170210/bufernye_sistemy_№1_images/bufernye_sistemy_№1_17.jpg)











bufernye_sistemy_№1.ppt
- Размер: 404.0 Кб
- Автор:
- Количество слайдов: 32
Описание презентации Буферные системы Общие понятия Классификация буферных по слайдам
 Буферные системы • Общие понятия • Классификация буферных систем • Механизм действия буферных систем • Буферные системы крови
Буферные системы • Общие понятия • Классификация буферных систем • Механизм действия буферных систем • Буферные системы крови
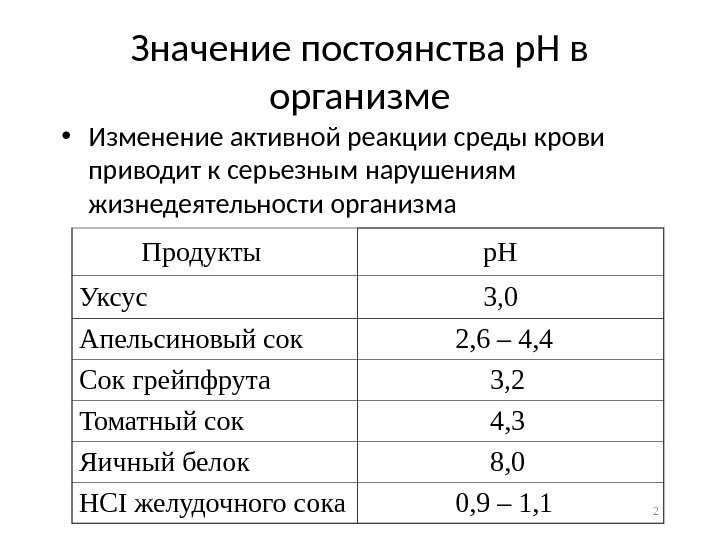
 Значение постоянства р. Н в организме • Изменение активной реакции среды крови приводит к серьезным нарушениям жизнедеятельности организма 2 Продукты р. Н Уксус 3, 0 Апельсиновый сок 2, 6 – 4, 4 Сок грейпфрута 3, 2 Томатный сок 4, 3 Яичный белок 8, 0 HCI желудочного сока 0, 9 – 1,
Значение постоянства р. Н в организме • Изменение активной реакции среды крови приводит к серьезным нарушениям жизнедеятельности организма 2 Продукты р. Н Уксус 3, 0 Апельсиновый сок 2, 6 – 4, 4 Сок грейпфрута 3, 2 Томатный сок 4, 3 Яичный белок 8, 0 HCI желудочного сока 0, 9 – 1,
 Буферные системы Растворы, обладающие свойством достаточно стойко сохранять постоянное значение активной реакции среды как при добавлении кислоты и щелочей, так и при разведении С точки зрения протонной теории буферными системами являются сопряженные кислотно-основные пары
Буферные системы Растворы, обладающие свойством достаточно стойко сохранять постоянное значение активной реакции среды как при добавлении кислоты и щелочей, так и при разведении С точки зрения протонной теории буферными системами являются сопряженные кислотно-основные пары
 Классификация буферных систем • Буферные системы кислотного типа (слабая кислота и соль этой кислоты и слабого основания) CH 3 COO — /CH 3 COOH – ацетатный буфер • Буферные системы основного типа (слабое основание и соль этого основания и сильной кислоты) NH 4 + / NH 4 OH – аммиачный буфер
Классификация буферных систем • Буферные системы кислотного типа (слабая кислота и соль этой кислоты и слабого основания) CH 3 COO — /CH 3 COOH – ацетатный буфер • Буферные системы основного типа (слабое основание и соль этого основания и сильной кислоты) NH 4 + / NH 4 OH – аммиачный буфер
 • Анионы многоосновных кислот (анионы кислой и средней или двух кислых солей) HPO 4 2 — /H 2 PO 4 — – фосфатный буфер • Ионы и молекулы амфолитов R – CH – COO — | – белковый буфер NH 3 +
• Анионы многоосновных кислот (анионы кислой и средней или двух кислых солей) HPO 4 2 — /H 2 PO 4 — – фосфатный буфер • Ионы и молекулы амфолитов R – CH – COO — | – белковый буфер NH 3 +
 Вывод формулы р. Н буферных систем В растворе имеет место равновесие CH 3 COOH H + + CH 3 COO — [H + ][CH 3 COO — ] Кд = ———— [CH 3 COOH] [H + ] = К Д ——— — [CH 3 COO — ] — для уксусной кислоты Присутствие соли влияет на диссоциацию кислоты CH 3 COONa Na + + CH 3 COO — ( = 1) CH 3 COOH H + + CH 3 COO — К Д ( CH 3 COOH) = = 1 , 8 10 -5 [CH 3 COOH] = C кислоты [CH 3 COO — ] = C соли
Вывод формулы р. Н буферных систем В растворе имеет место равновесие CH 3 COOH H + + CH 3 COO — [H + ][CH 3 COO — ] Кд = ———— [CH 3 COOH] [H + ] = К Д ——— — [CH 3 COO — ] — для уксусной кислоты Присутствие соли влияет на диссоциацию кислоты CH 3 COONa Na + + CH 3 COO — ( = 1) CH 3 COOH H + + CH 3 COO — К Д ( CH 3 COOH) = = 1 , 8 10 -5 [CH 3 COOH] = C кислоты [CH 3 COO — ] = C соли
![C кислоты [H + ] = К Д -------- моль/л C соли C C кислоты [H + ] = К Д -------- моль/л C соли C](http://present5.com/presentforday2/20170210/bufernye_sistemy_№1_images/bufernye_sistemy_№1_6.jpg) C кислоты [H + ] = К Д ——— моль/л C соли C кислоты р. Н = — lg[H + ] = — lg К Д – lg ——— или C соли р. Н = р. К а + lg ——— – C кислоты – это уравнение Гендерсона-Гассельбаха C соли р. Н = 14 – р. К в – lg —— C основания
C кислоты [H + ] = К Д ——— моль/л C соли C кислоты р. Н = — lg[H + ] = — lg К Д – lg ——— или C соли р. Н = р. К а + lg ——— – C кислоты – это уравнение Гендерсона-Гассельбаха C соли р. Н = 14 – р. К в – lg —— C основания
 Анализ уравнения Гендерсона-Гассельбаха р. Н буферной системы зависит от: • Константы диссоциации слабой кислоты р. Ка или основания р. Кв • Соотношения концентраций взятых компонентов • Наиболее эффективно буферная система работает когда концентрации компонентов равны, т. е. когда р. Н = р. К
Анализ уравнения Гендерсона-Гассельбаха р. Н буферной системы зависит от: • Константы диссоциации слабой кислоты р. Ка или основания р. Кв • Соотношения концентраций взятых компонентов • Наиболее эффективно буферная система работает когда концентрации компонентов равны, т. е. когда р. Н = р. К
 Механизм действия буферных систем CH 3 COOH + CH 3 COONa + HCI = CH 3 COOH + Na. CI Кислота нейтрализуется солью CH 3 COOH + Na. OH = CH 3 COONa + H 2 O В этом случае щелочь нейтрализуется слабой кислотой. Небольшое изменение в соотношении концентраций слабой кислоты ее соли незначительно изменяет р. Н
Механизм действия буферных систем CH 3 COOH + CH 3 COONa + HCI = CH 3 COOH + Na. CI Кислота нейтрализуется солью CH 3 COOH + Na. OH = CH 3 COONa + H 2 O В этом случае щелочь нейтрализуется слабой кислотой. Небольшое изменение в соотношении концентраций слабой кислоты ее соли незначительно изменяет р. Н
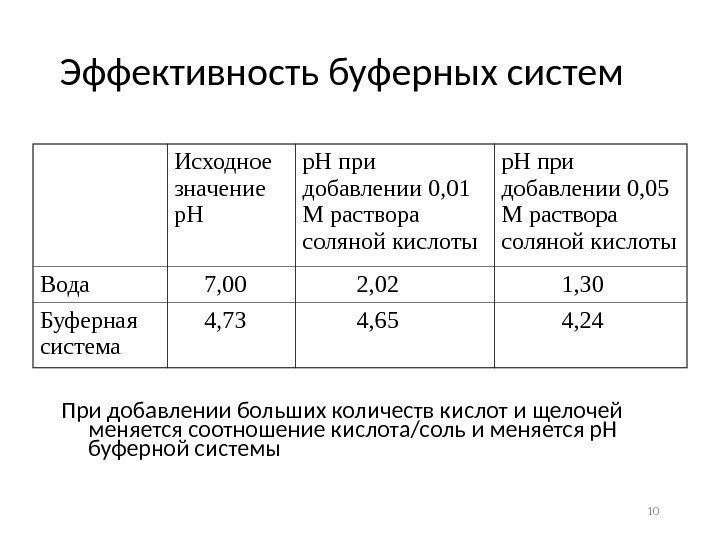
 Эффективность буферных систем Исходное значение р. Н при добавлении 0, 01 М раствора соляной кислоты р. Н при добавлении 0, 05 М раствора соляной кислоты Вода 7, 00 2, 02 1, 30 Буферная система 4, 73 4, 65 4, 24 При добавлении больших количеств кислот и щелочей меняется соотношение кислота/соль и меняется р. Н буферной системы
Эффективность буферных систем Исходное значение р. Н при добавлении 0, 01 М раствора соляной кислоты р. Н при добавлении 0, 05 М раствора соляной кислоты Вода 7, 00 2, 02 1, 30 Буферная система 4, 73 4, 65 4, 24 При добавлении больших количеств кислот и щелочей меняется соотношение кислота/соль и меняется р. Н буферной системы
 Буферная емкость (В) • Количество молей эквивалентов сильной кислоты или основания, которое необходимо добавить к 1 литру буферной смеси, чтобы изменить р. Н на единицу В = ——— = —— (р. Н 2 – р. Н 1 ) V Л р. Н V Л Буферная емкость рассчитывается и по кислоте (В а ) и по основанию (В в ). Эти величины обычно не одинаковы.
Буферная емкость (В) • Количество молей эквивалентов сильной кислоты или основания, которое необходимо добавить к 1 литру буферной смеси, чтобы изменить р. Н на единицу В = ——— = —— (р. Н 2 – р. Н 1 ) V Л р. Н V Л Буферная емкость рассчитывается и по кислоте (В а ) и по основанию (В в ). Эти величины обычно не одинаковы.
 Буферная емкость зависит от: • Абсолютной концентрации компонентов буферной системы • От соотношения между этими концентрациями Наибольшей буферной емкостью будут обладать растворы с соотношением: [ кислота ] ——- = 1 [ соль ]
Буферная емкость зависит от: • Абсолютной концентрации компонентов буферной системы • От соотношения между этими концентрациями Наибольшей буферной емкостью будут обладать растворы с соотношением: [ кислота ] ——- = 1 [ соль ]
 Пример Имеем два ацетатных буфера, концентрация компонентов в одном составляет 10 мг-экв, а в другом 100 мг-экв. Соотношение компонентов кислота/соль = 1. Добавим к каждому буферу по 5 мг-экв HCI [ кислота ] 10 + 5 15 —— = —— = 3; [ соль ] 10 – 5 5 [ кислота ] 100 + 5 105 —— = —— 1; [ соль ] 100 –
Пример Имеем два ацетатных буфера, концентрация компонентов в одном составляет 10 мг-экв, а в другом 100 мг-экв. Соотношение компонентов кислота/соль = 1. Добавим к каждому буферу по 5 мг-экв HCI [ кислота ] 10 + 5 15 —— = —— = 3; [ соль ] 10 – 5 5 [ кислота ] 100 + 5 105 —— = —— 1; [ соль ] 100 –
 Рабочий участок буферной системы • Значение р. Н, при котором сохраняются свойства буферной системы (р. Н = р. К 1) Способность противодействовать изменению значения р. Н наиболее высокая в точке р. Н = р. К и эффективна в пределах р. К
Рабочий участок буферной системы • Значение р. Н, при котором сохраняются свойства буферной системы (р. Н = р. К 1) Способность противодействовать изменению значения р. Н наиболее высокая в точке р. Н = р. К и эффективна в пределах р. К
 Буферные системы организма • Гидрокарбонатная • Белковая • Гемоглобиновая-оксигемоглобиновая • Фосфатная • Аминокислотная
Буферные системы организма • Гидрокарбонатная • Белковая • Гемоглобиновая-оксигемоглобиновая • Фосфатная • Аминокислотная
 Буферные системы плазмы крови Гидрокарбонатная буферная система H 2 CO 3 + Na. HCO 3 Является первой по значимости; составляет в плазме 35% буферной емкости крови и 18% — в эритроцитах (всего 53%)
Буферные системы плазмы крови Гидрокарбонатная буферная система H 2 CO 3 + Na. HCO 3 Является первой по значимости; составляет в плазме 35% буферной емкости крови и 18% — в эритроцитах (всего 53%)
 Ее особенности в организме • Действие тесно связано с функцией дыхания организма • Один из компонентов буферной системы (угольная кислота) образуется в крови из CO 2( г) CO 2( р) H 2 CO 3 H + + HCO 3 — • Концентрация CO 2 в крови определяется коэффициентом растворимости при 37 º C и парциальным давлением р CO 2 [H 2 CO 3 ] = C p. CO
Ее особенности в организме • Действие тесно связано с функцией дыхания организма • Один из компонентов буферной системы (угольная кислота) образуется в крови из CO 2( г) CO 2( р) H 2 CO 3 H + + HCO 3 — • Концентрация CO 2 в крови определяется коэффициентом растворимости при 37 º C и парциальным давлением р CO 2 [H 2 CO 3 ] = C p. CO
![Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO 3 - ] p. H = р. Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO 3 - ] p. H = р.](http://present5.com/presentforday2/20170210/bufernye_sistemy_№1_images/bufernye_sistemy_№1_17.jpg) Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO 3 — ] p. H = р. К( H 2 CO 3 ) + lg——- ; [H 2 CO 3 ] [HCO 3 — ] р. Н = р. К( H 2 CO 3 ) + lg——- C p. CO 2 В организме: [HCO 3 — ] —— = 10 [H 2 CO 3 ] р. Н = 6, 4 + lg 10 = 6, 4 + 1 = 7,
Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO 3 — ] p. H = р. К( H 2 CO 3 ) + lg——- ; [H 2 CO 3 ] [HCO 3 — ] р. Н = р. К( H 2 CO 3 ) + lg——- C p. CO 2 В организме: [HCO 3 — ] —— = 10 [H 2 CO 3 ] р. Н = 6, 4 + lg 10 = 6, 4 + 1 = 7,
 Механизм действия HCO 3 — /H 2 CO 3 • В случае накопления кислот в крови расходуется Na. HCO 3 : HCO 3 — + H 2 CO 3 При повышении кислотности увеличивается объем легочной вентиляции: H 2 CO 3 CO 2 + H 2 O • При увеличении щелочности расходуется H 2 CO 3 , уменьшается легочная вентиляция, накапливается CO 2 : H 2 CO 3 + OH — H 2 O + HCO 3 —
Механизм действия HCO 3 — /H 2 CO 3 • В случае накопления кислот в крови расходуется Na. HCO 3 : HCO 3 — + H 2 CO 3 При повышении кислотности увеличивается объем легочной вентиляции: H 2 CO 3 CO 2 + H 2 O • При увеличении щелочности расходуется H 2 CO 3 , уменьшается легочная вентиляция, накапливается CO 2 : H 2 CO 3 + OH — H 2 O + HCO 3 —
 Механизмы регуляции дыхания стабилизируют буферное соотношение в гидрокарбонатном буфере. Чувствительность дыхательного центра к изменению р. Н очень велика. Уменьшение р. Н на 0, 1 Увеличивает объем легочной вентиляции в 2 раза Таким образом, механизм действия гидрокарбонатного буфера связан с функцией дыхания
Механизмы регуляции дыхания стабилизируют буферное соотношение в гидрокарбонатном буфере. Чувствительность дыхательного центра к изменению р. Н очень велика. Уменьшение р. Н на 0, 1 Увеличивает объем легочной вентиляции в 2 раза Таким образом, механизм действия гидрокарбонатного буфера связан с функцией дыхания
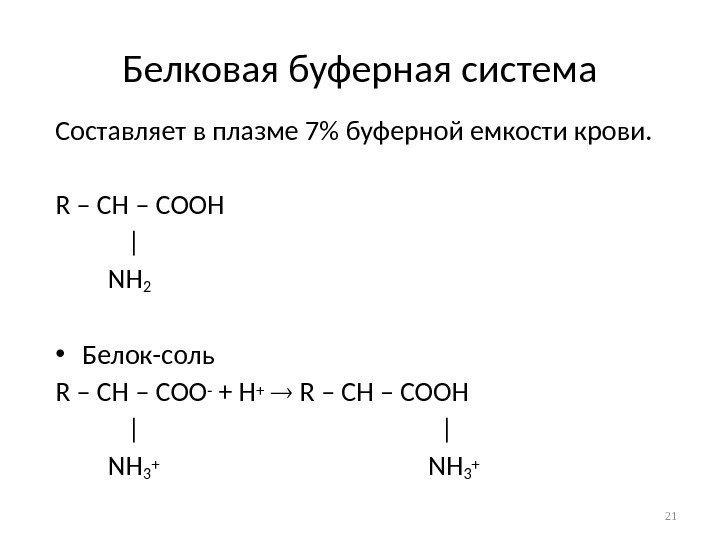
 Белковая буферная система Составляет в плазме 7% буферной емкости крови. R – CH – COOH | NH 2 • Белок-соль R – CH – COO — + H + R – CH – COOH | | NH 3 +
Белковая буферная система Составляет в плазме 7% буферной емкости крови. R – CH – COOH | NH 2 • Белок-соль R – CH – COO — + H + R – CH – COOH | | NH 3 +
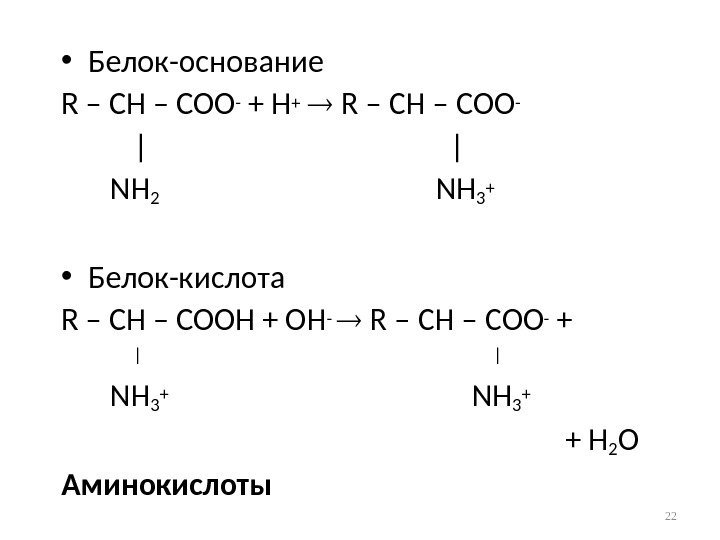
 • Белок-основание R – CH – COO- + H+ R – CH – COO- | | NH 2 NH 3 + • Белок-кислота R – CH – COOH + OH — R – CH – COO- + || NH 3 + + H 2 O Аминокислоты
• Белок-основание R – CH – COO- + H+ R – CH – COO- | | NH 2 NH 3 + • Белок-кислота R – CH – COOH + OH — R – CH – COO- + || NH 3 + + H 2 O Аминокислоты
 Фосфатная буферная система Na 2 HPO 4 + Na. H 2 PO 4 Концентрация ее компонентов в плазме невелика (фосфаты выводятся с мочой). Составляет в плазме 1% буферной емкости крови и 4% — в эритроцитах. Наибольшее значение имеет в тканях, моче, пищеварительных соках. В крови буферное соотношение Na 2 HPO 4 —— = 3 , 5 Na. H 2 PO 4 Фосфатная буферная система имеет более высокую емкость по кислоте
Фосфатная буферная система Na 2 HPO 4 + Na. H 2 PO 4 Концентрация ее компонентов в плазме невелика (фосфаты выводятся с мочой). Составляет в плазме 1% буферной емкости крови и 4% — в эритроцитах. Наибольшее значение имеет в тканях, моче, пищеварительных соках. В крови буферное соотношение Na 2 HPO 4 —— = 3 , 5 Na. H 2 PO 4 Фосфатная буферная система имеет более высокую емкость по кислоте
 Буферные системы эритроцитов Гемоглобиновый-оксигемоглобиновый буфер Составляет 35% буферной емкости крови HHb H + + Hb — ( р. К = 8, 2) HHb. O 2 H + + Hb. O 2 — ( р. К = 6, 95) HHb и HHb. O 2 – слабые кислоты, но HHb. O 2 – сильнее (около 65% HHb. O 2 находится в диссоциированном состоянии, а HHb – тоько на 10%) При добавлении кислот: H + + Hb — HHb ; При добавлении оснований: HHb. O 2 + OH — Hb. O 2 — + H 2 O
Буферные системы эритроцитов Гемоглобиновый-оксигемоглобиновый буфер Составляет 35% буферной емкости крови HHb H + + Hb — ( р. К = 8, 2) HHb. O 2 H + + Hb. O 2 — ( р. К = 6, 95) HHb и HHb. O 2 – слабые кислоты, но HHb. O 2 – сильнее (около 65% HHb. O 2 находится в диссоциированном состоянии, а HHb – тоько на 10%) При добавлении кислот: H + + Hb — HHb ; При добавлении оснований: HHb. O 2 + OH — Hb. O 2 — + H 2 O
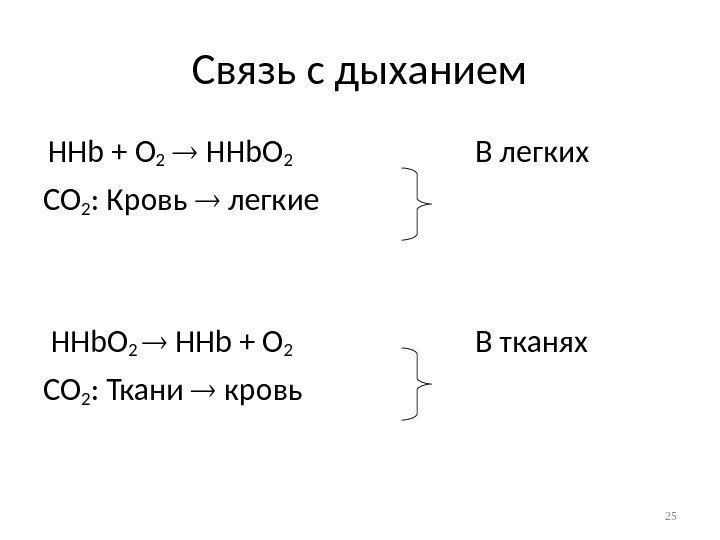
 Связь с дыханием HHb + O 2 HHb. O 2 В легких CO 2 : Кровь легкие HHb. O 2 HHb + O 2 В тканях CO 2 : Ткани кровь
Связь с дыханием HHb + O 2 HHb. O 2 В легких CO 2 : Кровь легкие HHb. O 2 HHb + O 2 В тканях CO 2 : Ткани кровь
 Кооперативность действия буферных систем крови Фосфатная буферная система проявляет кооперативность действия с гидрокарбонатной буферной системой. Если наступает истощение гидрокарбонатной буферной системы (в пределах 7, 4), то фосфатная способна поддерживать р. Н в пределах 6, 2 -8, 2. Большой вклад в буферную емкость вносят органические фосфаты: триозофосфаты, гексозофосфаты, аденозинфосфаты, а также фосфолипиды (строительный материал клеточных мембран); сама мембрана обладает буферным действием
Кооперативность действия буферных систем крови Фосфатная буферная система проявляет кооперативность действия с гидрокарбонатной буферной системой. Если наступает истощение гидрокарбонатной буферной системы (в пределах 7, 4), то фосфатная способна поддерживать р. Н в пределах 6, 2 -8, 2. Большой вклад в буферную емкость вносят органические фосфаты: триозофосфаты, гексозофосфаты, аденозинфосфаты, а также фосфолипиды (строительный материал клеточных мембран); сама мембрана обладает буферным действием
 Кислотно-основное равновесие • Соотношение кислотных и основных свойств крови
Кислотно-основное равновесие • Соотношение кислотных и основных свойств крови
 Показатели кислотно-основного состояния крови • р. Н крови (7, 4 0, 05) • Парциальное давление CO 2 p CO 2 = 40 5 мм рт. ст. алкалоз: 10 мм рт. ст. ацидоз: 130 мм рт. ст. • Содержание гидрокарбонатов в плазме C(H 2 CO 3 ) = 24. 4 3 ммоль/л • Общее содержание буферных оснований в плазме крови (ВВ = 42 3 ммоль/л) • Избыток или дефицит буферных оснований в крови (ВЕ) – в норме 3, при патологии 30 ммоль/л
Показатели кислотно-основного состояния крови • р. Н крови (7, 4 0, 05) • Парциальное давление CO 2 p CO 2 = 40 5 мм рт. ст. алкалоз: 10 мм рт. ст. ацидоз: 130 мм рт. ст. • Содержание гидрокарбонатов в плазме C(H 2 CO 3 ) = 24. 4 3 ммоль/л • Общее содержание буферных оснований в плазме крови (ВВ = 42 3 ммоль/л) • Избыток или дефицит буферных оснований в крови (ВЕ) – в норме 3, при патологии 30 ммоль/л
 Резервная щелочность крови • Способность крови связывать CO 2 Она определяется количеством CO 2 , связанной в виде гидрокарбонатов. Определяют общее количество CO 2 и количество физически растворимой CO 2 в исследуемой плазме. Вычитая из первой цифры вторую, получают искомую величину. Она выражается в объемных процентах CO 2 (объем CO 2 в мл на 100 мл плазмы). В плазме у человека резервная щелочность составляет 50 -65% CO
Резервная щелочность крови • Способность крови связывать CO 2 Она определяется количеством CO 2 , связанной в виде гидрокарбонатов. Определяют общее количество CO 2 и количество физически растворимой CO 2 в исследуемой плазме. Вычитая из первой цифры вторую, получают искомую величину. Она выражается в объемных процентах CO 2 (объем CO 2 в мл на 100 мл плазмы). В плазме у человека резервная щелочность составляет 50 -65% CO
 Нарушения К-О равновесия Уменьшение емкости буферных систем крови по кислоте (ацидоз) или по щелочи (алкалоз) Причины: • Дыхание (состав газовой смеси, частота) • Потребление кислот и оснований • Метаболизм (диабет)
Нарушения К-О равновесия Уменьшение емкости буферных систем крови по кислоте (ацидоз) или по щелочи (алкалоз) Причины: • Дыхание (состав газовой смеси, частота) • Потребление кислот и оснований • Метаболизм (диабет)
 Виды нарушений К-О равновесия • Компенсированный ацидоз • Некомпенсированный ацидоз • Компенсированный алкалоз • Некомпенсированный алкалоз
Виды нарушений К-О равновесия • Компенсированный ацидоз • Некомпенсированный ацидоз • Компенсированный алкалоз • Некомпенсированный алкалоз
 Коррекция нарушений К-О равновесия • Натрия гидрокарбонат (4, 5% раствор, р. Н = 8, 1; 100 -200 мл) применяют при ацидозе (сахарный диабет, инфекции, травмы), вводят в/в. В тяжелых случаях – 100 мл 8, 4% раствора • Трисамин ( «трисбуфер» ) – триоксиметиламинометан. Водный раствор 3, 66% (изотонический) р. Н = 10, 2 обладает буферным действием, устраняет ацидоз; вводят в/в • Аскорбиновая кислота (5% раствор) применяют при алкалозе, вводят в/в
Коррекция нарушений К-О равновесия • Натрия гидрокарбонат (4, 5% раствор, р. Н = 8, 1; 100 -200 мл) применяют при ацидозе (сахарный диабет, инфекции, травмы), вводят в/в. В тяжелых случаях – 100 мл 8, 4% раствора • Трисамин ( «трисбуфер» ) – триоксиметиламинометан. Водный раствор 3, 66% (изотонический) р. Н = 10, 2 обладает буферным действием, устраняет ацидоз; вводят в/в • Аскорбиновая кислота (5% раствор) применяют при алкалозе, вводят в/в
