1″Коллигативные свойства растворов. » 2 Граф структуры
































02-2_kolligativnye_svoystva.ppt
- Размер: 5.3 Мб
- Автор:
- Количество слайдов: 48
Описание презентации 1″Коллигативные свойства растворов. » 2 Граф структуры по слайдам
 1″Коллигативные свойства растворов. «
1″Коллигативные свойства растворов. «
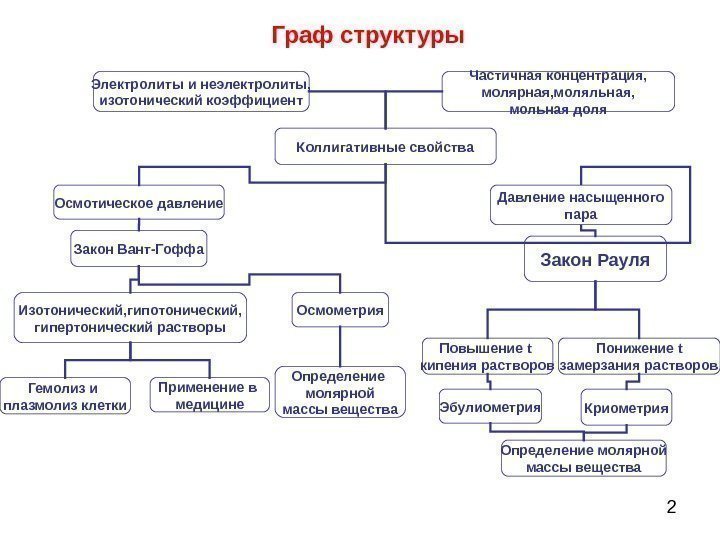
 2 Граф структуры Электролиты и неэлектролиты, изотонический коэффициент Частичная концентрация, молярная, моляльная, мольная доля Коллигативные свойства Осмотическое давление Закон Рауля. Давление насыщенного пара Закон Вант-Гоффа Повышение t кипения растворов. Изотонический, гипертонический растворы Осмометрия Гемолиз и плазмолиз клетки Применение в медицине Эбулиометрия Криометрия. Определение молярной массы вещества Понижение t замерзания растворов
2 Граф структуры Электролиты и неэлектролиты, изотонический коэффициент Частичная концентрация, молярная, моляльная, мольная доля Коллигативные свойства Осмотическое давление Закон Рауля. Давление насыщенного пара Закон Вант-Гоффа Повышение t кипения растворов. Изотонический, гипертонический растворы Осмометрия Гемолиз и плазмолиз клетки Применение в медицине Эбулиометрия Криометрия. Определение молярной массы вещества Понижение t замерзания растворов
 3 Коллигативные (коллективные) — зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц Понижение давления пара растворителя. Повышение температуры кипения растворителя. Понижение температуры замерзания растворителя. Явление осмотического давления. Коллигативные свойства позволили Аррениусу показать, что молекулы растворенного вещества в растворе диссоциируют на ионы. Коллигативные свойства используются главным образом для определения молекулярных масс неизвестных веществ.
3 Коллигативные (коллективные) — зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц Понижение давления пара растворителя. Повышение температуры кипения растворителя. Понижение температуры замерзания растворителя. Явление осмотического давления. Коллигативные свойства позволили Аррениусу показать, что молекулы растворенного вещества в растворе диссоциируют на ионы. Коллигативные свойства используются главным образом для определения молекулярных масс неизвестных веществ.
 4 Закон Рауля: а) Парциальное давление насыщенного пара данного компонента над раствором прямо пропорционально его мольной доле: OHo OHNPP 22· б) Относительное понижение давления растворителя равно мольной доле растворенного вещества. A N P o OH 22 P P 1. Понижение давления пара растворителя: (нелетучее вещество в летучем растворителе) Основное направление научных исследований – химия растворов. Его имя связано главным образом с созданием основ криоскопии. Открыл носящий его имя закон о понижении давления пара растворителя. Сконструировал газовую горелку. Рауль Франсуа (10. 05. 1830 – 1. 06. 1901)
4 Закон Рауля: а) Парциальное давление насыщенного пара данного компонента над раствором прямо пропорционально его мольной доле: OHo OHNPP 22· б) Относительное понижение давления растворителя равно мольной доле растворенного вещества. A N P o OH 22 P P 1. Понижение давления пара растворителя: (нелетучее вещество в летучем растворителе) Основное направление научных исследований – химия растворов. Его имя связано главным образом с созданием основ криоскопии. Открыл носящий его имя закон о понижении давления пара растворителя. Сконструировал газовую горелку. Рауль Франсуа (10. 05. 1830 – 1. 06. 1901)
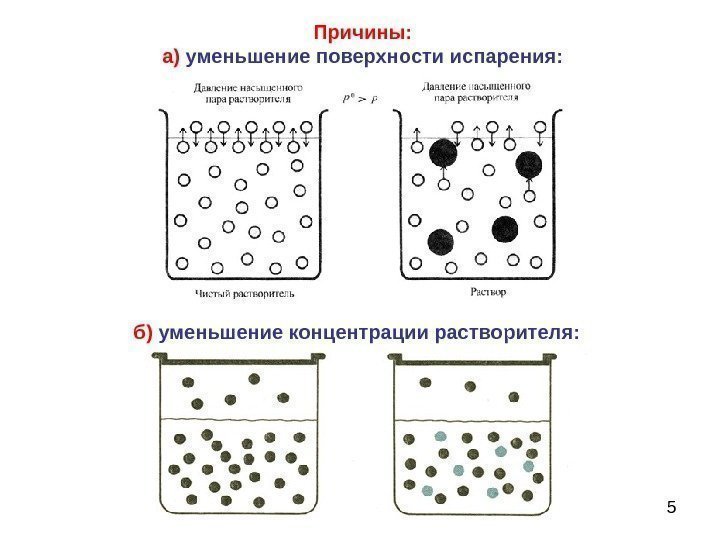
 5 Причины: а) уменьшение поверхности испарения: б) уменьшение концентрации растворителя:
5 Причины: а) уменьшение поверхности испарения: б) уменьшение концентрации растворителя:
 6 Для идеальных растворов понижение давления насыщенного пара растворителя не зависит от природы растворенного нелетучего вещества. Для реальных растворов, где имеют место межмолекулярные взаимодействия, в это уравнение необходимо ввести изотонический коэффициент: : , причем 0 0 Ai. N p pp 1 i 1 i 1 i для электролитов для неэлектролитов для веществ, склонных к диссоциации
6 Для идеальных растворов понижение давления насыщенного пара растворителя не зависит от природы растворенного нелетучего вещества. Для реальных растворов, где имеют место межмолекулярные взаимодействия, в это уравнение необходимо ввести изотонический коэффициент: : , причем 0 0 Ai. N p pp 1 i 1 i 1 i для электролитов для неэлектролитов для веществ, склонных к диссоциации
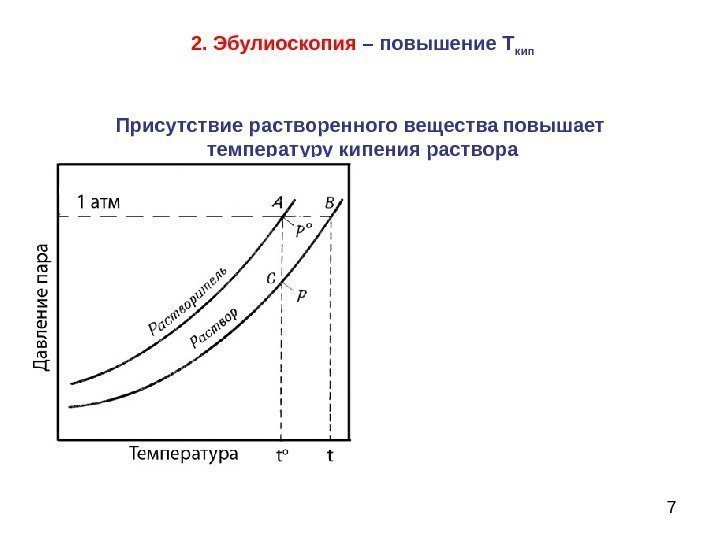
 72. Эбулиоскопия – повышение Т кип Присутствие растворенного вещества повышает температуру кипения раствора
72. Эбулиоскопия – повышение Т кип Присутствие растворенного вещества повышает температуру кипения раствора
 8, m·КТэкип. Кэ – эбулиоскопическая константа (град/моль·кг); m – моляльность (число моль вещества в 1000 г растворителя; ) лярвав экип m·M 1000·m КТ Эбулиоскопия — способ определения М вещества
8, m·КТэкип. Кэ – эбулиоскопическая константа (град/моль·кг); m – моляльность (число моль вещества в 1000 г растворителя; ) лярвав экип m·M 1000·m КТ Эбулиоскопия — способ определения М вещества
 9 Растворитель Эбулиоскопическа я константа К э , о С Растворитель Эбулиоскопическ ая константа К э , о С Вода Бензол Анилин 0, 516 2, 57 3, 69 Этиловый спирт Уксусная кислота CCl 4 1 , 16 3, 10 5, 00 Значения Кэляркип вав э m·Т 1000·m КМ
9 Растворитель Эбулиоскопическа я константа К э , о С Растворитель Эбулиоскопическ ая константа К э , о С Вода Бензол Анилин 0, 516 2, 57 3, 69 Этиловый спирт Уксусная кислота CCl 4 1 , 16 3, 10 5, 00 Значения Кэляркип вав э m·Т 1000·m КМ
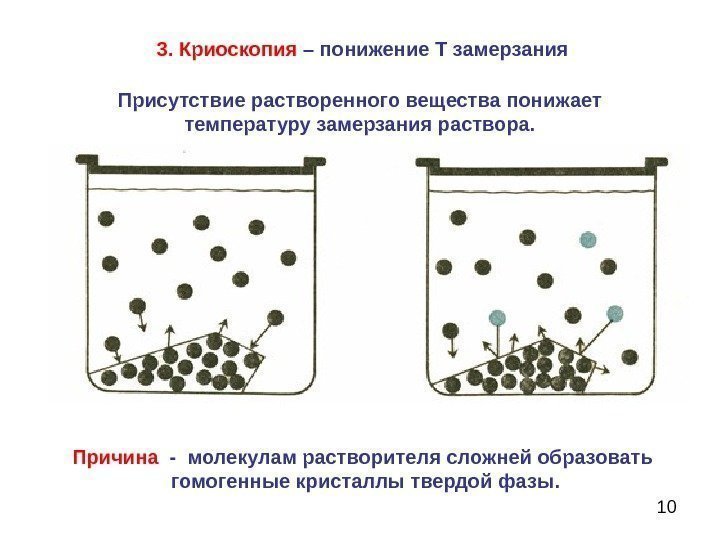
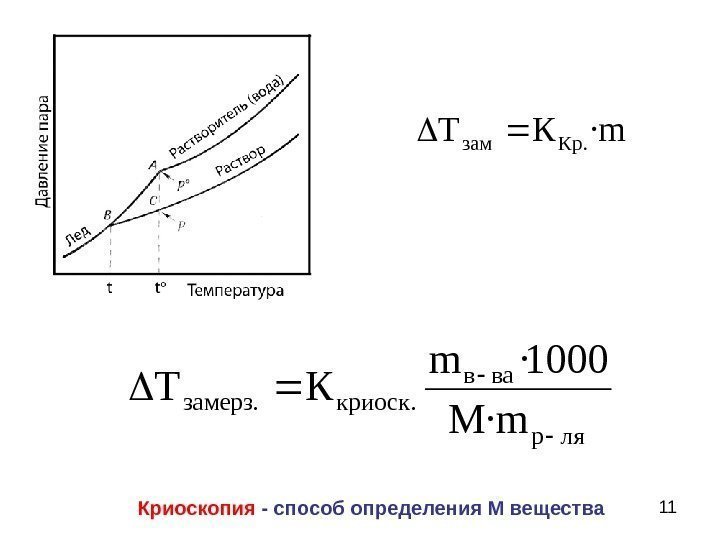
 103. Криоскопия – понижение Т замерзания Присутствие растворенного вещества понижает температуру замерзания раствора. Причина — молекулам растворителя сложней образовать гомогенные кристаллы твердой фазы.
103. Криоскопия – понижение Т замерзания Присутствие растворенного вещества понижает температуру замерзания раствора. Причина — молекулам растворителя сложней образовать гомогенные кристаллы твердой фазы.
 11 m·КТ. Крзам ляр вав. криоск. замерз m·M 1000·m КТ Криоскопия — способ определения М вещества
11 m·КТ. Крзам ляр вав. криоск. замерз m·M 1000·m КТ Криоскопия — способ определения М вещества
 12 Растворитель Криоскопическая константа К кр , о С Вода Бензол Анилин Фенол 1, 86 5, 12 5, 87 7, 27 Значения К кр ляр. замерз вав. криоскm·Т 1000·m КМ
12 Растворитель Криоскопическая константа К кр , о С Вода Бензол Анилин Фенол 1, 86 5, 12 5, 87 7, 27 Значения К кр ляр. замерз вав. криоскm·Т 1000·m КМ
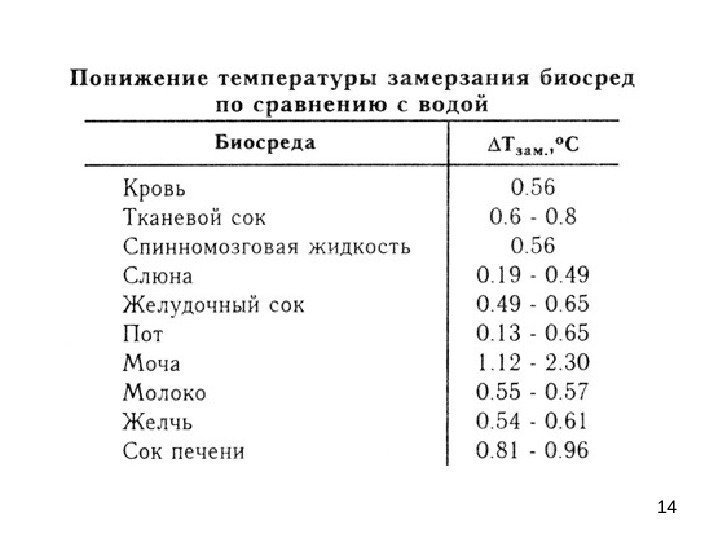
 13 Растворы различных веществ в воде замерзают при температуре ниже 0 o С Одномоляльные растворы различных веществ в воде замерзают при температуре -1. 86 o С
13 Растворы различных веществ в воде замерзают при температуре ниже 0 o С Одномоляльные растворы различных веществ в воде замерзают при температуре -1. 86 o С

 15 неорганические: хлориды аммония, натрия, магния, кальция, а также карбонат калия. органические: этиловый спирт, глицерин и этиленгликоль. Насыщенный раствор хлористого кальция остается жидким до — 55 °С. Антифризы — вещества, понижающие температуру замерзания водных растворов
15 неорганические: хлориды аммония, натрия, магния, кальция, а также карбонат калия. органические: этиловый спирт, глицерин и этиленгликоль. Насыщенный раствор хлористого кальция остается жидким до — 55 °С. Антифризы — вещества, понижающие температуру замерзания водных растворов
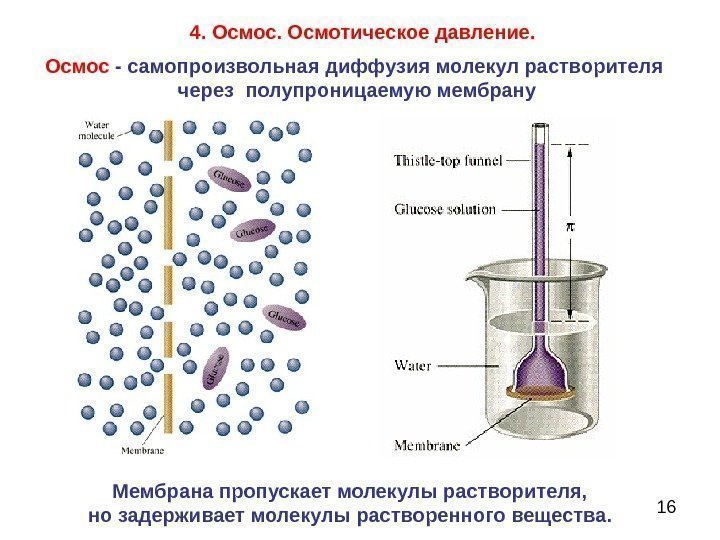
 164. Осмос. Осмотическое давление. Осмос — самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану Мембрана пропускает молекулы растворителя, но задерживает молекулы растворенного вещества.
164. Осмос. Осмотическое давление. Осмос — самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану Мембрана пропускает молекулы растворителя, но задерживает молекулы растворенного вещества.
 17 Осмотическое давление – минимальное гидравлическое давление, которое нужно приложить к раствору, чтобы осмос прекратился. Причина осмоса — стремление вещества распределяться равномерно по всему объему растворителя.
17 Осмотическое давление – минимальное гидравлическое давление, которое нужно приложить к раствору, чтобы осмос прекратился. Причина осмоса — стремление вещества распределяться равномерно по всему объему растворителя.
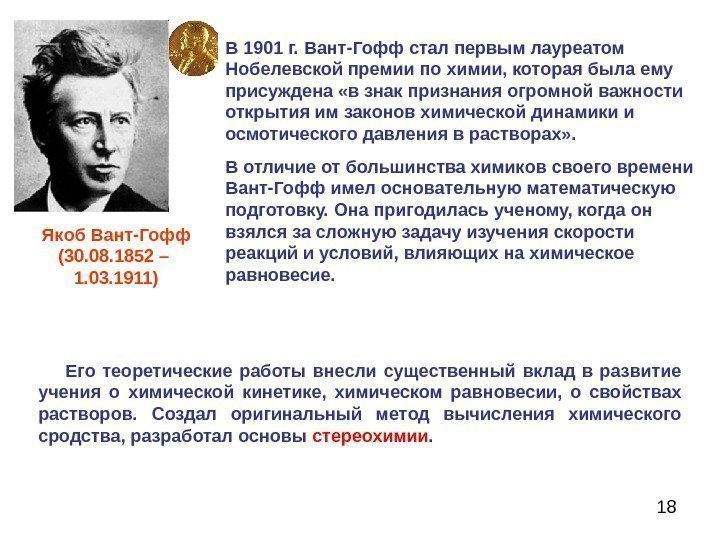
 18 В 1901 г. Вант-Гофф стал первым лауреатом Нобелевской премии по химии, которая была ему присуждена «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах» . В отличие от большинства химиков своего времени Вант-Гофф имел основательную математическую подготовку. Она пригодилась ученому, когда он взялся за сложную задачу изучения скорости реакций и условий, влияющих на химическое равновесие. Якоб Вант-Гофф (30. 08. 1852 – 1. 03. 1911) Его теоретические работы внесли существенный вклад в развитие учения о химической кинетике, химическом равновесии, о свойствах растворов. Создал оригинальный метод вычисления химического сродства, разработал основы стереохимии.
18 В 1901 г. Вант-Гофф стал первым лауреатом Нобелевской премии по химии, которая была ему присуждена «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах» . В отличие от большинства химиков своего времени Вант-Гофф имел основательную математическую подготовку. Она пригодилась ученому, когда он взялся за сложную задачу изучения скорости реакций и условий, влияющих на химическое равновесие. Якоб Вант-Гофф (30. 08. 1852 – 1. 03. 1911) Его теоретические работы внесли существенный вклад в развитие учения о химической кинетике, химическом равновесии, о свойствах растворов. Создал оригинальный метод вычисления химического сродства, разработал основы стереохимии.
 19 Невольно большую роль в популяризации новых взглядов Вант-Гоффа принадлежала профессору Г. Кольбе из Лейпцига. В резкой форме он высказал свои замечания по поводу статьи голландского ученого: «Какой-то доктор Я. Г. Вант-Гофф из Ветеринарного института в Утрехте, видимо, не имеет вкуса к точным химическим исследованиям. Ему значительно удобнее воссесть на Пегаса (вероятно, взятого напрокат в Ветеринарном институте) и провозгласить в своей «Химии в пространстве», что, как ему показалось во время смелого полета к химическому Парнасу, атомы расположены в межпланетном пространстве». Естественно, каждого, кто прочел эту резкую отповедь, заинтересовала теория Вант-Гоффа. Так началось ее быстрое распространение в научном мире. В 1845 году Георг Кольбе синтезировал уксусную кислоту
19 Невольно большую роль в популяризации новых взглядов Вант-Гоффа принадлежала профессору Г. Кольбе из Лейпцига. В резкой форме он высказал свои замечания по поводу статьи голландского ученого: «Какой-то доктор Я. Г. Вант-Гофф из Ветеринарного института в Утрехте, видимо, не имеет вкуса к точным химическим исследованиям. Ему значительно удобнее воссесть на Пегаса (вероятно, взятого напрокат в Ветеринарном институте) и провозгласить в своей «Химии в пространстве», что, как ему показалось во время смелого полета к химическому Парнасу, атомы расположены в межпланетном пространстве». Естественно, каждого, кто прочел эту резкую отповедь, заинтересовала теория Вант-Гоффа. Так началось ее быстрое распространение в научном мире. В 1845 году Георг Кольбе синтезировал уксусную кислоту
 20 RTc. P М V n. RT P Уравнение осмотического давления находит широкое применение, при определении молекулярных весов макромолекул (каучук, целлюлоза, белки) Закон Вант-Гоффа Осмотическое давление вещества в растворе равно тому давлению, которое оно оказывало, если бы находилось в том же объеме, будучи в газообразном состоянии. Вант-Гофф и Вильгельм Оствальд в лаборатории
20 RTc. P М V n. RT P Уравнение осмотического давления находит широкое применение, при определении молекулярных весов макромолекул (каучук, целлюлоза, белки) Закон Вант-Гоффа Осмотическое давление вещества в растворе равно тому давлению, которое оно оказывало, если бы находилось в том же объеме, будучи в газообразном состоянии. Вант-Гофф и Вильгельм Оствальд в лаборатории
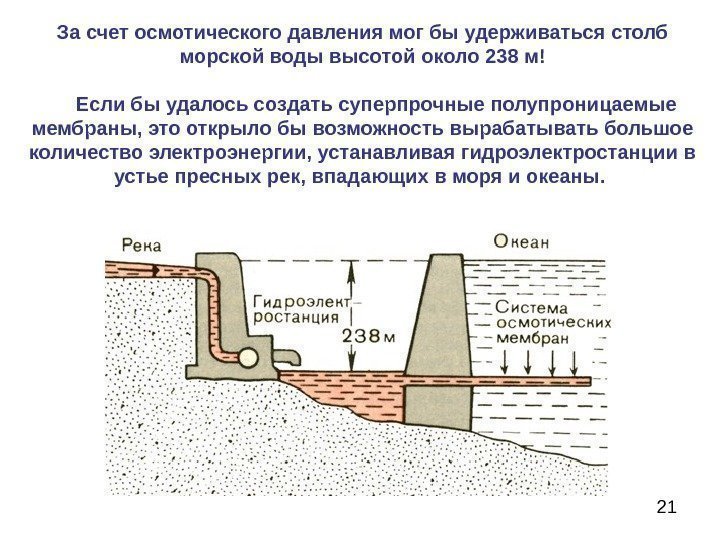
 21 За счет осмотического давления мог бы удерживаться столб морской воды высотой около 238 м! Если бы удалось создать суперпрочные полупроницаемые мембраны, это открыло бы возможность вырабатывать большое количество электроэнергии, устанавливая гидроэлектростанции в устье пресных рек, впадающих в моря и океаны.
21 За счет осмотического давления мог бы удерживаться столб морской воды высотой около 238 м! Если бы удалось создать суперпрочные полупроницаемые мембраны, это открыло бы возможность вырабатывать большое количество электроэнергии, устанавливая гидроэлектростанции в устье пресных рек, впадающих в моря и океаны.
 22 Ученые предполагают, что египтяне откалывали гранитные глыбы, заливая помещенные в расщелины скал стволы деревьев соленым раствором. Для 1 М раствора любого вещества при T = 273 К Р осм = 2270 к. Па или 22, 4 атм. 1 атм = 101. 325 к. Па
22 Ученые предполагают, что египтяне откалывали гранитные глыбы, заливая помещенные в расщелины скал стволы деревьев соленым раствором. Для 1 М раствора любого вещества при T = 273 К Р осм = 2270 к. Па или 22, 4 атм. 1 атм = 101. 325 к. Па
 23 Осмотическое давление плазмы крови человека — 7. 4 -7. 8 атм ( 740 – 780 к. Па) рыб до 15 атм. растений до 100 атм. прорастающих семян до 400 атм.
23 Осмотическое давление плазмы крови человека — 7. 4 -7. 8 атм ( 740 – 780 к. Па) рыб до 15 атм. растений до 100 атм. прорастающих семян до 400 атм.
 24 i показывает, во сколько раз истинная концентрация кинетически активных частиц в растворе электролита больше, чем в растворе неэлектролита с той же концентрацией Коэффициент Вант-Гоффа можно определить вышеизложенными методами. осм. не. . . π π эл элосм элкип элзам неэл эл P P t t C C i RTic. P М Для растворов электролитов в формулу вводится коэффициент Вант-Гоффа i
24 i показывает, во сколько раз истинная концентрация кинетически активных частиц в растворе электролита больше, чем в растворе неэлектролита с той же концентрацией Коэффициент Вант-Гоффа можно определить вышеизложенными методами. осм. не. . . π π эл элосм элкип элзам неэл эл P P t t C C i RTic. P М Для растворов электролитов в формулу вводится коэффициент Вант-Гоффа i
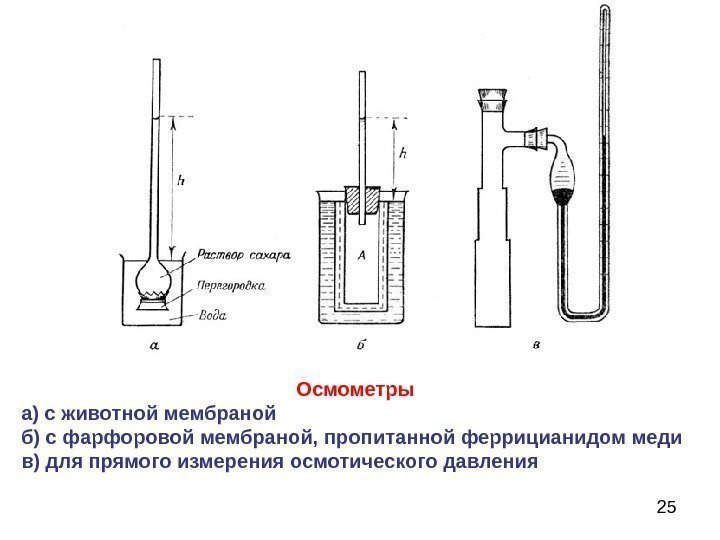
 25 Осмометры а) с животной мембраной б) с фарфоровой мембраной, пропитанной феррицианидом меди в) для прямого измерения осмотического давления
25 Осмометры а) с животной мембраной б) с фарфоровой мембраной, пропитанной феррицианидом меди в) для прямого измерения осмотического давления
 26 Онкотическое давление – осмотическое давление, создаваемое за счет наличия белков в биожидкостях организма и составляет 0, 5% от общего осмотического давления плазмы ( 0. 025 – 0. 04 атм ) Разрушение белков при гнойных процессах сильно увеличивает величину онкотического давления. При заболеваниях, сопровождающихся уменьшением концентрации белков крови, онкотическое давление падает. Возникают так называемые онкотические отеки подкожной клетчатки. Онкотическое давление играет важную роль в процессах всасывания жидкости из тканей в кровеносные сосуды.
26 Онкотическое давление – осмотическое давление, создаваемое за счет наличия белков в биожидкостях организма и составляет 0, 5% от общего осмотического давления плазмы ( 0. 025 – 0. 04 атм ) Разрушение белков при гнойных процессах сильно увеличивает величину онкотического давления. При заболеваниях, сопровождающихся уменьшением концентрации белков крови, онкотическое давление падает. Возникают так называемые онкотические отеки подкожной клетчатки. Онкотическое давление играет важную роль в процессах всасывания жидкости из тканей в кровеносные сосуды.
 27 Осмолярная концентрация — суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы ( 0. 29 – 0. 30 моль/л) Их суммарное осмотическое давление при 37°С составляет 7, 7 атм. Осмолярность (осмолярная концентрация) N a+ Cl -Ca 2 + -COO- Pt-COO — N H 3 + Fe 3+
27 Осмолярная концентрация — суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы ( 0. 29 – 0. 30 моль/л) Их суммарное осмотическое давление при 37°С составляет 7, 7 атм. Осмолярность (осмолярная концентрация) N a+ Cl -Ca 2 + -COO- Pt-COO — N H 3 + Fe 3+
 28 Физиологические растворы 0, 9%-ный ( 0, 15 М ) раствор Nа. С l и 5% — ный ( 0, 3 М ) раствор глюкозы создают такое же давление являющиеся, следовательно, изотоническими по отношению к крови. Истинно физиологическими !!! считаются растворы, включающие соли, белки и другие вещества в пропорциях, соответствующих их содержанию в крови человека и используемые в аппарате «искусственная почка»
28 Физиологические растворы 0, 9%-ный ( 0, 15 М ) раствор Nа. С l и 5% — ный ( 0, 3 М ) раствор глюкозы создают такое же давление являющиеся, следовательно, изотоническими по отношению к крови. Истинно физиологическими !!! считаются растворы, включающие соли, белки и другие вещества в пропорциях, соответствующих их содержанию в крови человека и используемые в аппарате «искусственная почка»
 29 Изоосмия — постоянство осмотического давления физиологических сред (фундаментальное физико-химическое требование гомеостаза). Нарушение изоосмии оказывается губительным для организма гораздо раньше, чем наступает плазмолиз или лизис клеток. Понижение осмотического давления (избыток воды, потеря солей) вызывает рвоту, судороги, затемнение сознания, вплоть до гибели организма. Повышение же осмотического давления (потеря воды, избыток солей) вызывает их отеки, в первую очередь подкожной клетчатке.
29 Изоосмия — постоянство осмотического давления физиологических сред (фундаментальное физико-химическое требование гомеостаза). Нарушение изоосмии оказывается губительным для организма гораздо раньше, чем наступает плазмолиз или лизис клеток. Понижение осмотического давления (избыток воды, потеря солей) вызывает рвоту, судороги, затемнение сознания, вплоть до гибели организма. Повышение же осмотического давления (потеря воды, избыток солей) вызывает их отеки, в первую очередь подкожной клетчатке.
 30 Изо-, гипер- и гипотонические растворы Изотонические — с одинаковым осмотическим давлением (0. 9%) Гипертонические — с большим осмотическим давлением ( > 0. 9%) Гипотонические — с меньшим осмотическим давлением ( < 0. 9%) Во всех случаях, когда в кровяное русло, мышечную ткань, спинномозговой канал в терапевтических целях вводят растворы, необходимо избегать «осмотического конфликта» .
30 Изо-, гипер- и гипотонические растворы Изотонические — с одинаковым осмотическим давлением (0. 9%) Гипертонические — с большим осмотическим давлением ( > 0. 9%) Гипотонические — с меньшим осмотическим давлением ( < 0. 9%) Во всех случаях, когда в кровяное русло, мышечную ткань, спинномозговой канал в терапевтических целях вводят растворы, необходимо избегать «осмотического конфликта» .
 31 Осмотический конфликт : внезапное изменение концентрации растворенных солей — например, если рыбу без постепенной акклиматизации пересаживают из воды, бедной минеральными солями, в воду, богатую минеральными солями ( в гипертонический раствор!). Это приводит к смерти рыбы в течение 2 -3 суток и часто является причиной высокой смертности среди недавно приобретенных рыб у невежественных или равнодушных аквариумистов. Лечение. Приведите содержание минеральных солей в воде к уровню, приемлемому для данного вида рыб. В случае осмотического шока это соответствие должно быть полным, а установить его нужно немедленно. Недавно приобретенных рыб, если они явно поражены, лучше перевести в другой аквариум с подходящим химическим составом воды (например, в карантинный аквариум, где они в любом случае должны какое-то время находиться!), вместо того чтобы изменять химический состав воды в основном аквариуме, так как это может вызвать осмотический шок у рыб, уже живущих там. Потом воду в карантинном аквариуме можно постепенно, в течение 2 -3 недель, привести в соответствие с водой в основном аквариуме и тогда перевести новых рыб в их постоянное жилище.
31 Осмотический конфликт : внезапное изменение концентрации растворенных солей — например, если рыбу без постепенной акклиматизации пересаживают из воды, бедной минеральными солями, в воду, богатую минеральными солями ( в гипертонический раствор!). Это приводит к смерти рыбы в течение 2 -3 суток и часто является причиной высокой смертности среди недавно приобретенных рыб у невежественных или равнодушных аквариумистов. Лечение. Приведите содержание минеральных солей в воде к уровню, приемлемому для данного вида рыб. В случае осмотического шока это соответствие должно быть полным, а установить его нужно немедленно. Недавно приобретенных рыб, если они явно поражены, лучше перевести в другой аквариум с подходящим химическим составом воды (например, в карантинный аквариум, где они в любом случае должны какое-то время находиться!), вместо того чтобы изменять химический состав воды в основном аквариуме, так как это может вызвать осмотический шок у рыб, уже живущих там. Потом воду в карантинном аквариуме можно постепенно, в течение 2 -3 недель, привести в соответствие с водой в основном аквариуме и тогда перевести новых рыб в их постоянное жилище.
 32 Осмотический шок : пребывание в воде, которая либо неестественно богата минеральными веществами, либо, наоборот, неестественно бедна ими. Осмотический стресс имеет более серьезные последствия для рыб тех видов, которые в природе обитают в водоемах, богатых минеральными веществами, а в аквариуме их держат в воде, крайне бедной этими веществами (гипотонический раствор!). Такие рыбы имеют менее эффективную систему осмотической регуляции, чем те, которые физиологически адаптированы к жизни в воде, бедной минеральными веществами. Поэтому они не способны справиться с возникающими в результате подобных условий перегрузками осморегулирующей системы. В случае осмотического стресса концентрацию растворенных солей следует изменять постепенно в течение 1 -2 недель, чтобы избежать осмотического шока.
32 Осмотический шок : пребывание в воде, которая либо неестественно богата минеральными веществами, либо, наоборот, неестественно бедна ими. Осмотический стресс имеет более серьезные последствия для рыб тех видов, которые в природе обитают в водоемах, богатых минеральными веществами, а в аквариуме их держат в воде, крайне бедной этими веществами (гипотонический раствор!). Такие рыбы имеют менее эффективную систему осмотической регуляции, чем те, которые физиологически адаптированы к жизни в воде, бедной минеральными веществами. Поэтому они не способны справиться с возникающими в результате подобных условий перегрузками осморегулирующей системы. В случае осмотического стресса концентрацию растворенных солей следует изменять постепенно в течение 1 -2 недель, чтобы избежать осмотического шока.
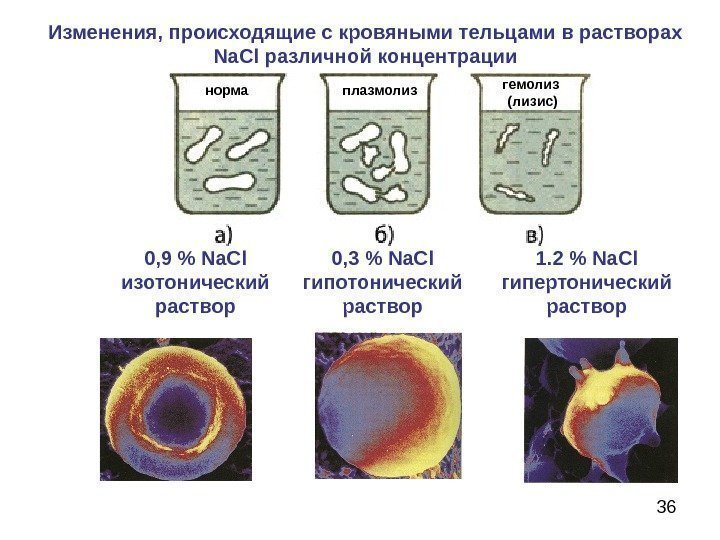
 33 Изменения, происходящие с кровяными тельцами в растворах Na. Cl различной концентрации При введении гипертонических наблюдается: 1) осмотический шок 2) осмотический конфликт 3) флуороз 4) ацидоз При введении гипотонических растворов наблюдается: 1) осмотический шок 2) осмотический конфликт 3) ацидоз 4) алкалоз
33 Изменения, происходящие с кровяными тельцами в растворах Na. Cl различной концентрации При введении гипертонических наблюдается: 1) осмотический шок 2) осмотический конфликт 3) флуороз 4) ацидоз При введении гипотонических растворов наблюдается: 1) осмотический шок 2) осмотический конфликт 3) ацидоз 4) алкалоз
 34 Рабочие «горячих» цехов должны пить подсоленную воду, так как в результате повышенного потоотделения осмотическое давление у них понижается !
34 Рабочие «горячих» цехов должны пить подсоленную воду, так как в результате повышенного потоотделения осмотическое давление у них понижается !
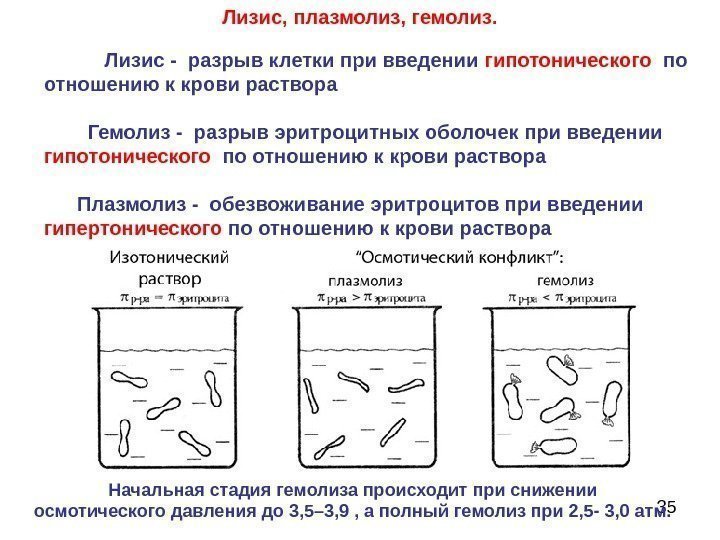
 35 Лизис, плазмолиз, гемолиз. Лизис — разрыв клетки при введении гипотонического по отношению к крови раствора Гемолиз — разрыв эритроцитных оболочек при введении гипотонического по отношению к крови раствора Плазмолиз — обезвоживание эритроцитов при введении гипертонического по отношению к крови раствора Начальная стадия гемолиза происходит при снижении осмотического давления до 3, 5– 3, 9 , а полный гемолиз при 2, 5 — 3, 0 атм.
35 Лизис, плазмолиз, гемолиз. Лизис — разрыв клетки при введении гипотонического по отношению к крови раствора Гемолиз — разрыв эритроцитных оболочек при введении гипотонического по отношению к крови раствора Плазмолиз — обезвоживание эритроцитов при введении гипертонического по отношению к крови раствора Начальная стадия гемолиза происходит при снижении осмотического давления до 3, 5– 3, 9 , а полный гемолиз при 2, 5 — 3, 0 атм.
 36 Изменения, происходящие с кровяными тельцами в растворах Na. Cl различной концентрации норма гемолиз (лизис)плазмолиз 0, 9 % Na. Cl изотонический раствор 0, 3 % Na. Cl гипотонический раствор 1. 2 % Na. Cl гипертонический раствор
36 Изменения, происходящие с кровяными тельцами в растворах Na. Cl различной концентрации норма гемолиз (лизис)плазмолиз 0, 9 % Na. Cl изотонический раствор 0, 3 % Na. Cl гипотонический раствор 1. 2 % Na. Cl гипертонический раствор
 37 Консервирование продуктов питания происходит благодаря уничтожению микроорганизмов вследствие их плазмолиза. Плазмолиз также наблюдается при посыпании ягод или фруктов сахаром, а овощей, мяса или рыбы — солью.
37 Консервирование продуктов питания происходит благодаря уничтожению микроорганизмов вследствие их плазмолиза. Плазмолиз также наблюдается при посыпании ягод или фруктов сахаром, а овощей, мяса или рыбы — солью.
 38 Тургор – осмотическое набухание клетки с появлением сильного внутреннего давления Тургор определяет объем и форму клеток (эритроцитов). Для нормального функционирования тургорное давление должно быть ниже осмотического — только в этих условиях наблюдается активный транспорт в клетку. Испарение воды листьями в окружающую среду (транспирация) поддерживается накоплением воды через ствол и ветви за счет осмотического давления.
38 Тургор – осмотическое набухание клетки с появлением сильного внутреннего давления Тургор определяет объем и форму клеток (эритроцитов). Для нормального функционирования тургорное давление должно быть ниже осмотического — только в этих условиях наблюдается активный транспорт в клетку. Испарение воды листьями в окружающую среду (транспирация) поддерживается накоплением воды через ствол и ветви за счет осмотического давления.
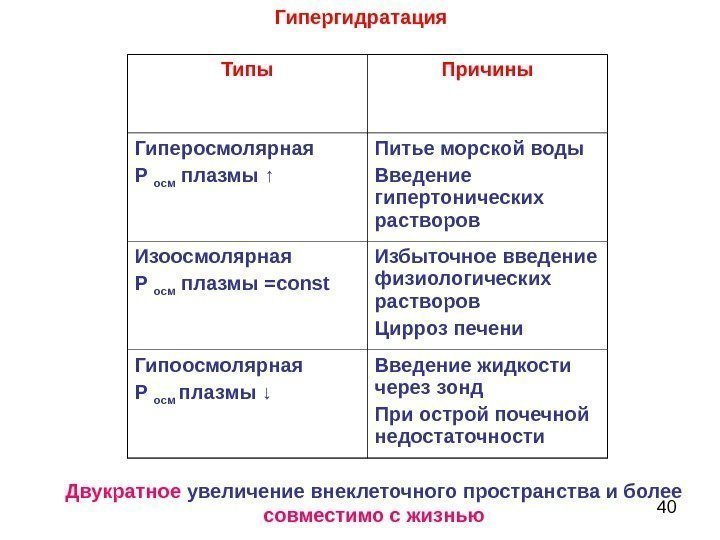
 39 Гипергидратация – избыточное поступление воды в организм либо недостаточное ее выведение Нарушения водного обмена
39 Гипергидратация – избыточное поступление воды в организм либо недостаточное ее выведение Нарушения водного обмена
 40 Типы Причины Гиперосмолярная Р осм плазмы ↑ Питье морской воды Введение гипертонических растворов Изоосмолярная Р осм плазмы = const Избыточное введение физиологических растворов Цирроз печени Гипоосмолярная Р осм плазмы ↓ Введение жидкости через зонд При острой почечной недостаточности. Гипергидратация Двукратное увеличение внеклеточного пространства и более совместимо с жизнью
40 Типы Причины Гиперосмолярная Р осм плазмы ↑ Питье морской воды Введение гипертонических растворов Изоосмолярная Р осм плазмы = const Избыточное введение физиологических растворов Цирроз печени Гипоосмолярная Р осм плазмы ↓ Введение жидкости через зонд При острой почечной недостаточности. Гипергидратация Двукратное увеличение внеклеточного пространства и более совместимо с жизнью
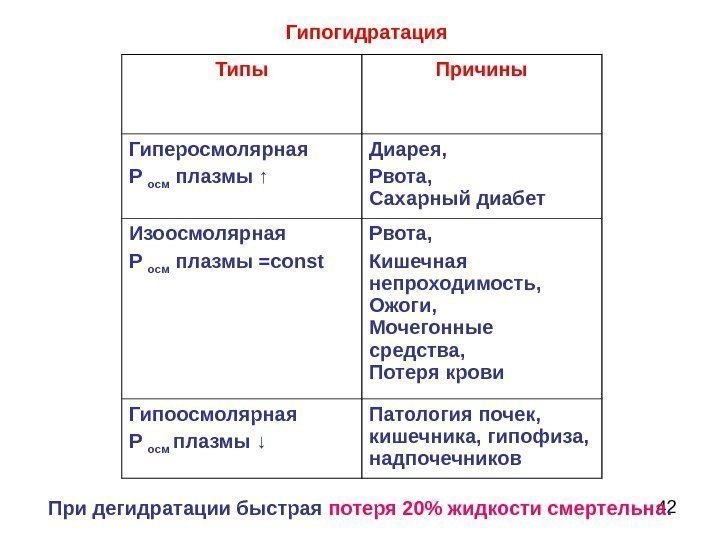
 41 Гипогидратация – обезвоживание организма вследствие значительного снижения поступления воды в организм, либо чрезмерные её потери.
41 Гипогидратация – обезвоживание организма вследствие значительного снижения поступления воды в организм, либо чрезмерные её потери.
 42 Типы Причины Гиперосмолярная Р осм плазмы ↑ Диарея, Рвота, Сахарный диабет Изоосмолярная Р осм плазмы = const Рвота, Кишечная непроходимость, Ожоги, Мочегонные средства, Потеря крови Гипоосмолярная Р осм плазмы ↓ Патология почек, кишечника, гипофиза, надпочечников. Гипогидратация При дегидратации быстрая потеря 20% жидкости смертельна.
42 Типы Причины Гиперосмолярная Р осм плазмы ↑ Диарея, Рвота, Сахарный диабет Изоосмолярная Р осм плазмы = const Рвота, Кишечная непроходимость, Ожоги, Мочегонные средства, Потеря крови Гипоосмолярная Р осм плазмы ↓ Патология почек, кишечника, гипофиза, надпочечников. Гипогидратация При дегидратации быстрая потеря 20% жидкости смертельна.
 43 Значение осмотического давления 1. Слабительное действие глауберовой соли Na 2 SO 4 · 10 H 2 O и горькой соли Mg. SO 4 · 7 H 2 O. Плохая всасываемость стенками желудка вызывает интенсивный переход воды внутрь кишечника, способствуя послабляющему действию.
43 Значение осмотического давления 1. Слабительное действие глауберовой соли Na 2 SO 4 · 10 H 2 O и горькой соли Mg. SO 4 · 7 H 2 O. Плохая всасываемость стенками желудка вызывает интенсивный переход воды внутрь кишечника, способствуя послабляющему действию.
 442. Осмотическая очистка морской воды
442. Осмотическая очистка морской воды
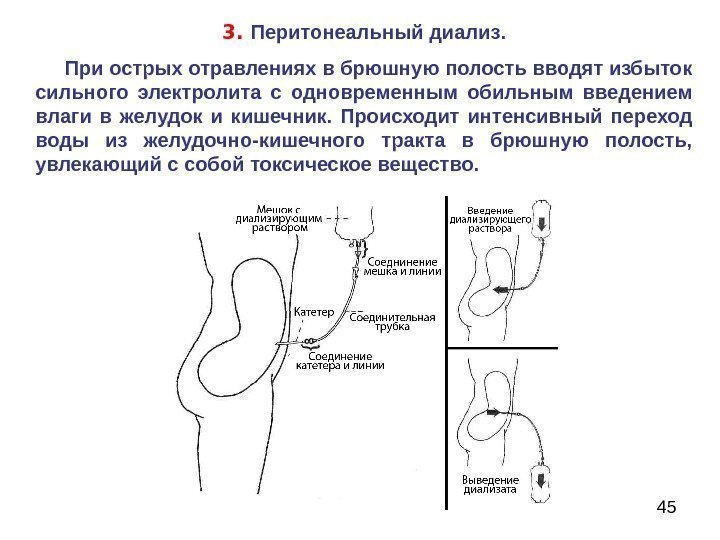
 453. Перитонеальный диализ. При острых отравлениях в брюшную полость вводят избыток сильного электролита с одновременным обильным введением влаги в желудок и кишечник. Происходит интенсивный переход воды из желудочно-кишечного тракта в брюшную полость, увлекающий с собой токсическое вещество.
453. Перитонеальный диализ. При острых отравлениях в брюшную полость вводят избыток сильного электролита с одновременным обильным введением влаги в желудок и кишечник. Происходит интенсивный переход воды из желудочно-кишечного тракта в брюшную полость, увлекающий с собой токсическое вещество.
 46 4. При очистке ран от гноя и носителей инфекции используют гипертонические марлевые повязки, пропитанные 10%-ным раствором Na. CI или этанолом. 5. При глаукоме гипертонические растворы вводят внутривенно чтобы снизить внутриглазное давление.
46 4. При очистке ран от гноя и носителей инфекции используют гипертонические марлевые повязки, пропитанные 10%-ным раствором Na. CI или этанолом. 5. При глаукоме гипертонические растворы вводят внутривенно чтобы снизить внутриглазное давление.
 47 6. Осмос и диализ — основа ряда физиологических процессов: усвоение пищи, окислительные процессы связанные с дыхательной цепи, распределение питательных веществ, жидкостной обмен в тканях, выделение продуктов жизнедеятельности. 7. Осмос при купании В пресной воде болевые ощущения, резь в глазах более заметны (осмос воды направлен внутрь глазного яблока). В морской воде замечается покраснение глаз с незначительными болевыми ощущениями (осмос воды направлен из глазного яблока в морскую воду)
47 6. Осмос и диализ — основа ряда физиологических процессов: усвоение пищи, окислительные процессы связанные с дыхательной цепи, распределение питательных веществ, жидкостной обмен в тканях, выделение продуктов жизнедеятельности. 7. Осмос при купании В пресной воде болевые ощущения, резь в глазах более заметны (осмос воды направлен внутрь глазного яблока). В морской воде замечается покраснение глаз с незначительными болевыми ощущениями (осмос воды направлен из глазного яблока в морскую воду)
 48 Спасибо за внимание!
48 Спасибо за внимание!
