1″Гидролиз» Кафедра общей и медицинской химии 2






![8 Домножим числитель и знаменатель на [H + ]: (к) д 3 3 8 Домножим числитель и знаменатель на [H + ]: (к) д 3 3](http://present5.com/presentforday2/20170109/03-2_gidroliz_images/03-2_gidroliz_7.jpg)
![9)3( )( 22 к. Д OH c. К K C ][OH Приравнивая формулы 9)3( )( 22 к. Д OH c. К K C ][OH Приравнивая формулы](http://present5.com/presentforday2/20170109/03-2_gidroliz_images/03-2_gidroliz_8.jpg)
![10 h. COH C C c cc ·][ ][ h ; h гидр 10 h. COH C C c cc ·][ ][ h ; h гидр](http://present5.com/presentforday2/20170109/03-2_gidroliz_images/03-2_gidroliz_9.jpg)













03-2_gidroliz.ppt
- Размер: 24.1 Мб
- Автор:
- Количество слайдов: 46
Описание презентации 1″Гидролиз» Кафедра общей и медицинской химии 2 по слайдам
 1″Гидролиз» Кафедра общей и медицинской химии
1″Гидролиз» Кафедра общей и медицинской химии
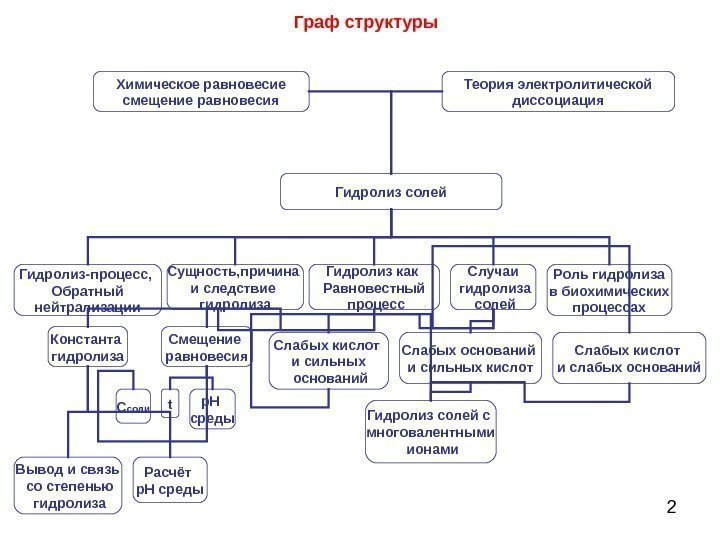
 2 Граф структуры Химическое равновесие смещение равновесия Теория электролитической диссоциация Гидролиз солей Гидролиз-процесс, Обратный нейтрализации Случаи гидролиза солей Слабых кислот и слабых оснований. Слабых оснований и сильных кислот. Слабых кислот и сильных оснований. Сущность, причина и следствие гидролиза Гидролиз как Равновестный процесс Роль гидролиза в биохимических процессах Смещение равновесия. Константа гидролиза Вывод и связь со степенью гидролиза Расчёт р. Н среды. С соли t Гидролиз солей с многовалентными ионами
2 Граф структуры Химическое равновесие смещение равновесия Теория электролитической диссоциация Гидролиз солей Гидролиз-процесс, Обратный нейтрализации Случаи гидролиза солей Слабых кислот и слабых оснований. Слабых оснований и сильных кислот. Слабых кислот и сильных оснований. Сущность, причина и следствие гидролиза Гидролиз как Равновестный процесс Роль гидролиза в биохимических процессах Смещение равновесия. Константа гидролиза Вывод и связь со степенью гидролиза Расчёт р. Н среды. С соли t Гидролиз солей с многовалентными ионами
 3 В общем случае к гидролизу относятся процессы взаимодействия частей вещества с ионами Н + и ОН – воды.
3 В общем случае к гидролизу относятся процессы взаимодействия частей вещества с ионами Н + и ОН – воды.
 4 р. Н слезы 7. 6 — 7. 8 Na. Cl — ? ? ?
4 р. Н слезы 7. 6 — 7. 8 Na. Cl — ? ? ?
 5 Гидролиз солей — процесс взаимодействия ионов соли с составными частями воды (Н + и ОН – ). Причина -образование малодиссоциированных соединений (слабых электролитов) Следствие – сдвиг равновесия диссоциации (ионизации) воды, который сопровождается изменением кислотности среды вследствие накопления Н + или ОН – ионов.
5 Гидролиз солей — процесс взаимодействия ионов соли с составными частями воды (Н + и ОН – ). Причина -образование малодиссоциированных соединений (слабых электролитов) Следствие – сдвиг равновесия диссоциации (ионизации) воды, который сопровождается изменением кислотности среды вследствие накопления Н + или ОН – ионов.
 6 Гидролиз – процесс: обратимый ( ↔ ) ступенчатый эндотермический (- Q ), так как обратен реакции нейтрализации. Гидролиз идет по слабому компоненту соли! Кислотность определяет сильный компонент! Количественно гидролиз характеризуется константой гидролиза К г и степенью гидролиза h.
6 Гидролиз – процесс: обратимый ( ↔ ) ступенчатый эндотермический (- Q ), так как обратен реакции нейтрализации. Гидролиз идет по слабому компоненту соли! Кислотность определяет сильный компонент! Количественно гидролиз характеризуется константой гидролиза К г и степенью гидролиза h.
 71. Соль образована одноосновной слабой кислотой и однокислотным сильным основанием ( Na С N, CH 3 COONa, Na. NO 2 …) – среда щелочная Варианты гидролиза: COOHCHOH OHCOOCH COOHCHNa. OH OHCOONa. CH 323 ]COOCH][OH[ ]COOHCH][OH[ К 32 3 р Так как [H 2 O] практически постоянна, ][ ]][[ ][ 3 3 2 COOCH COOHCHOH КOHК гр Константа гидролиза Кг
71. Соль образована одноосновной слабой кислотой и однокислотным сильным основанием ( Na С N, CH 3 COONa, Na. NO 2 …) – среда щелочная Варианты гидролиза: COOHCHOH OHCOOCH COOHCHNa. OH OHCOONa. CH 323 ]COOCH][OH[ ]COOHCH][OH[ К 32 3 р Так как [H 2 O] практически постоянна, ][ ]][[ ][ 3 3 2 COOCH COOHCHOH КOHК гр Константа гидролиза Кг
![8 Домножим числитель и знаменатель на [H + ]: (к) д 3 3 8 Домножим числитель и знаменатель на [H + ]: (к) д 3 3](http://present5.com/presentforday2/20170109/03-2_gidroliz_images/03-2_gidroliz_7.jpg) 8 Домножим числитель и знаменатель на [H + ]: (к) д 3 3 г 2]][[ ]][][[ К К K COOCHH COOHCHOHH OH 10 514 10751 10 ·, ·, К г К K К COOH CH OH Дг 3 2 Значение К г показывает, что в момент равновесия произведение концентраций исходных веществ примерно в миллиард раз больше, чем продуктов реакции, что говорит об относительно небольшой степени протекания гидролиза. ][ ]][[ 3 3 COOCH COOHCHOH К г. Связь Кг с ионным произведением воды и Кд
8 Домножим числитель и знаменатель на [H + ]: (к) д 3 3 г 2]][[ ]][][[ К К K COOCHH COOHCHOHH OH 10 514 10751 10 ·, ·, К г К K К COOH CH OH Дг 3 2 Значение К г показывает, что в момент равновесия произведение концентраций исходных веществ примерно в миллиард раз больше, чем продуктов реакции, что говорит об относительно небольшой степени протекания гидролиза. ][ ]][[ 3 3 COOCH COOHCHOH К г. Связь Кг с ионным произведением воды и Кд
![9)3( )( 22 к. Д OH c. К K C ][OH Приравнивая формулы 9)3( )( 22 к. Д OH c. К K C ][OH Приравнивая формулы](http://present5.com/presentforday2/20170109/03-2_gidroliz_images/03-2_gidroliz_8.jpg) 9)3( )( 22 к. Д OH c. К K C ][OH Приравнивая формулы (1) и (2), получим: COOHCHOHOHCOOCH 323 ][ ]][[ 3 3 COOCH COOHCHOH К г [OH — ]=[CH 3 COOH] )1( ][ 2 с С OH Кг )2(К д(к)г 2 КK OH Вывод степени гидролиза h
9)3( )( 22 к. Д OH c. К K C ][OH Приравнивая формулы (1) и (2), получим: COOHCHOHOHCOOCH 323 ][ ]][[ 3 3 COOCH COOHCHOH К г [OH — ]=[CH 3 COOH] )1( ][ 2 с С OH Кг )2(К д(к)г 2 КK OH Вывод степени гидролиза h
![10 h. COH C C c cc ·][ ][ h ; h гидр 10 h. COH C C c cc ·][ ][ h ; h гидр](http://present5.com/presentforday2/20170109/03-2_gidroliz_images/03-2_gidroliz_9.jpg) 10 h. COH C C c cc ·][ ][ h ; h гидр )3()(2 2 к. Д OH c К K C ][OH )(Д(к)22 c ·h К·C 22 к. Дc OHOH c КC KK C h h·C]OH[c COOHCHOHOHCOOCH 323 Подставим в уравнение (3)
10 h. COH C C c cc ·][ ][ h ; h гидр )3()(2 2 к. Д OH c К K C ][OH )(Д(к)22 c ·h К·C 22 к. Дc OHOH c КC KK C h h·C]OH[c COOHCHOHOHCOOCH 323 Подставим в уравнение (3)
 11 Вывод формулы для расчёта p. Hcк д к дc. OH к д c. OH Clg 2 1 p. К 2 1 7 p. H p. OH 14 p. H Klg 2 1 Clg 2 1 Klg 2 1 p. OH K C·K ][OH 2 2 CH 3 COONa ( р. Н > 7 ))3( )(2 2 к. Д OH c К K C ][OH
11 Вывод формулы для расчёта p. Hcк д к дc. OH к д c. OH Clg 2 1 p. К 2 1 7 p. H p. OH 14 p. H Klg 2 1 Clg 2 1 Klg 2 1 p. OH K C·K ][OH 2 2 CH 3 COONa ( р. Н > 7 ))3( )(2 2 к. Д OH c К K C ][OH
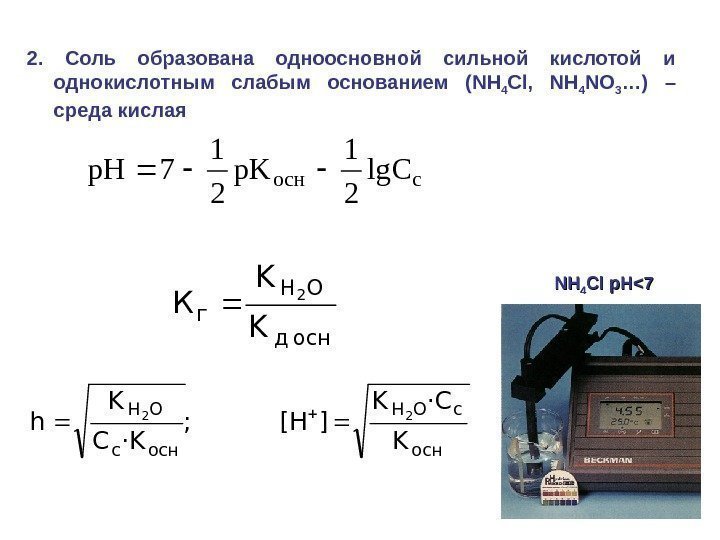
 122. Соль образована одноосновной сильной кислотой и однокислотным слабым основанием ( NH 4 Cl, NH 4 NO 3 …) – среда кислая осн c. OH оснc OH K ·CK ][H ; ·KC K h 22 осн д OH г. K K К 2 cосн lg. C 21 p. K 21 7 p. H NHNH 44 Cl. Cl р. Н <<
122. Соль образована одноосновной сильной кислотой и однокислотным слабым основанием ( NH 4 Cl, NH 4 NO 3 …) – среда кислая осн c. OH оснc OH K ·CK ][H ; ·KC K h 22 осн д OH г. K K К 2 cосн lg. C 21 p. K 21 7 p. H NHNH 44 Cl. Cl р. Н <<
 133. Соль образована слабым однокислотным основанием и слабой одноосновной кислотой ( NH 4 CN, CH 3 COONH 4 …) – среда ≈ нейтральная р. Н не зависит от концентрации соли, гидролиз проходит достаточно глубоко оснкp. К 2 1 p. K 2 1 7 p. H CH 3 COON Н 4 + ( р. Н ≈ 7 ) 9, 0 10· 75, 1· 10· 2, 6 10 K·K K К K ·КK ][H ; ·KК K h 510 14 HCNOHNH OH г осн к. OH оснк OH
133. Соль образована слабым однокислотным основанием и слабой одноосновной кислотой ( NH 4 CN, CH 3 COONH 4 …) – среда ≈ нейтральная р. Н не зависит от концентрации соли, гидролиз проходит достаточно глубоко оснкp. К 2 1 p. K 2 1 7 p. H CH 3 COON Н 4 + ( р. Н ≈ 7 ) 9, 0 10· 75, 1· 10· 2, 6 10 K·K K К K ·КK ][H ; ·KК K h 510 14 HCNOHNH OH г осн к. OH оснк OH
 14 2 3 К 3 32 К 23 3223 SOH HSO )б SOHOH OHHSO а) SOHNa. OH OHNa. HSO 2 г В данном случае 13 2 14 )(1 10· 3, 6 10· 6, 1 10 32 2 SOH OH г K K К намного меньше, чем следовательно, среда будет слабокислой. 8 )(2 10· 3, 6 32 SOHK Параллельно с гидролизом в растворах кислых солей протекает диссоциация кислотного остатка, поэтому при оценке значения р. Н необходимо сравнить константы гидролиза (Кг) и диссоциации кислоты по второй ступени (К 2 ): Гидролиз кислых солей
14 2 3 К 3 32 К 23 3223 SOH HSO )б SOHOH OHHSO а) SOHNa. OH OHNa. HSO 2 г В данном случае 13 2 14 )(1 10· 3, 6 10· 6, 1 10 32 2 SOH OH г K K К намного меньше, чем следовательно, среда будет слабокислой. 8 )(2 10· 3, 6 32 SOHK Параллельно с гидролизом в растворах кислых солей протекает диссоциация кислотного остатка, поэтому при оценке значения р. Н необходимо сравнить константы гидролиза (Кг) и диссоциации кислоты по второй ступени (К 2 ): Гидролиз кислых солей
 15 Расчет степени гидролиза концентрации ионов водорода и р. Н среды для кислых солей к 2 к 1 p. K 2 1 p. H Растворы кислых солей имеют различный характер среды: Na 2 HPO 4 — щелочная Na. H 2 PO 4 – кислая Раствор питьевой соды Na. HCO 3 имеет слабощелочную среду и используется в медицине для предотвращения ацидозов к 2 к 1 к 2 K·К][H ; К K 2 h
15 Расчет степени гидролиза концентрации ионов водорода и р. Н среды для кислых солей к 2 к 1 p. K 2 1 p. H Растворы кислых солей имеют различный характер среды: Na 2 HPO 4 — щелочная Na. H 2 PO 4 – кислая Раствор питьевой соды Na. HCO 3 имеет слабощелочную среду и используется в медицине для предотвращения ацидозов к 2 к 1 к 2 K·К][H ; К K 2 h
 16 Ступенчатый гидролиз В случае солей многоосновных кислот или многокислотных оснований процесс гидролиза протекает ступенчато 1 — я ступень: 2 -я ступень: 322 3 3232 HCOOH OHCO Na. HCONa. OH OHСONa 3223 COHOH OHHCO COHNa. OH OHNa. HСO 8 1 д OH 2 г 4 2 д OH 1 г 10· 2, 2 K K К ; 10· 1, 2 K K К 22 cк д 2 Clg 2 1 p. K 2 1 7 p. H Сравнение величин К г 1 и Кг 2 показывает, что практически гидролиз протекает только по первой ступени. C мещением равновесия вправо ( нагреванием и разбавлением раствора – согласно принципу Ле-Шателье) можно добиться в ряде случаев реализации гидролиза по второй и даже по третьей ступени.
16 Ступенчатый гидролиз В случае солей многоосновных кислот или многокислотных оснований процесс гидролиза протекает ступенчато 1 — я ступень: 2 -я ступень: 322 3 3232 HCOOH OHCO Na. HCONa. OH OHСONa 3223 COHOH OHHCO COHNa. OH OHNa. HСO 8 1 д OH 2 г 4 2 д OH 1 г 10· 2, 2 K K К ; 10· 1, 2 K K К 22 cк д 2 Clg 2 1 p. K 2 1 7 p. H Сравнение величин К г 1 и Кг 2 показывает, что практически гидролиз протекает только по первой ступени. C мещением равновесия вправо ( нагреванием и разбавлением раствора – согласно принципу Ле-Шателье) можно добиться в ряде случаев реализации гидролиза по второй и даже по третьей ступени.
 17 Смещение равновесия обратимого гидролиза
17 Смещение равновесия обратимого гидролиза
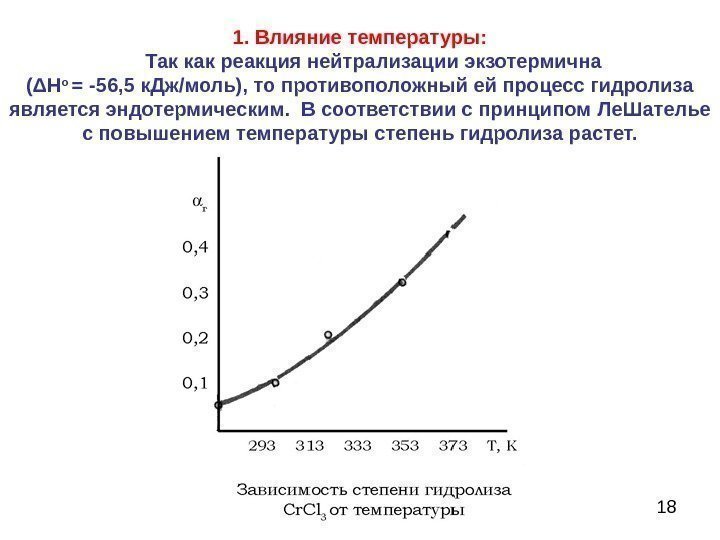
 181. Влияние температуры: Так как реакция нейтрализации экзотермична ( Δ H o = -56, 5 к. Дж/моль), то противоположный ей процесс гидролиза является эндотермическим. В соответствии с принципом Ле. Шателье с повышением температуры степень гидролиза растет.
181. Влияние температуры: Так как реакция нейтрализации экзотермична ( Δ H o = -56, 5 к. Дж/моль), то противоположный ей процесс гидролиза является эндотермическим. В соответствии с принципом Ле. Шателье с повышением температуры степень гидролиза растет.
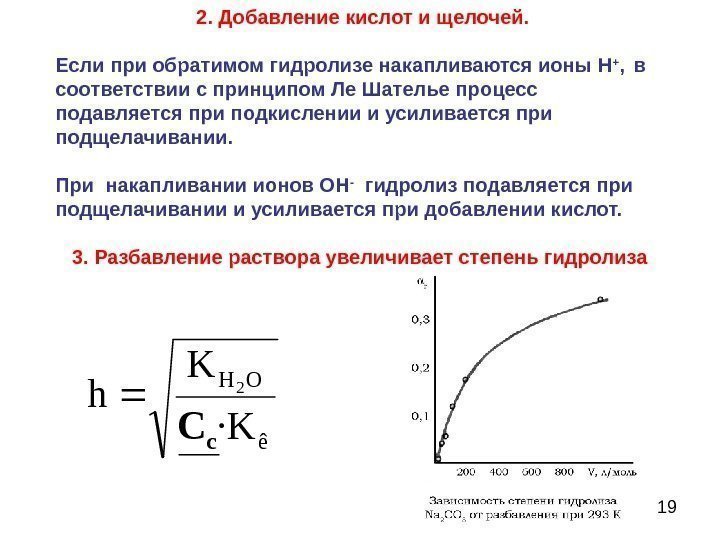
 19êOH·K K h 2 c C 2. Добавление кислот и щелочей. Если при обратимом гидролизе накапливаются ионы Н + , в соответствии с принципом Ле Шателье процесс подавляется при подкислении и усиливается при подщелачивании. При накапливании ионов ОН — гидролиз подавляется при подщелачивании и усиливается при добавлении кислот. 3. Разбавление раствора увеличивает степень гидролиза
19êOH·K K h 2 c C 2. Добавление кислот и щелочей. Если при обратимом гидролизе накапливаются ионы Н + , в соответствии с принципом Ле Шателье процесс подавляется при подкислении и усиливается при подщелачивании. При накапливании ионов ОН — гидролиз подавляется при подщелачивании и усиливается при добавлении кислот. 3. Разбавление раствора увеличивает степень гидролиза
 20 Необратимый гидролиз Если какое-либо из образующихся в процессе гидролиза веществ накапливается в растворе в таких количествах, что станет возможным выделение его в осадок или улетучивание в виде газа, то гидролиз будет необратимым, что приведет к полному разложению соли водой: 232 -2 33 23232 3 CO 2 Al(OH)OH 33 CO 2 Al или Na. Cl 63 CO 2 Al(OH)OH 3 CONa 3 Al. Cl 2 S 3 H 2 Al(OH) OH 6 SAl Соли, подвергающиеся необратимому гидролизу: 33233233232)(COFe , )(COCr , )(COAl , SCr
20 Необратимый гидролиз Если какое-либо из образующихся в процессе гидролиза веществ накапливается в растворе в таких количествах, что станет возможным выделение его в осадок или улетучивание в виде газа, то гидролиз будет необратимым, что приведет к полному разложению соли водой: 232 -2 33 23232 3 CO 2 Al(OH)OH 33 CO 2 Al или Na. Cl 63 CO 2 Al(OH)OH 3 CONa 3 Al. Cl 2 S 3 H 2 Al(OH) OH 6 SAl Соли, подвергающиеся необратимому гидролизу: 33233233232)(COFe , )(COCr , )(COAl , SCr
 21 Роль гидролиза биоорганических соединений в процессах жизнедеятельности 1. Каждый из ферментов активен при строго определенных значениях р. Н: пепсин желудочного сока активен при р. Н 1, 5– 2, 0, каталаза крови – при р. Н 7, 0; тканевые кетапсины при реакции среды, близкой к нейтральной, катализируют синтез белка, а при кислой реакции расщепляют его. 2. Ионы водорода катализируют гидролиз сложных жиров, сахарозы.
21 Роль гидролиза биоорганических соединений в процессах жизнедеятельности 1. Каждый из ферментов активен при строго определенных значениях р. Н: пепсин желудочного сока активен при р. Н 1, 5– 2, 0, каталаза крови – при р. Н 7, 0; тканевые кетапсины при реакции среды, близкой к нейтральной, катализируют синтез белка, а при кислой реакции расщепляют его. 2. Ионы водорода катализируют гидролиз сложных жиров, сахарозы.
 223. Без ферментативного гидролиза невозможно усвоение пищевых продуктов (жиры, углеводы, белки) , так как всасываться в кишечнике способны только относительно небольшие молекулы. Жиры в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты. R 1 — О— R 2 + H 2 O → R 1 — ОН + R 2 — ОН R 1 , R 2 — фрагменты биоорганической молекулы Усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Белки гидролизуются до веществ, которые лишь потом могут усваиваться.
223. Без ферментативного гидролиза невозможно усвоение пищевых продуктов (жиры, углеводы, белки) , так как всасываться в кишечнике способны только относительно небольшие молекулы. Жиры в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты. R 1 — О— R 2 + H 2 O → R 1 — ОН + R 2 — ОН R 1 , R 2 — фрагменты биоорганической молекулы Усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Белки гидролизуются до веществ, которые лишь потом могут усваиваться.
 23 4. Гидролиз АТФ — источник энергии в организме Человек получает энергию как за счет многостадийного процесса окисления пищи — белков, жиров и углеводов, так и за счет гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидов. Космические ракеты высотой с башню устремляются в небо за счет громадной энергии, что выделяется при сжигании водорода в чистом кислороде. Эта же энергия поддерживает жизнь и в клетках нашего тела. В них реакция окисления протекает поэтапно. Кроме того, сначала вместо тепловой и кинетической энергии наши клетки создают клеточное «топливо» — АТФ.
23 4. Гидролиз АТФ — источник энергии в организме Человек получает энергию как за счет многостадийного процесса окисления пищи — белков, жиров и углеводов, так и за счет гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидов. Космические ракеты высотой с башню устремляются в небо за счет громадной энергии, что выделяется при сжигании водорода в чистом кислороде. Эта же энергия поддерживает жизнь и в клетках нашего тела. В них реакция окисления протекает поэтапно. Кроме того, сначала вместо тепловой и кинетической энергии наши клетки создают клеточное «топливо» — АТФ.
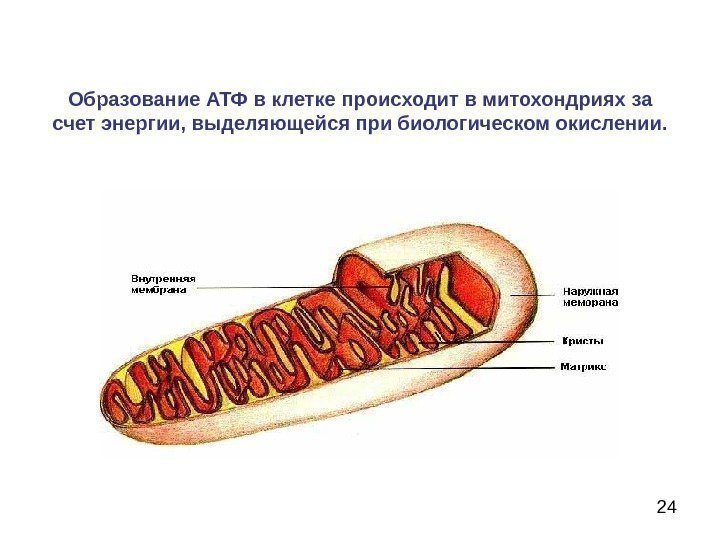
 24 Образование АТФ в клетке п роисходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
24 Образование АТФ в клетке п роисходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
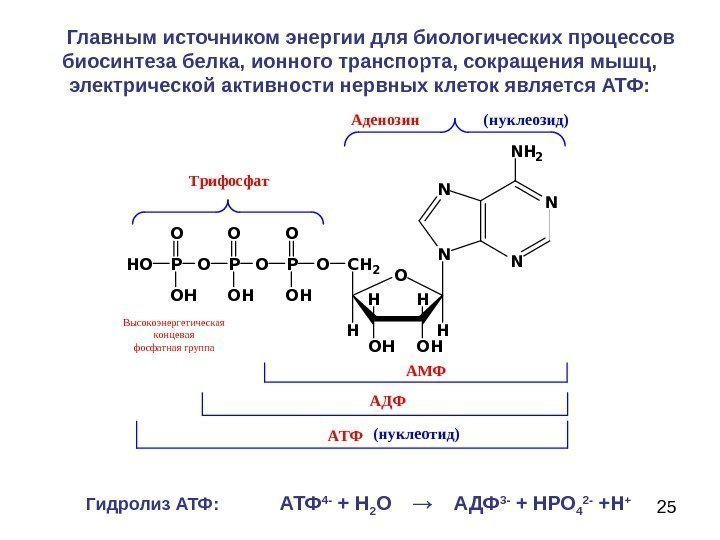
 25 N NNN N H 2 O O HO H HH HC H 2 HOPO O HO PH O O HO А д е н о з и н ( н у к л е о з и д ) А М Ф А Д Ф А Т ФВ ы с о к о э н е р г е т и ч е с к а я к о н ц е в а я ф о с ф а т н а я г р у п п а. Т р и ф о с ф а т ( н у к л е о т и д ) Главным источником энергии для биологических процессов биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток является АТФ: Гидролиз АТФ: АТФ 4 — + Н 2 О → АДФ 3 — + НРО 4 2 — +Н +
25 N NNN N H 2 O O HO H HH HC H 2 HOPO O HO PH O O HO А д е н о з и н ( н у к л е о з и д ) А М Ф А Д Ф А Т ФВ ы с о к о э н е р г е т и ч е с к а я к о н ц е в а я ф о с ф а т н а я г р у п п а. Т р и ф о с ф а т ( н у к л е о т и д ) Главным источником энергии для биологических процессов биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток является АТФ: Гидролиз АТФ: АТФ 4 — + Н 2 О → АДФ 3 — + НРО 4 2 — +Н +
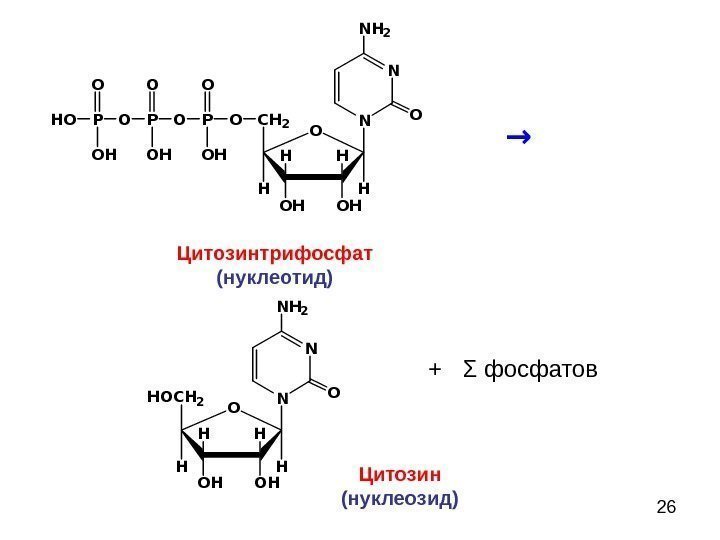
 26 NN H 2 O N O O HO H HH HC H 2 HOPO O HO PH O O HO NN H 2 O N O O HO H HH HH O C H 2 H Цитозин (нуклеозид)Цитозинтрифосфат (нуклеотид) → + Σ фосфатов
26 NN H 2 O N O O HO H HH HC H 2 HOPO O HO PH O O HO NN H 2 O N O O HO H HH HH O C H 2 H Цитозин (нуклеозид)Цитозинтрифосфат (нуклеотид) → + Σ фосфатов
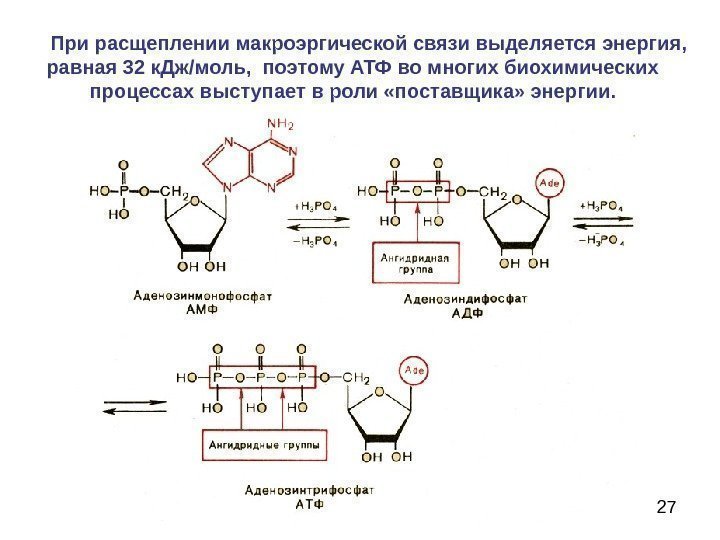
 27 При расщеплении макроэргической связи выделяется энергия, равная 32 к. Дж/моль, поэтому АТФ во многих биохимических процессах выступает в роли «поставщика» энергии.
27 При расщеплении макроэргической связи выделяется энергия, равная 32 к. Дж/моль, поэтому АТФ во многих биохимических процессах выступает в роли «поставщика» энергии.
 28 5. Гидролиз –один из важнейших путей метаболизма лекарственных препаратов и пищевых продуктов Процесс гидролиза может идти: В плазме крови На клеточных мембранах В цитоплазме клеток Во внутренних органеллах, в частности в лизосомах
28 5. Гидролиз –один из важнейших путей метаболизма лекарственных препаратов и пищевых продуктов Процесс гидролиза может идти: В плазме крови На клеточных мембранах В цитоплазме клеток Во внутренних органеллах, в частности в лизосомах
 29 Большинство лекарственных веществ метаболизируются в печени, располагающей для этого набором ферментных систем весьма большой мощности. Эти ферментные системы локализованы либо в митохондриях, либо в микросомах, либо в гиалоплазме.
29 Большинство лекарственных веществ метаболизируются в печени, располагающей для этого набором ферментных систем весьма большой мощности. Эти ферментные системы локализованы либо в митохондриях, либо в микросомах, либо в гиалоплазме.
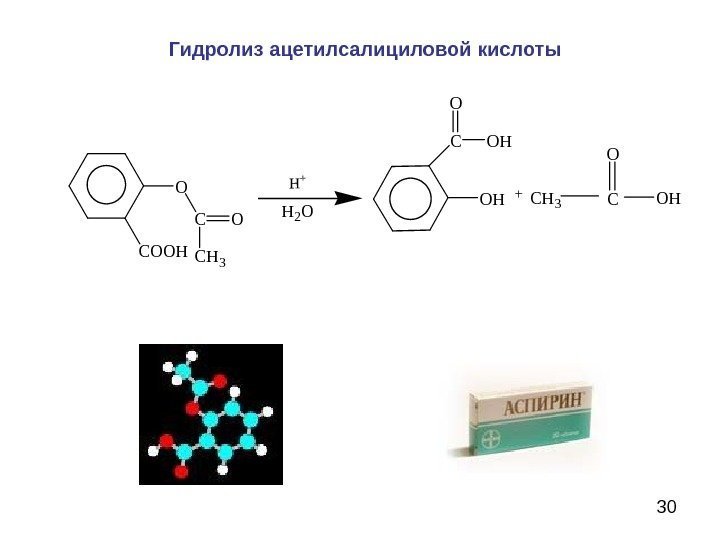
 30 O COOH CO CH 3 H 2 O COH O OHOHCH 3 C O + Гидролиз ацетилсалициловой кислоты
30 O COOH CO CH 3 H 2 O COH O OHOHCH 3 C O + Гидролиз ацетилсалициловой кислоты
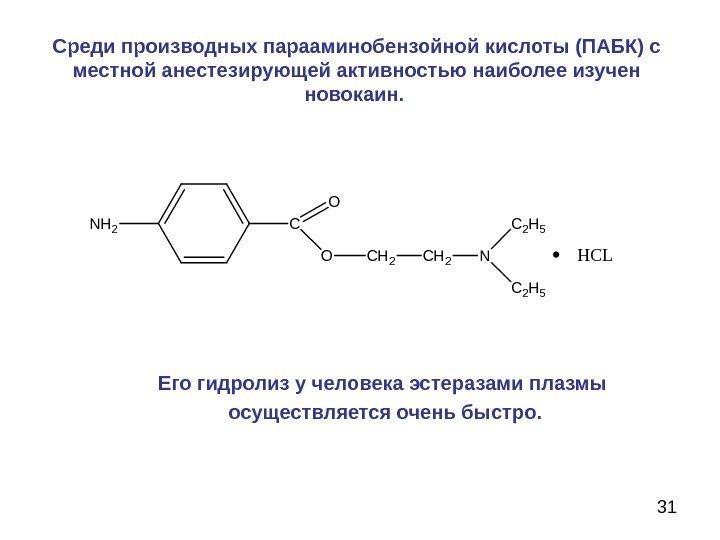
 31 Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин. Его гидролиз у человека эстеразами плазмы осуществляется очень быстро. N H 2 C O O C H 2 N C 2 H 5 HCL
31 Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин. Его гидролиз у человека эстеразами плазмы осуществляется очень быстро. N H 2 C O O C H 2 N C 2 H 5 HCL
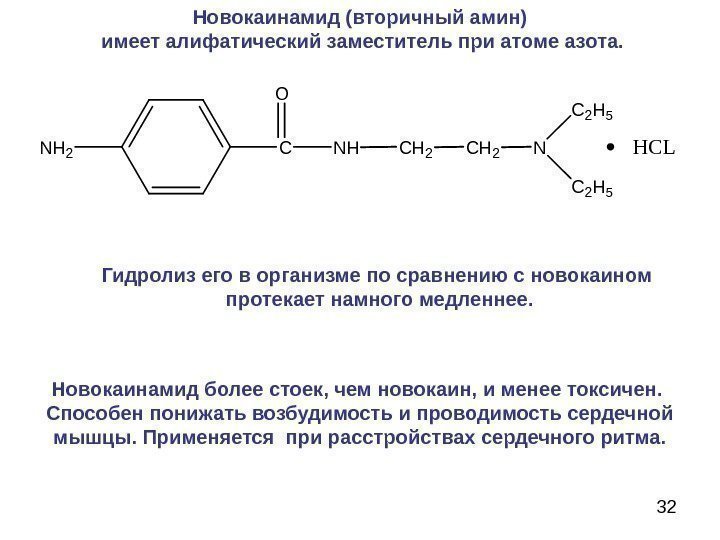
 32 Новокаинамид (вторичный амин) имеет алифатический заместитель при атоме азота. NH 2 CNH O CH 2 N C 2 H 5 HCL Новокаинамид более стоек, чем новокаин, и менее токсичен. Способен понижать возбудимость и проводимость сердечной мышцы. Применяется при расстройствах сердечного ритма. Гидролиз его в организме по сравнению с новокаином протекает намного медленнее.
32 Новокаинамид (вторичный амин) имеет алифатический заместитель при атоме азота. NH 2 CNH O CH 2 N C 2 H 5 HCL Новокаинамид более стоек, чем новокаин, и менее токсичен. Способен понижать возбудимость и проводимость сердечной мышцы. Применяется при расстройствах сердечного ритма. Гидролиз его в организме по сравнению с новокаином протекает намного медленнее.
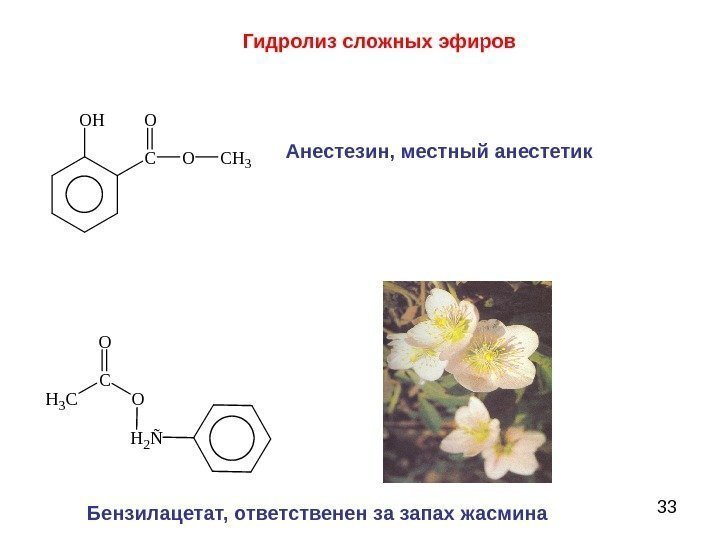
 33 O H CO O C H 3 H 2 ÑOCO H 3 C Анестезин, местный анестетик Бензилацетат, ответственен за запах жасмина Гидролиз сложных эфиров
33 O H CO O C H 3 H 2 ÑOCO H 3 C Анестезин, местный анестетик Бензилацетат, ответственен за запах жасмина Гидролиз сложных эфиров
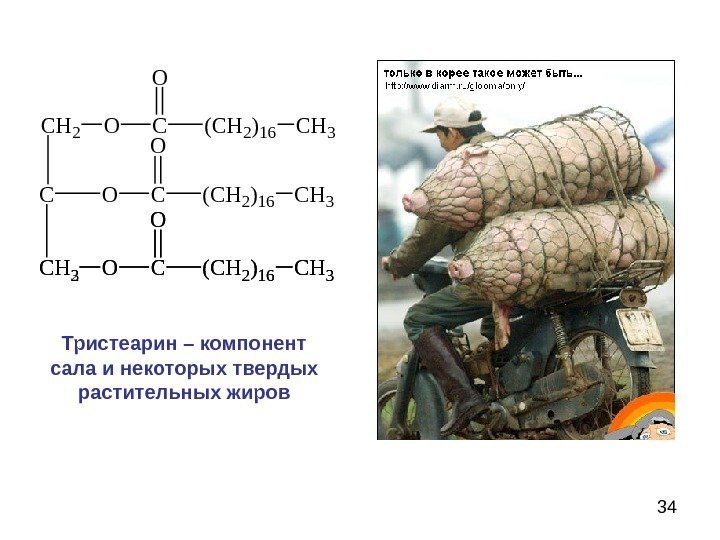
 34 CH 2 OC(CH 2)16 CH 3 O CH 3 OC(CH 2)16 CH 3 O CH 2 OC(CH 2)16 CH 3 O COC(CH 2)16 CH 3 OТристеарин – компонент сала и некоторых твердых растительных жиров
34 CH 2 OC(CH 2)16 CH 3 O CH 3 OC(CH 2)16 CH 3 O CH 2 OC(CH 2)16 CH 3 O COC(CH 2)16 CH 3 OТристеарин – компонент сала и некоторых твердых растительных жиров
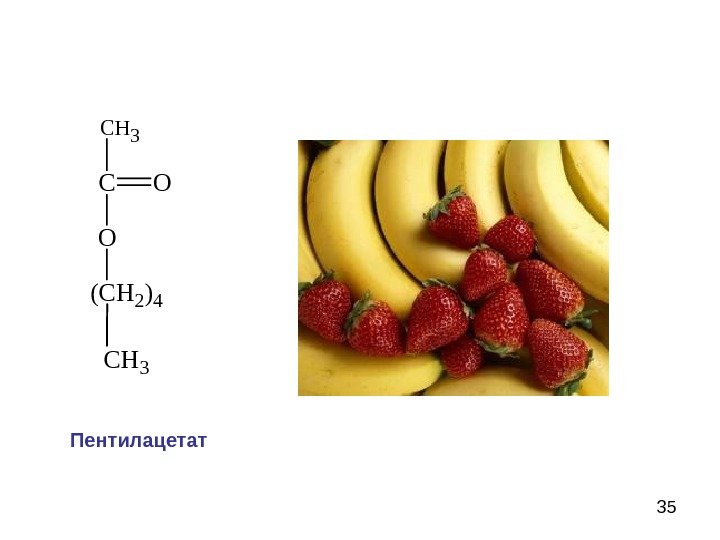
 35 CH 3 CO O (CH 2)4 CH 3 Пентилацетат
35 CH 3 CO O (CH 2)4 CH 3 Пентилацетат
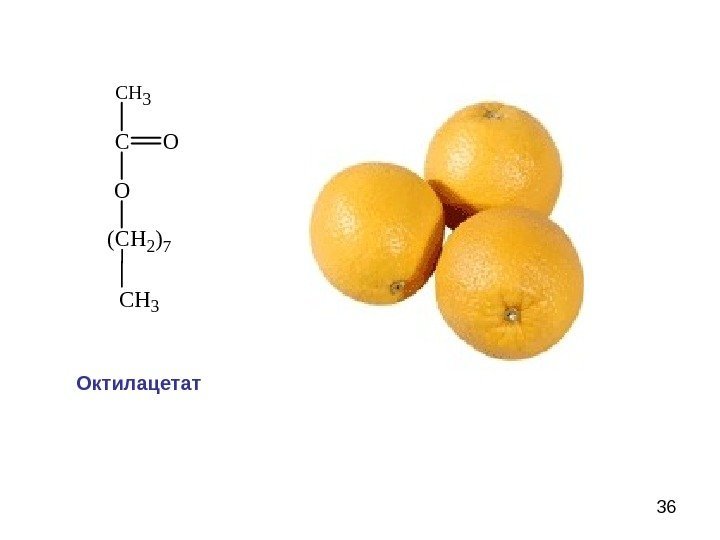
 36 C H 3 CO O (CH 2)7 CH 3 Октилацетат
36 C H 3 CO O (CH 2)7 CH 3 Октилацетат
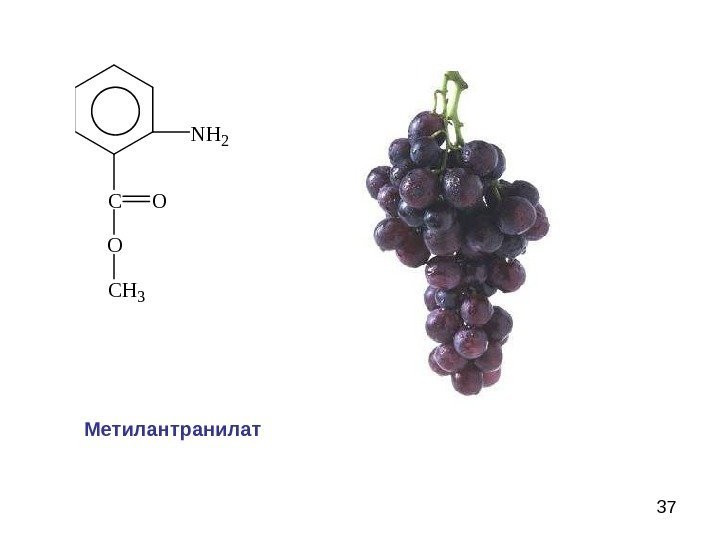
 37 N H 2 C O C H 3 O Метилантранилат
37 N H 2 C O C H 3 O Метилантранилат
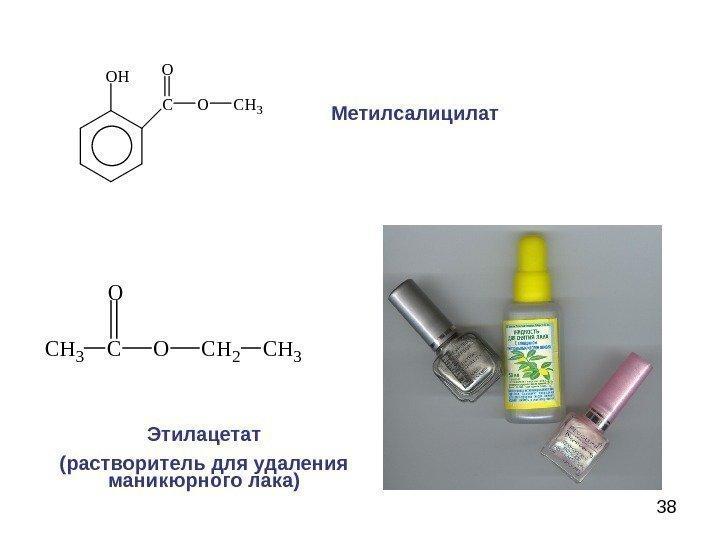
 38 O H C O C H 3 O Метилсалицилат C H 3 C O C H 2 C H 3 O Этилацетат (растворитель для удаления маникюрного лака)
38 O H C O C H 3 O Метилсалицилат C H 3 C O C H 2 C H 3 O Этилацетат (растворитель для удаления маникюрного лака)
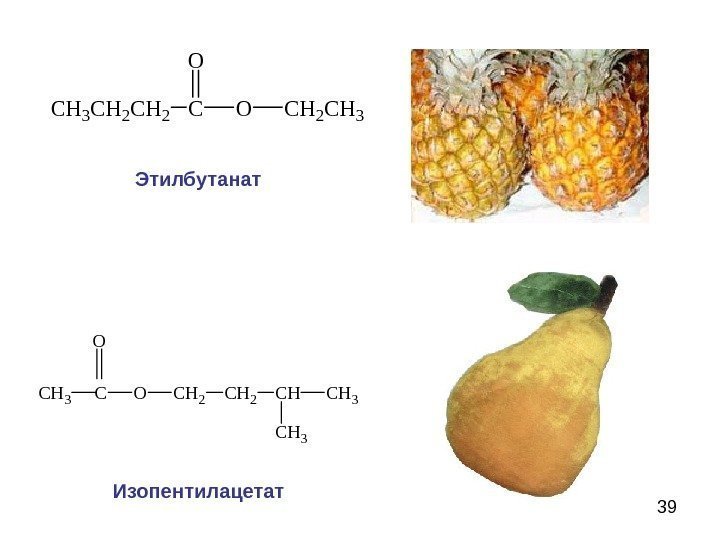
 39 C H 3 C H 2 C O C H 2 C H 3 O C H 3 C OO C H 2 C H 3 Этилбутанат Изопентилацетат
39 C H 3 C H 2 C O C H 2 C H 3 O C H 3 C OO C H 2 C H 3 Этилбутанат Изопентилацетат
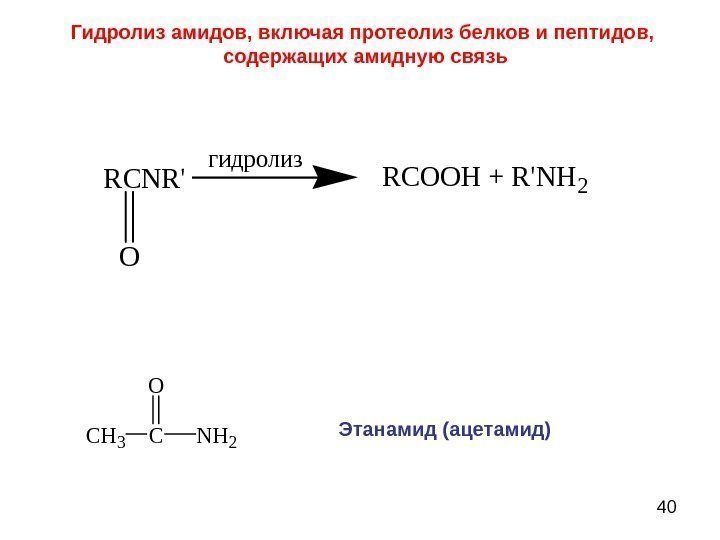
 40 RCNR’ O RCOOH + R’NH 2 гидролиз CH 3 CNH 2 OЭтанамид (ацетамид)Гидролиз амидов, включая протеолиз белков и пептидов, содержащих амидную связь
40 RCNR’ O RCOOH + R’NH 2 гидролиз CH 3 CNH 2 OЭтанамид (ацетамид)Гидролиз амидов, включая протеолиз белков и пептидов, содержащих амидную связь
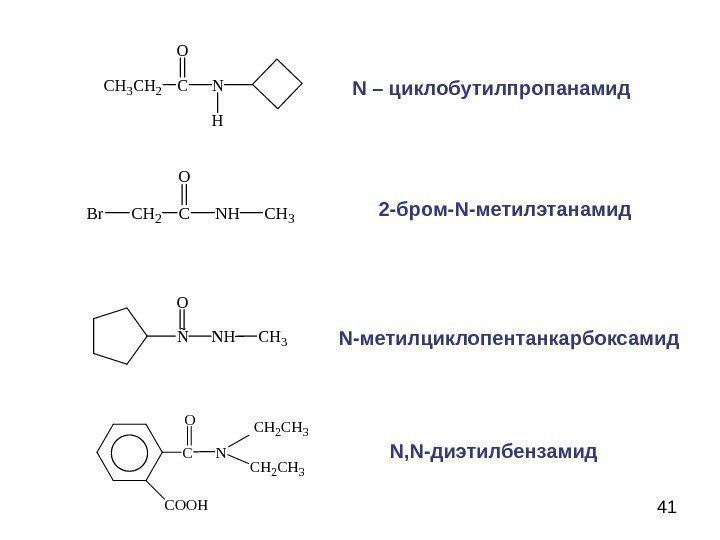
 41 C H 3 C H 2 CO N H N – циклобутилпропанамид. Br. CH 2 C O NHCH 3 2 -бром- N- метилэтанамид ÑO N H C H 3 N -метилциклопентанкарбоксамид C O O HC O N C H 2 C H 3 N, N -диэтилбензамид
41 C H 3 C H 2 CO N H N – циклобутилпропанамид. Br. CH 2 C O NHCH 3 2 -бром- N- метилэтанамид ÑO N H C H 3 N -метилциклопентанкарбоксамид C O O HC O N C H 2 C H 3 N, N -диэтилбензамид
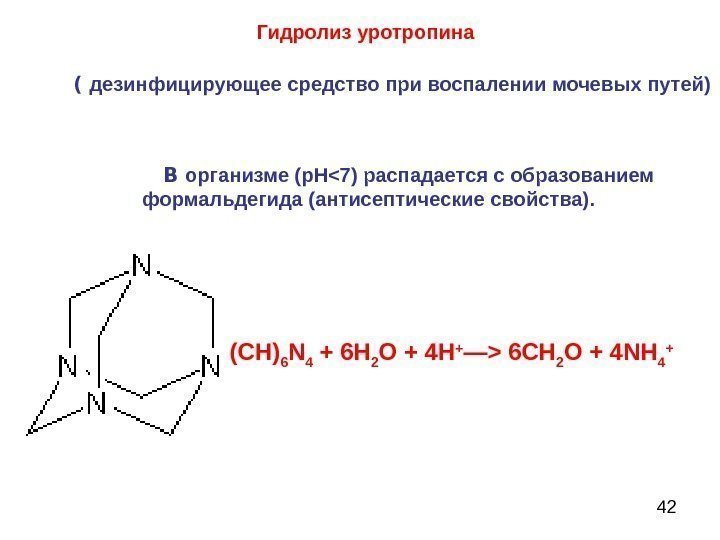
 42 (CH) 6 N 4 + 6 Н 2 О + 4 H + —> 6 СН 2 О + 4 NH 4 +Гидролиз уротропина В организме ( p. H<7 ) распадается с образова нием формальдегида ( антисептически е свойства ). ( дезинфицирующее средство при воспалении мочевых путей)
42 (CH) 6 N 4 + 6 Н 2 О + 4 H + —> 6 СН 2 О + 4 NH 4 +Гидролиз уротропина В организме ( p. H<7 ) распадается с образова нием формальдегида ( антисептически е свойства ). ( дезинфицирующее средство при воспалении мочевых путей)
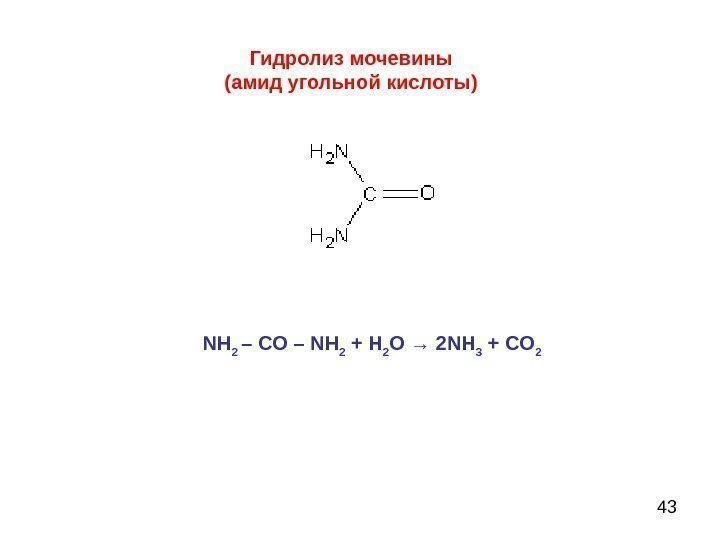
 43 Гидролиз мочевины (амид угольной кислоты) NH 2 – CO – NH 2 + H 2 O → 2 NH 3 + CO
43 Гидролиз мочевины (амид угольной кислоты) NH 2 – CO – NH 2 + H 2 O → 2 NH 3 + CO
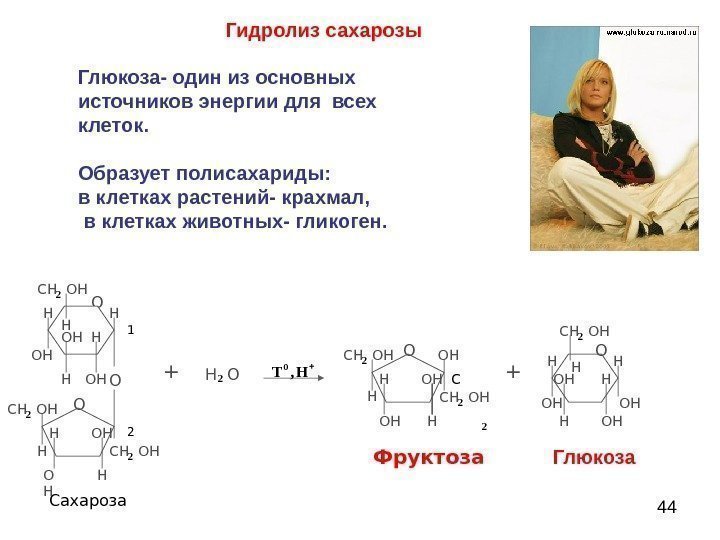
 44 Гидролиз сахарозы + H O 2 + О С OH H CH OH 22 OH OHH HCH OH + О OH OH OHOH HHCH OH 21 2 H, T 0 Сахароза Фруктоза Глюкоза- один из основных источников энергии для всех клеток. Образует полисахариды: в клетках растений- крахмал, в клетках животных- гликоген. О ОOH O H OH OHOHHH H H H ОCH OH
44 Гидролиз сахарозы + H O 2 + О С OH H CH OH 22 OH OHH HCH OH + О OH OH OHOH HHCH OH 21 2 H, T 0 Сахароза Фруктоза Глюкоза- один из основных источников энергии для всех клеток. Образует полисахариды: в клетках растений- крахмал, в клетках животных- гликоген. О ОOH O H OH OHOHHH H H H ОCH OH

 46 Спасибо за внимание!
46 Спасибо за внимание!
