1 Растворы. «Способы выражения концентраций.






















![33 Задача: Рассчитать концентрацию ионов водорода [ Н + ] в 9 растворе уксуса 33 Задача: Рассчитать концентрацию ионов водорода [ Н + ] в 9 растворе уксуса](http://present5.com/presentforday2/20161222/2.1._rastvory_images/2.1._rastvory_32.jpg)
![34 Задача: Рассчитать концентрацию ионов водорода [ Н+ ] в 9 растворе уксуса 34 Задача: Рассчитать концентрацию ионов водорода [ Н+ ] в 9 растворе уксуса](http://present5.com/presentforday2/20161222/2.1._rastvory_images/2.1._rastvory_33.jpg)

2.1._rastvory.ppt
- Размер: 6.7 Мб
- Автор:
- Количество слайдов: 35
Описание презентации 1 Растворы. «Способы выражения концентраций. по слайдам
 1 Растворы. «Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда» Кафедра общей и медицинской химии
1 Растворы. «Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда» Кафедра общей и медицинской химии
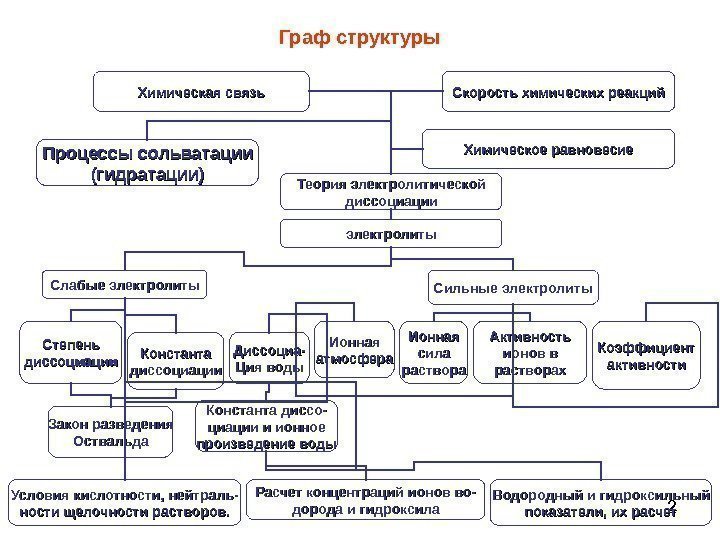
 2 Граф структуры Химическая связь Скорость химических реакций Теория электролитической диссоциации Слабые электролиты Сильные электролиты Коэффициент активности. Процессы сольватации (гидратации) Химическое равновесие электролиты Диссоциа- Ция воды. Степень диссоцмации Константа диссоциации Закон разведения Оствальда Константа диссо- циации и ионное произведение воды Расчет концентраций ионов во- дорода и гидроксила. Условия кислотности, нейтраль- ности щелочности растворов. Водородный и гидроксильный показатели, их расчет. Активность ионов в растворах. Ионная сила раствора. Ионная атмосфера. Химическая связь Скорость химических реакций Теория электролитической диссоциации Слабые электролиты Сильные электролиты Коэффициент активности. Процессы сольватации (гидратации) Химическое равновесие электролиты Диссоциа- Ция воды. Степень диссоциации Константа диссоциации Закон разведения Оствальда Константа диссо- циации и ионное произведение воды Расчет концентраций ионов во- дорода и гидроксила. Условия кислотности, нейтраль- ности щелочности растворов. Водородный и гидроксильный показатели, их расчет. Активность ионов в растворах. Ионная сила раствора. Ионная атмосфера
2 Граф структуры Химическая связь Скорость химических реакций Теория электролитической диссоциации Слабые электролиты Сильные электролиты Коэффициент активности. Процессы сольватации (гидратации) Химическое равновесие электролиты Диссоциа- Ция воды. Степень диссоцмации Константа диссоциации Закон разведения Оствальда Константа диссо- циации и ионное произведение воды Расчет концентраций ионов во- дорода и гидроксила. Условия кислотности, нейтраль- ности щелочности растворов. Водородный и гидроксильный показатели, их расчет. Активность ионов в растворах. Ионная сила раствора. Ионная атмосфера. Химическая связь Скорость химических реакций Теория электролитической диссоциации Слабые электролиты Сильные электролиты Коэффициент активности. Процессы сольватации (гидратации) Химическое равновесие электролиты Диссоциа- Ция воды. Степень диссоциации Константа диссоциации Закон разведения Оствальда Константа диссо- циации и ионное произведение воды Расчет концентраций ионов во- дорода и гидроксила. Условия кислотности, нейтраль- ности щелочности растворов. Водородный и гидроксильный показатели, их расчет. Активность ионов в растворах. Ионная сила раствора. Ионная атмосфера
 3 Растворы — гомогенные термодинамически устойчивые системы, состоящие из двух и большего числа компонентов, состав которых изменяться в пределах, допустимых растворимостью. Точка зрения Менделеева: Раствор — это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия. Д. И. Менделеев (8. 02. 1834 – 02. 1907) NB! Гидратная теория Менделеева стала o дной из основ современной теории растворов. «В растворе при обычной температуре происходит образование и разрушение ассоциатов (соединениий) – частиц растворителя – гидратов — с частицами растворенного вещества»
3 Растворы — гомогенные термодинамически устойчивые системы, состоящие из двух и большего числа компонентов, состав которых изменяться в пределах, допустимых растворимостью. Точка зрения Менделеева: Раствор — это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия. Д. И. Менделеев (8. 02. 1834 – 02. 1907) NB! Гидратная теория Менделеева стала o дной из основ современной теории растворов. «В растворе при обычной температуре происходит образование и разрушение ассоциатов (соединениий) – частиц растворителя – гидратов — с частицами растворенного вещества»
 4 Раствор может иметь любое агрегатное состояние: жидкое газообразное (газовая смесь). твердое
4 Раствор может иметь любое агрегатное состояние: жидкое газообразное (газовая смесь). твердое
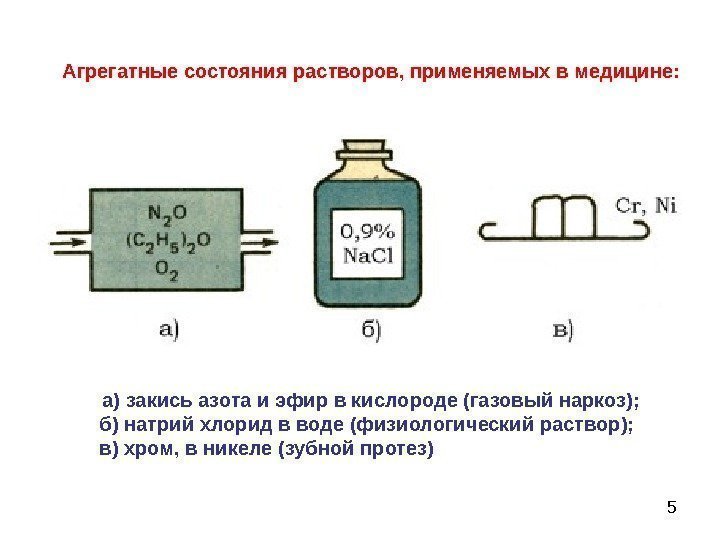
 5 Агрегатные состояния растворов, применяемых в медицине: а) закись азота и эфир в кислороде (газовый наркоз); б) натрий хлорид в воде (физиологический раствор); в) хром, в никеле (зубной протез)
5 Агрегатные состояния растворов, применяемых в медицине: а) закись азота и эфир в кислороде (газовый наркоз); б) натрий хлорид в воде (физиологический раствор); в) хром, в никеле (зубной протез)
 6 Характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Размер растворенных частиц (ионов и молекул) меньше 10 -9 м. Классификация 1. По молярной массе растворенного вещества ВМС — полимеры, макромолекулы которых состоят мономерных звеньев, соединенных между собой химическими связями. Растворы полиэлектролитов — растворы ВМС, в состав которых входят функциональные группы, способные к ионизации. а) М 5000 г/моль — растворы высокомолекулярных соединений (ВМС).
6 Характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Размер растворенных частиц (ионов и молекул) меньше 10 -9 м. Классификация 1. По молярной массе растворенного вещества ВМС — полимеры, макромолекулы которых состоят мономерных звеньев, соединенных между собой химическими связями. Растворы полиэлектролитов — растворы ВМС, в состав которых входят функциональные группы, способные к ионизации. а) М 5000 г/моль — растворы высокомолекулярных соединений (ВМС).
 72. По наличию или отсутствию электролитической диссоциации Растворы электролитов — в которых вещества диссоциируют на ионы (соли, кислоты и гидроксиды — КNО 3 , НС l , КОН). Растворы неэлектролитов – в которых вещества практически не диссоциируют в воде( растворы сахарозы, глюкозы, мочевины. ) Растворы амфолитов — веществ, которые могут диссоциировать и по кислотному, и по основному типу: А l( ОН) 3 , глицин. 3. По концентрации а) разбавленные растворы ~ до 10 %; в) средней концентрации ~ 10 — 30% б) концентрированные ~ 30 % и выше;
72. По наличию или отсутствию электролитической диссоциации Растворы электролитов — в которых вещества диссоциируют на ионы (соли, кислоты и гидроксиды — КNО 3 , НС l , КОН). Растворы неэлектролитов – в которых вещества практически не диссоциируют в воде( растворы сахарозы, глюкозы, мочевины. ) Растворы амфолитов — веществ, которые могут диссоциировать и по кислотному, и по основному типу: А l( ОН) 3 , глицин. 3. По концентрации а) разбавленные растворы ~ до 10 %; в) средней концентрации ~ 10 — 30% б) концентрированные ~ 30 % и выше;
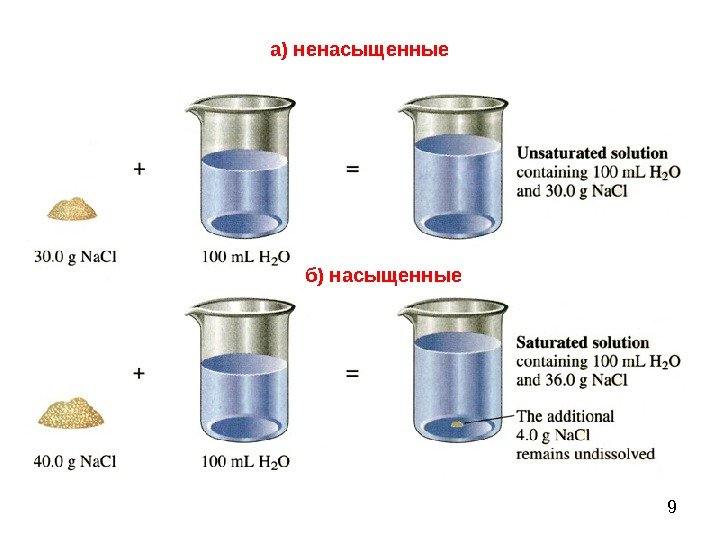
 8 а) Ненасыщенный — раствор, в котором еще можно растворить добавочное количество данного вещества. б) Насыщенный — раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом. 4. По равновесному состоянию
8 а) Ненасыщенный — раствор, в котором еще можно растворить добавочное количество данного вещества. б) Насыщенный — раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом. 4. По равновесному состоянию
 9 б) насыщенные а) ненасыщенные
9 б) насыщенные а) ненасыщенные
 10 в) пересыщенные – содержащие значительно больше растворенного вещества чем его требуется для насыщения при данной температуре Пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества. Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов-центров кристаллизации.
10 в) пересыщенные – содержащие значительно больше растворенного вещества чем его требуется для насыщения при данной температуре Пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества. Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов-центров кристаллизации.
 11 Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. S – растворимость — масса вещества, способная растворяться в 100 г растворителя (воды).
11 Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. S – растворимость — масса вещества, способная растворяться в 100 г растворителя (воды).
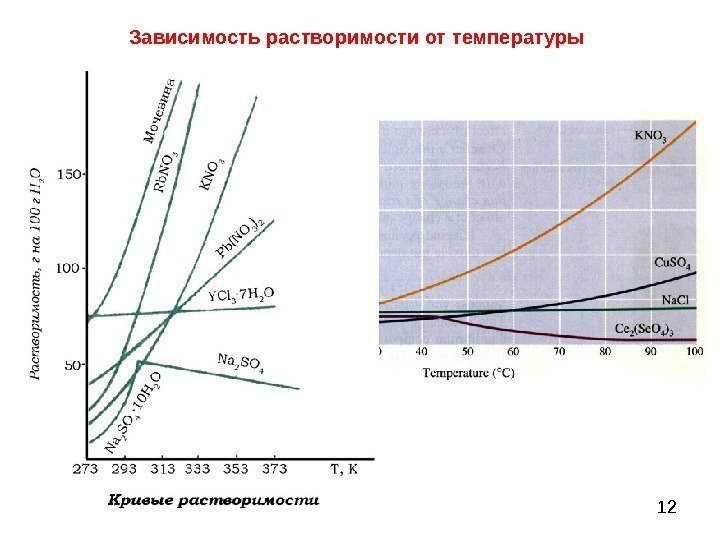
 12 Зависимость растворимости от температуры
12 Зависимость растворимости от температуры
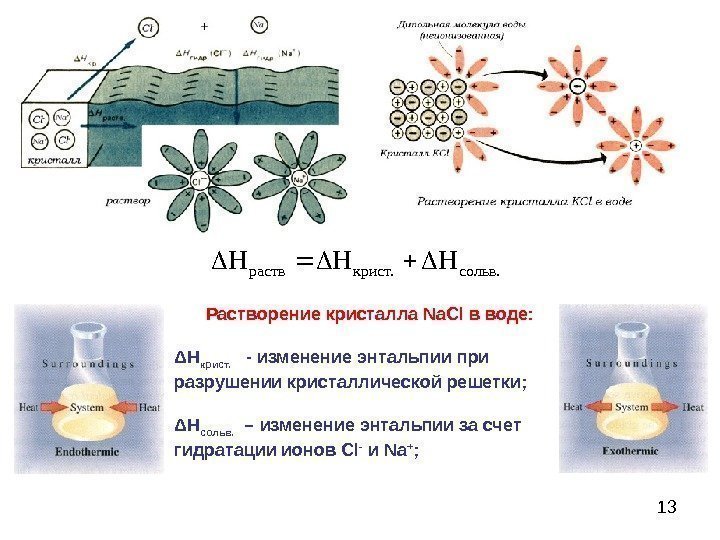
 13 сольв. крист. раств. HHHРастворение кристалла Na. Cl в воде: Δ Н крист. — изменение энтальпии при разрушении кристаллической решетки; Δ Н сольв. – изменение энтальпии за счет гидратации ионов С l — и Na + ;
13 сольв. крист. раств. HHHРастворение кристалла Na. Cl в воде: Δ Н крист. — изменение энтальпии при разрушении кристаллической решетки; Δ Н сольв. – изменение энтальпии за счет гидратации ионов С l — и Na + ;
 14· 100% m m % ра)-(р ва)-(в 1. Процентная – масса вещества в 100 г раствора Процентная концентрация выражается числом, граммов растворенного вещества, содержащимся в 100 граммах раствора 95 г Н 2 О + 5 г Na. Cl = 100 г 5 %-ного раствора Na. Cl. Способы выражения концентраций растворов
14· 100% m m % ра)-(р ва)-(в 1. Процентная – масса вещества в 100 г раствора Процентная концентрация выражается числом, граммов растворенного вещества, содержащимся в 100 граммах раствора 95 г Н 2 О + 5 г Na. Cl = 100 г 5 %-ного раствора Na. Cl. Способы выражения концентраций растворов
 15 «% — сотая часть » 2 мл 3% раствора – 60 мг 7 мл 4% раствора – 280 мг 25 мл 25% раствора — ? мг m мг = V мл ∙ ω %∙
15 «% — сотая часть » 2 мл 3% раствора – 60 мг 7 мл 4% раствора – 280 мг 25 мл 25% раствора — ? мг m мг = V мл ∙ ω %∙
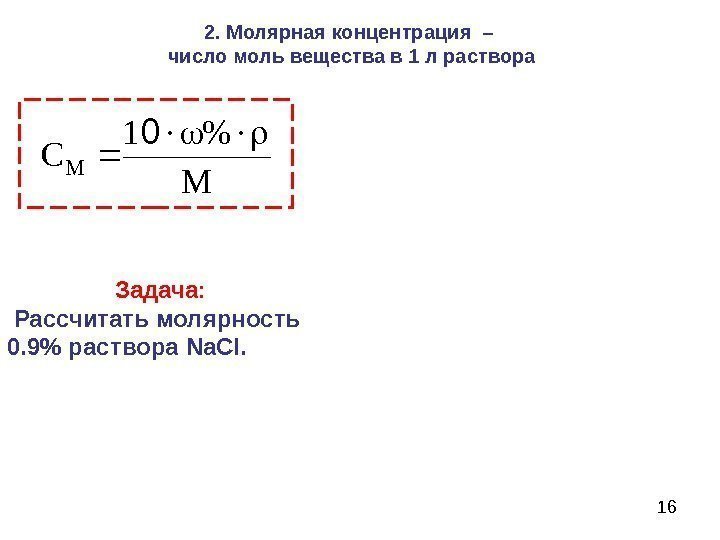
 16 M 1 ·%· CM 02. Молярная концентрация – число моль вещества в 1 л раствора Задача: Рассчитать молярность 0. 9% раствора Na. CI.
16 M 1 ·%· CM 02. Молярная концентрация – число моль вещества в 1 л раствора Задача: Рассчитать молярность 0. 9% раствора Na. CI.
 17 M · f ρ · %ω · 01 н. C 3. Нормальная концентрация – число моль-экв вещества в 1 л раствора
17 M · f ρ · %ω · 01 н. C 3. Нормальная концентрация – число моль-экв вещества в 1 л раствора
 18 Фактор эквивалентности – f экв (Х) – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. z 1 (Х)эквf z – основность кислоты или кислотность основания данной кислотно-основной реакции, или число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции. Эквивалент — реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
18 Фактор эквивалентности – f экв (Х) – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. z 1 (Х)эквf z – основность кислоты или кислотность основания данной кислотно-основной реакции, или число электронов, присоединяемых или теряемых частицей в данной окислительно-восстановительной реакции. Эквивалент — реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
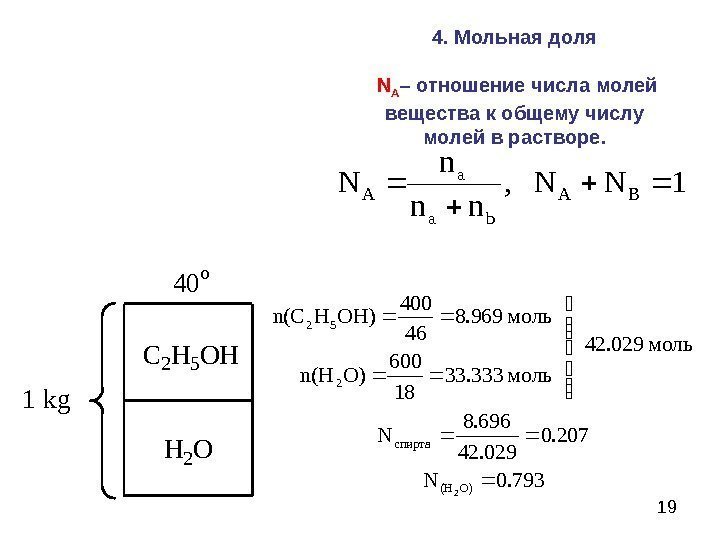
 19 C 2 H 5 OH H 2 O 40 o 1 kg 0. 793 N 0. 207 42. 029 8. 696 N моль 42. 029 моль 33. 333 18600 O)n(H моль 8. 969 46400 OH)Hn(C O)(Hспирта 252 2 1 NN , nn n N BA ba a A 4. Мольная доля N A – отношение числа молей вещества к общему числу молей в растворе.
19 C 2 H 5 OH H 2 O 40 o 1 kg 0. 793 N 0. 207 42. 029 8. 696 N моль 42. 029 моль 33. 333 18600 O)n(H моль 8. 969 46400 OH)Hn(C O)(Hспирта 252 2 1 NN , nn n N BA ba a A 4. Мольная доля N A – отношение числа молей вещества к общему числу молей в растворе.
 205. Моляльность m — число моль вещества в 1000 г растворителя (не зависит от температуры, поэтому применяется в клинической практике!)ля-р ва-в m · M 000 m 1· m
205. Моляльность m — число моль вещества в 1000 г растворителя (не зависит от температуры, поэтому применяется в клинической практике!)ля-р ва-в m · M 000 m 1· m
 21 6. Титр раствора Т – число грамм вещества в 1 мл раствора (г/мл). С м = 1000 Т/ М ω% = 100 Т 7. Миллиграмм процент мг % — масса вещества в миллиграммах на 100 мл раствора (мг/ 100 мл – при пл. =1)
21 6. Титр раствора Т – число грамм вещества в 1 мл раствора (г/мл). С м = 1000 Т/ М ω% = 100 Т 7. Миллиграмм процент мг % — масса вещества в миллиграммах на 100 мл раствора (мг/ 100 мл – при пл. =1)
 22 Осмолярная концентрация — суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы. В организме человека осмолярность составляет примерно 290 -300 м. Осм/л ( ~ 0. 29 -0. 30 Осм/л) Осмолярность (осмолярная концентрация) N a+ C l -Ca 2 + -COO- Pt-COO — — N H 3 + Fe 3+ Концентрационный гомеостаз – постоянство кислотности, концентраций солей и органических веществ в жидких средах организма
22 Осмолярная концентрация — суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы. В организме человека осмолярность составляет примерно 290 -300 м. Осм/л ( ~ 0. 29 -0. 30 Осм/л) Осмолярность (осмолярная концентрация) N a+ C l -Ca 2 + -COO- Pt-COO — — N H 3 + Fe 3+ Концентрационный гомеостаз – постоянство кислотности, концентраций солей и органических веществ в жидких средах организма
 23 Растворы электролитов Электролиты – вещества, растворы и расплавы которых проводят электрический ток вследствие диссоциации на ионы. 1. Сильные электролиты диссоциируют полностью, необратимо, в одну ступень. 2 4 3 32 SOAl , Cl. HHCl 342)(SOAl c a 0)(c 1 im 1 0 ·c, a f ff a – активность иона f – коэффициент активности, учитывающий межионное взаимодействие
23 Растворы электролитов Электролиты – вещества, растворы и расплавы которых проводят электрический ток вследствие диссоциации на ионы. 1. Сильные электролиты диссоциируют полностью, необратимо, в одну ступень. 2 4 3 32 SOAl , Cl. HHCl 342)(SOAl c a 0)(c 1 im 1 0 ·c, a f ff a – активность иона f – коэффициент активности, учитывающий межионное взаимодействие

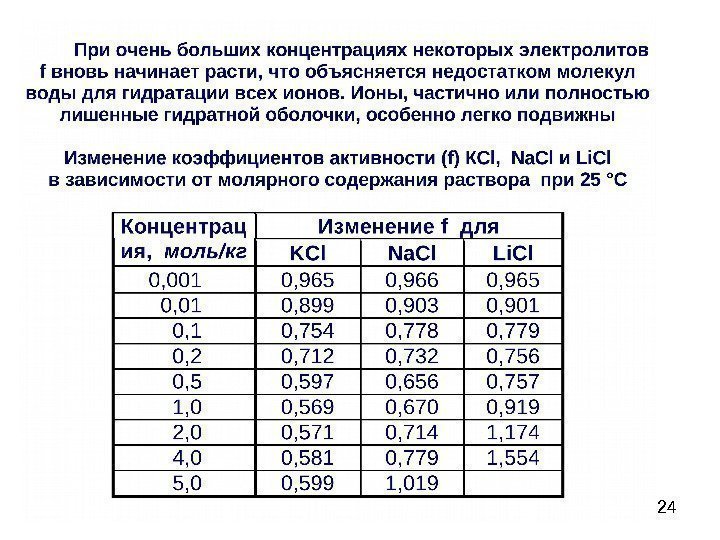
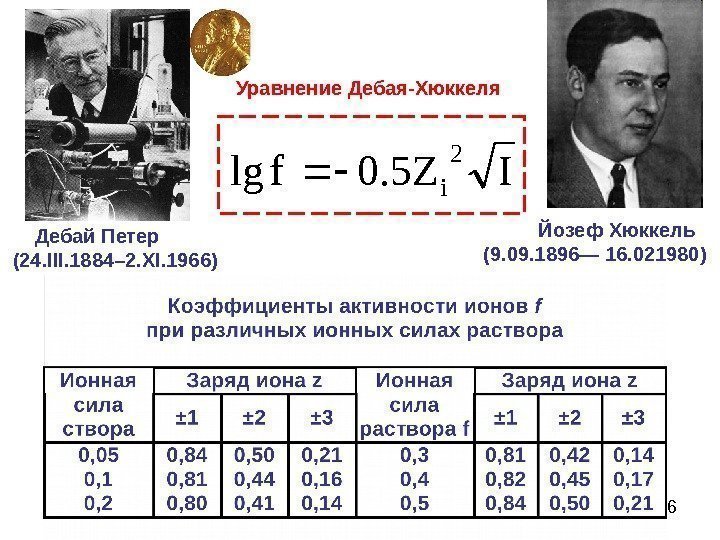
 25 Ионная сила растворов — величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда (понятие введено Г. Льюисом ) 2 nn 2 222 11 z. C. . . z. CI 21 Ионная сила – удобная характеристика раствора, учитывающая взаимодействие ионов, что важно для изучения биологических систем и физиологических растворов, ионная сила которых, в том числе и 0. 9% (0. 15 м) Na. CI равна, как правило, 0. 15. Ионная сила характеризует общее число ионных зарядов в единице объема, независимо от их знаков. Размерность — обратна размерности объема.
25 Ионная сила растворов — величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда (понятие введено Г. Льюисом ) 2 nn 2 222 11 z. C. . . z. CI 21 Ионная сила – удобная характеристика раствора, учитывающая взаимодействие ионов, что важно для изучения биологических систем и физиологических растворов, ионная сила которых, в том числе и 0. 9% (0. 15 м) Na. CI равна, как правило, 0. 15. Ионная сила характеризует общее число ионных зарядов в единице объема, независимо от их знаков. Размерность — обратна размерности объема.
 26 Уравнение Дебая-Хюккеля. IZ 5. 0 flg 2 i Дебай Петер (24. III. 1884– 2. XI. 1966) Йозеф Хюккель (9. 09. 1896— 16. 021980)
26 Уравнение Дебая-Хюккеля. IZ 5. 0 flg 2 i Дебай Петер (24. III. 1884– 2. XI. 1966) Йозеф Хюккель (9. 09. 1896— 16. 021980)
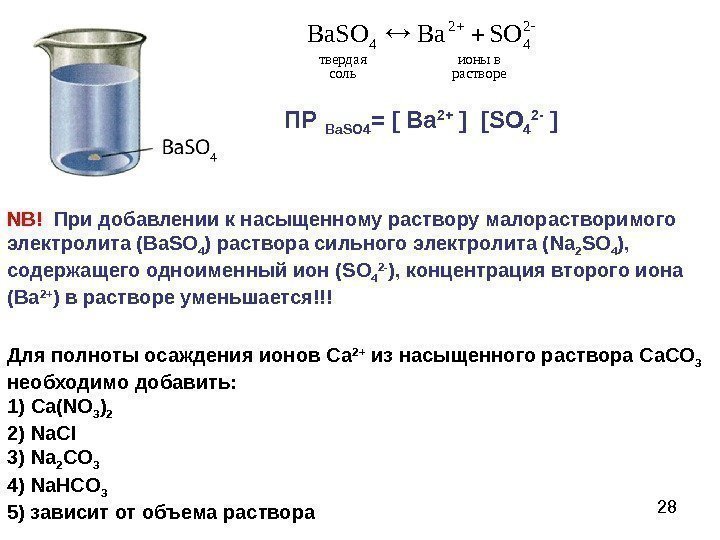
 27 NB! При добавлении к насыщенному раствору малорастворимого электролита раствора сильного электролита, не имеющего с ним общих ионов, повышается ионная сила раствора, понижается коэффициент активности f , следовательно, произведение активностей ионов становится меньше ПР, т. е. раствор становится ненасыщенным, происходит растворение осадка. Это явление называется солевым эффектом. растворе вионы сольтвердая. SOВa. SO 2 42 4 ПР Ва SO 4 = [ Ba 2+ ] [SO 4 2 — ] IZ 5. 0 flg 2 i Добавление Na. NO 3 в насыщенный раствор Ag. Cl : 1) способствует образованию осадка 2) препятствует образованию осадка 3) на образование осадка не влияет 4) зависит от формы сосуда 5) зависит от объема сосуда
27 NB! При добавлении к насыщенному раствору малорастворимого электролита раствора сильного электролита, не имеющего с ним общих ионов, повышается ионная сила раствора, понижается коэффициент активности f , следовательно, произведение активностей ионов становится меньше ПР, т. е. раствор становится ненасыщенным, происходит растворение осадка. Это явление называется солевым эффектом. растворе вионы сольтвердая. SOВa. SO 2 42 4 ПР Ва SO 4 = [ Ba 2+ ] [SO 4 2 — ] IZ 5. 0 flg 2 i Добавление Na. NO 3 в насыщенный раствор Ag. Cl : 1) способствует образованию осадка 2) препятствует образованию осадка 3) на образование осадка не влияет 4) зависит от формы сосуда 5) зависит от объема сосуда
 28 NB! При добавлении к насыщенному раствору малорастворимого электролита ( Ba. SO 4 ) раствора сильного электролита ( Na 2 SO 4 ) , содержащего одноименный ион ( SO 4 2 — ), концентрация второго иона ( Ba 2+ ) в растворе уменьшается!!!растворе вионы соль твердая SOВa. SO 2 4 ПР Ва SO 4 = [ Ba 2+ ] [SO 4 2 — ] Для полноты осаждения ионов Са 2+ из насыщенного раствора Са. СО 3 необходимо добавить: 1) Ca ( NO 3 ) 2 2) Na. Cl 3) Na 2 CO 3 4) Na. HCO 3 5) зависит от объема раствора
28 NB! При добавлении к насыщенному раствору малорастворимого электролита ( Ba. SO 4 ) раствора сильного электролита ( Na 2 SO 4 ) , содержащего одноименный ион ( SO 4 2 — ), концентрация второго иона ( Ba 2+ ) в растворе уменьшается!!!растворе вионы соль твердая SOВa. SO 2 4 ПР Ва SO 4 = [ Ba 2+ ] [SO 4 2 — ] Для полноты осаждения ионов Са 2+ из насыщенного раствора Са. СО 3 необходимо добавить: 1) Ca ( NO 3 ) 2 2) Na. Cl 3) Na 2 CO 3 4) Na. HCO 3 5) зависит от объема раствора
 292. Слабые электролиты диссоциируют обратимо, ступенчато. HCOOCHCOOHCH 33 α – степень диссоциации К д – константа диссоциации Степень диссоциации (ионизации) — отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе. α зависит от: Природы вещества и растворителя; Концентрации; Температуры; Присутствия одноименного иона. 10 , общ. диссоц. С С
292. Слабые электролиты диссоциируют обратимо, ступенчато. HCOOCHCOOHCH 33 α – степень диссоциации К д – константа диссоциации Степень диссоциации (ионизации) — отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе. α зависит от: Природы вещества и растворителя; Концентрации; Температуры; Присутствия одноименного иона. 10 , общ. диссоц. С С
 30 Закон разбавления Оствальда Нобелевская премия (1909 г) « в знак признания работ по катализу, а также за исследования основных принципов управления химическим равновесием и скоростями реакций» С 1887 года работал в одной лаборатории с Вант-Гоффом, Аррениусом и Нернстом. (02. 09. 1853 – 4. 06. 1932) О нем говорили: «Потолкуй с Оствальдом полчаса, и ты будешь иметь работу на полгода» α 1 α 2 C Кд
30 Закон разбавления Оствальда Нобелевская премия (1909 г) « в знак признания работ по катализу, а также за исследования основных принципов управления химическим равновесием и скоростями реакций» С 1887 года работал в одной лаборатории с Вант-Гоффом, Аррениусом и Нернстом. (02. 09. 1853 – 4. 06. 1932) О нем говорили: «Потолкуй с Оствальдом полчаса, и ты будешь иметь работу на полгода» α 1 α 2 C Кд
 31 CC — 3 СС 3 H COOHC COOHHC 1α α 1 α α αα 2 3 3 , C CC CC COOH][CH ]][HCOO[CH Кд 2 д C∙αКПри <<1 /СКα д ∙СК][Hд ·СК/СКC·C][Hддд 2 αВывод закона разведения Оствальда
31 CC — 3 СС 3 H COOHC COOHHC 1α α 1 α α αα 2 3 3 , C CC CC COOH][CH ]][HCOO[CH Кд 2 д C∙αКПри <<1 /СКα д ∙СК][Hд ·СК/СКC·C][Hддд 2 αВывод закона разведения Оствальда
 322. Степень диссоциации кислоты HX равна 0, 25. Какое суммарное число ионов H + и X — приходится в ее растворе на каждые 100 нераспавшихся молекул (ответ округлите до целого числа)? 1) 16 2) 33 3) 67 4) 8510 , общ. диссоц. С С 1. На каждые 20 нераспавшихся молекул кислоты HX приходится 5 ионов H + и 5 ионов X -. Укажите степень диссоциации кислоты: 1) 0, 05 2) 0, 10 3) 0, 15 4) 0,
322. Степень диссоциации кислоты HX равна 0, 25. Какое суммарное число ионов H + и X — приходится в ее растворе на каждые 100 нераспавшихся молекул (ответ округлите до целого числа)? 1) 16 2) 33 3) 67 4) 8510 , общ. диссоц. С С 1. На каждые 20 нераспавшихся молекул кислоты HX приходится 5 ионов H + и 5 ионов X -. Укажите степень диссоциации кислоты: 1) 0, 05 2) 0, 10 3) 0, 15 4) 0,
![33 Задача: Рассчитать концентрацию ионов водорода [ Н + ] в 9 растворе уксуса 33 Задача: Рассчитать концентрацию ионов водорода [ Н + ] в 9 растворе уксуса](http://present5.com/presentforday2/20161222/2.1._rastvory_images/2.1._rastvory_32.jpg) 33 Задача: Рассчитать концентрацию ионов водорода [ Н + ] в 9% растворе уксуса (пл. =1), К д =1. 75 ∙ 10 -5.
33 Задача: Рассчитать концентрацию ионов водорода [ Н + ] в 9% растворе уксуса (пл. =1), К д =1. 75 ∙ 10 -5.
![34 Задача: Рассчитать концентрацию ионов водорода [ Н+ ] в 9 растворе уксуса 34 Задача: Рассчитать концентрацию ионов водорода [ Н+ ] в 9 растворе уксуса](http://present5.com/presentforday2/20161222/2.1._rastvory_images/2.1._rastvory_33.jpg) 34 Задача: Рассчитать концентрацию ионов водорода [ Н+ ] в 9% растворе уксуса (пл. =1)∙СК][H д M 1 ·%· C M 0 Ответ: [ Н+ ]= 5. 12 ∙ 10 -3 моль-экв/л
34 Задача: Рассчитать концентрацию ионов водорода [ Н+ ] в 9% растворе уксуса (пл. =1)∙СК][H д M 1 ·%· C M 0 Ответ: [ Н+ ]= 5. 12 ∙ 10 -3 моль-экв/л
 35 Спасибо за внимание!
35 Спасибо за внимание!
