1 Металлоорганические соединения металлов 2 и12 групп (2M



![Методы синтеза магнийорганических соединений [1a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир. Методы синтеза магнийорганических соединений [1a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир.](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_5.jpg)
![Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 [2] Трансметаллирование: 10 Mg Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 [2] Трансметаллирование: 10 Mg](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_9.jpg)



![22 Сэндвичи [Cp*22M] R2M + 2Cp*H 2RH + Cp*2M в углеводородах 22 Сэндвичи [Cp*22M] R2M + 2Cp*H 2RH + Cp*2M в углеводородах](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_21.jpg)
![23 Сэндвичи [Cp*22M] особенности строения 23 Сэндвичи [Cp*22M] особенности строения](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_22.jpg)

![Вариант 2: добавим избыток лиганда, но не добавим восстановителя Mn+ + 6L = [ML6]n+ Вариант 2: добавим избыток лиганда, но не добавим восстановителя Mn+ + 6L = [ML6]n+](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_25.jpg)

![32 Методы синтеза R2Zn – [1а], [2], [4] [1а] [4] [2] ZnCl2 + 2RLi 32 Методы синтеза R2Zn – [1а], [2], [4] [1а] [4] [2] ZnCl2 + 2RLi](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_31.jpg)

![37 Комплексы [R2Zn(L)n] [Et2Zn(TMEDA)] 37 Комплексы [R2Zn(L)n] [Et2Zn(TMEDA)]](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_36.jpg)

![39 Арильные соединения Ar2Zn и их производные [Ph2Zn(Py)2] [Ph2Zn(18-crown-6)] 39 Арильные соединения Ar2Zn и их производные [Ph2Zn(Py)2] [Ph2Zn(18-crown-6)]](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_38.jpg)
![40 Сэндвичевые соединения [Cp*2Zn] = [(5-Cp*)(1-Cp*)Zn] Число валентных 40 Сэндвичевые соединения [Cp*2Zn] = [(5-Cp*)(1-Cp*)Zn] Число валентных](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_39.jpg)
![41 Полусэндвичевые соединения Аналогично для цинка, [Cp*ZnMe]: [CpBeMe]: 1.71 Å 1.50 Å 1.90 Å 41 Полусэндвичевые соединения Аналогично для цинка, [Cp*ZnMe]: [CpBeMe]: 1.71 Å 1.50 Å 1.90 Å](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_40.jpg)






![56 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr солнечный свет (история) [1а] 56 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr солнечный свет (история) [1а]](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_55.jpg)
![57 [7] [10] [11] [электроалкилирование] Металлоорганические соединения ртути в степени окисления +2 57 [7] [10] [11] [электроалкилирование] Металлоорганические соединения ртути в степени окисления +2](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_56.jpg)

![66 Немного подробнее о меркурировании Электрофильное замещение H+ на [Hg(OAc)]+ кроме аренов могут 66 Немного подробнее о меркурировании Электрофильное замещение H+ на [Hg(OAc)]+ кроме аренов могут](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_65.jpg)



lectures_4_5.ppt
- Количество слайдов: 74
 1 Металлоорганические соединения металлов 2 и12 групп (2M и 12M)
1 Металлоорганические соединения металлов 2 и12 групп (2M и 12M)
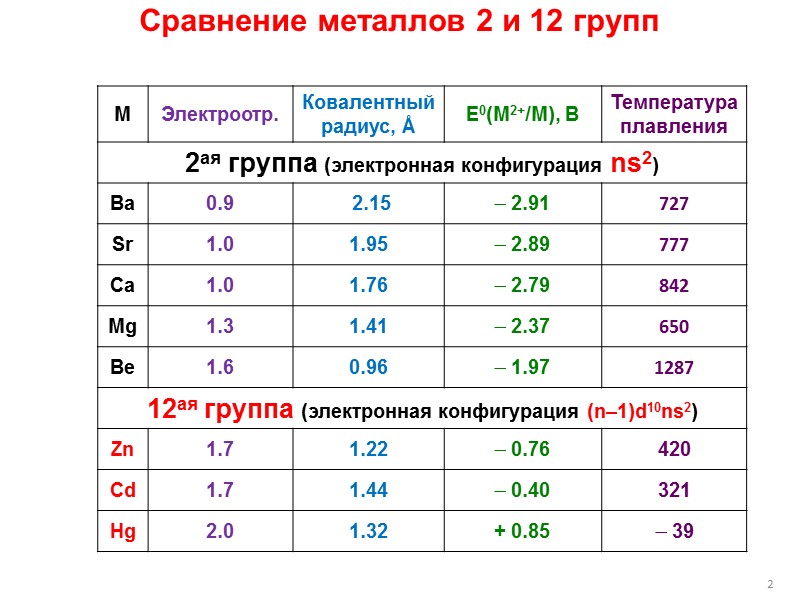
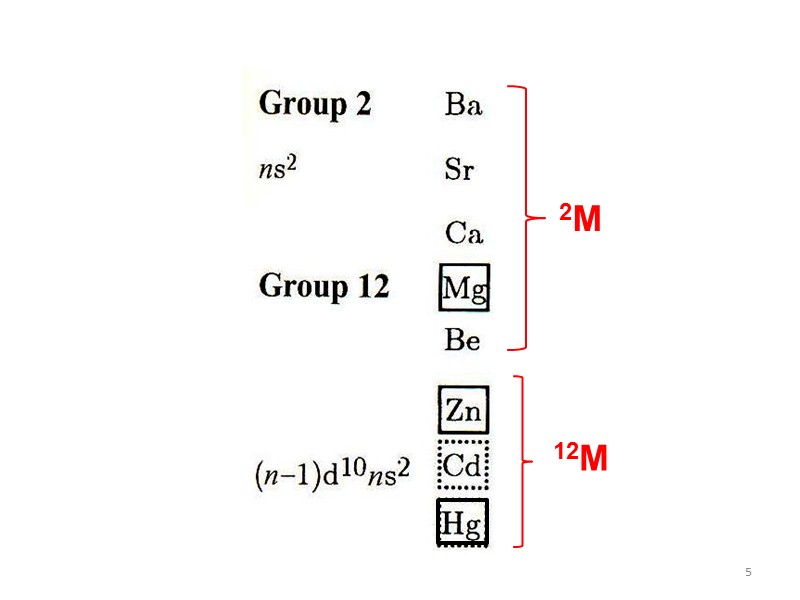
 2 Сравнение металлов 2 и 12 групп
2 Сравнение металлов 2 и 12 групп
 3 Сравнение металлов 2 и 12 групп Полярность связи M–C: для Zn и Cd – того же порядка, что и Be–C; для Hg – связь ковалентная малополярная. Склонность к образованию многоцентр. связей M–C–M : в отличие от Be и Mg, для 12M менее характерна, причем уменьшается от Zn к Hg. Льюисова кислотность: для Zn – того же порядка, что и для магния; уменьшается от Zn к Hg.
3 Сравнение металлов 2 и 12 групп Полярность связи M–C: для Zn и Cd – того же порядка, что и Be–C; для Hg – связь ковалентная малополярная. Склонность к образованию многоцентр. связей M–C–M : в отличие от Be и Mg, для 12M менее характерна, причем уменьшается от Zn к Hg. Льюисова кислотность: для Zn – того же порядка, что и для магния; уменьшается от Zn к Hg.
 4 Сравнение металлов 2 и 12 групп Редокс-свойства: как и соединения 2M2+, соединения Zn2+ и Cd2+ могут обладать восстановительными свойствами только за счет R–; соединения Hg(II) могут быть окислителями за счет самого Hg(II). Активность как источника нуклеофильного фрагмента R– : для Zn и Cd – да, но меньше, чем 2M; для Hg – нет, только за счет восстановления Hg2+ до Hg0. Чувствительность к H+ и O2: для Zn и Cd – да, но меньше, чем для 2M; для Hg – нет.
4 Сравнение металлов 2 и 12 групп Редокс-свойства: как и соединения 2M2+, соединения Zn2+ и Cd2+ могут обладать восстановительными свойствами только за счет R–; соединения Hg(II) могут быть окислителями за счет самого Hg(II). Активность как источника нуклеофильного фрагмента R– : для Zn и Cd – да, но меньше, чем 2M; для Hg – нет, только за счет восстановления Hg2+ до Hg0. Чувствительность к H+ и O2: для Zn и Cd – да, но меньше, чем для 2M; для Hg – нет.
 5 2M 12M
5 2M 12M
![>Методы синтеза магнийорганических соединений [1a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир. >Методы синтеза магнийорганических соединений [1a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир.](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_5.jpg) Методы синтеза магнийорганических соединений [1a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир. Для арилхлоридов только ТГФ или смесь ТГФ/петролейный эфир. Реактивы Гриньяра 6 Mg + RX + nEt2O RMgX(Et2O)n (X = Br, I)
Методы синтеза магнийорганических соединений [1a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир. Для арилхлоридов только ТГФ или смесь ТГФ/петролейный эфир. Реактивы Гриньяра 6 Mg + RX + nEt2O RMgX(Et2O)n (X = Br, I)
 Методы синтеза магнийорганических соединений Несольватированные «Гриньяры» получены только в аргоновой матрице соконденсацией из газовой фазы: Реактивы Гриньяра 7 Mg(г) + RX (г) RMgX (при – 196 оС)
Методы синтеза магнийорганических соединений Несольватированные «Гриньяры» получены только в аргоновой матрице соконденсацией из газовой фазы: Реактивы Гриньяра 7 Mg(г) + RX (г) RMgX (при – 196 оС)
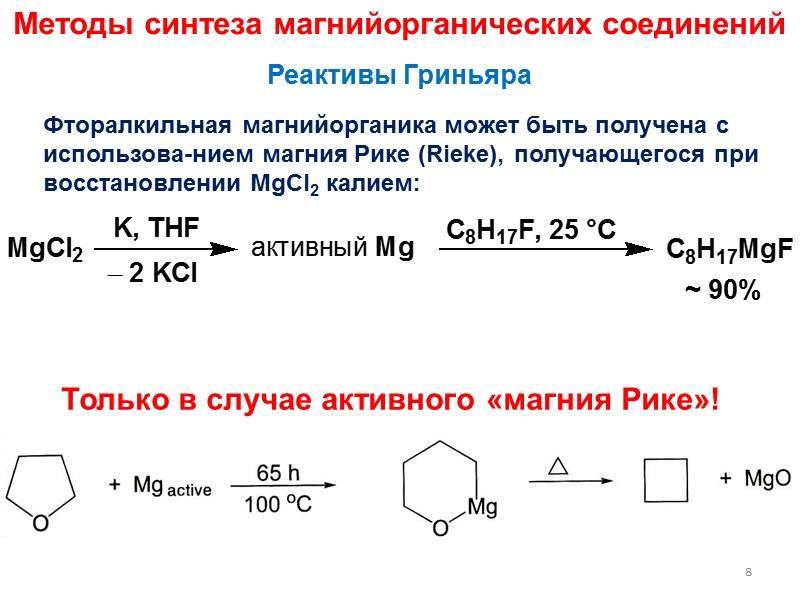
 Методы синтеза магнийорганических соединений Фторалкильная магнийорганика может быть получена с использова-нием магния Рике (Rieke), получающегося при восстановлении MgCl2 калием: Реактивы Гриньяра 8 ~ 90% Только в случае активного «магния Рике»!
Методы синтеза магнийорганических соединений Фторалкильная магнийорганика может быть получена с использова-нием магния Рике (Rieke), получающегося при восстановлении MgCl2 калием: Реактивы Гриньяра 8 ~ 90% Только в случае активного «магния Рике»!
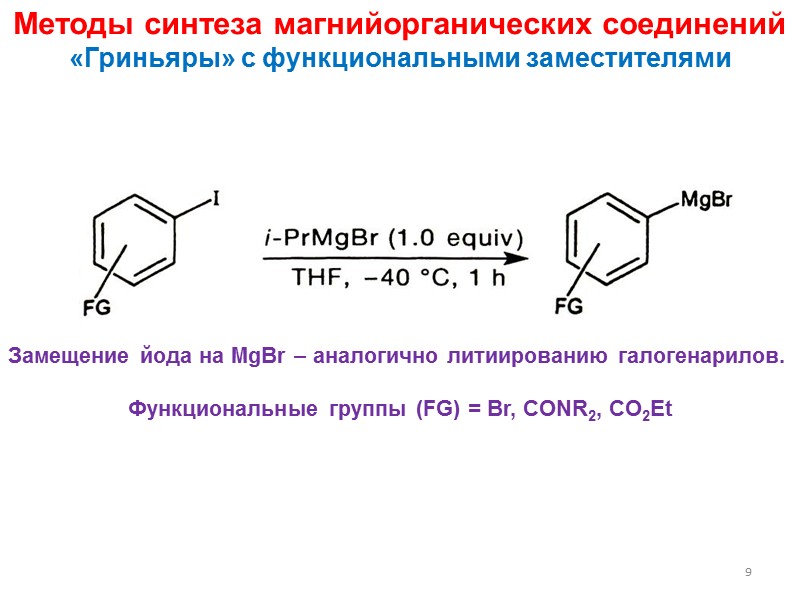
 Методы синтеза магнийорганических соединений «Гриньяры» с функциональными заместителями Замещение йода на MgBr – аналогично литиированию галогенарилов. Функциональные группы (FG) = Br, CONR2, CO2Et 9
Методы синтеза магнийорганических соединений «Гриньяры» с функциональными заместителями Замещение йода на MgBr – аналогично литиированию галогенарилов. Функциональные группы (FG) = Br, CONR2, CO2Et 9
![>Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 [2] Трансметаллирование: 10 Mg >Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 [2] Трансметаллирование: 10 Mg](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_9.jpg) Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 [2] Трансметаллирование: 10 Mg + R2Hg R2Mg + Hg
Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 [2] Трансметаллирование: 10 Mg + R2Hg R2Mg + Hg
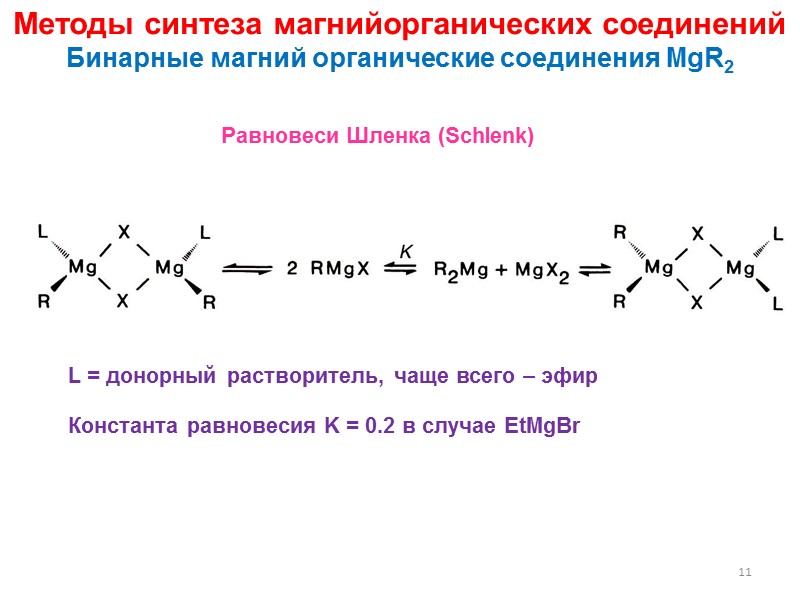
 11 L = донорный растворитель, чаще всего – эфир Константа равновесия K = 0.2 в случае EtMgBr Равновеси Шленка (Schlenk) Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2
11 L = донорный растворитель, чаще всего – эфир Константа равновесия K = 0.2 в случае EtMgBr Равновеси Шленка (Schlenk) Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2
 Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 Сдвиг равновесия «диспропорционирования» за счет образования осадка: Можно, и даже лучше, использовать нециклические полиэфиры Me(OCH2CH2)nOMe 12
Методы синтеза магнийорганических соединений Бинарные магний органические соединения MgR2 Сдвиг равновесия «диспропорционирования» за счет образования осадка: Можно, и даже лучше, использовать нециклические полиэфиры Me(OCH2CH2)nOMe 12
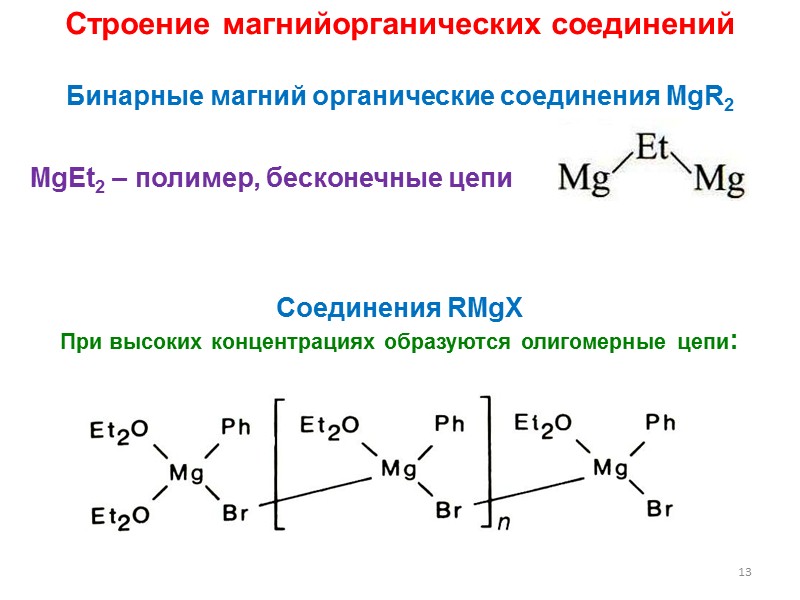
 13 MgEt2 – полимер, бесконечные цепи Строение магнийорганических соединений Бинарные магний органические соединения MgR2 Cоединения RMgX При высоких концентрациях образуются олигомерные цепи:
13 MgEt2 – полимер, бесконечные цепи Строение магнийорганических соединений Бинарные магний органические соединения MgR2 Cоединения RMgX При высоких концентрациях образуются олигомерные цепи:
 14 Строение магнийорганических соединений Бинарные магний органические соединения MgR2 Полимерные цепи могут быть «разбиты» такими лигандами как краун-эфиры с образованием структур ротаксанового типа Mg – O 2.78 Å Mg – C 2.10 Å
14 Строение магнийорганических соединений Бинарные магний органические соединения MgR2 Полимерные цепи могут быть «разбиты» такими лигандами как краун-эфиры с образованием структур ротаксанового типа Mg – O 2.78 Å Mg – C 2.10 Å
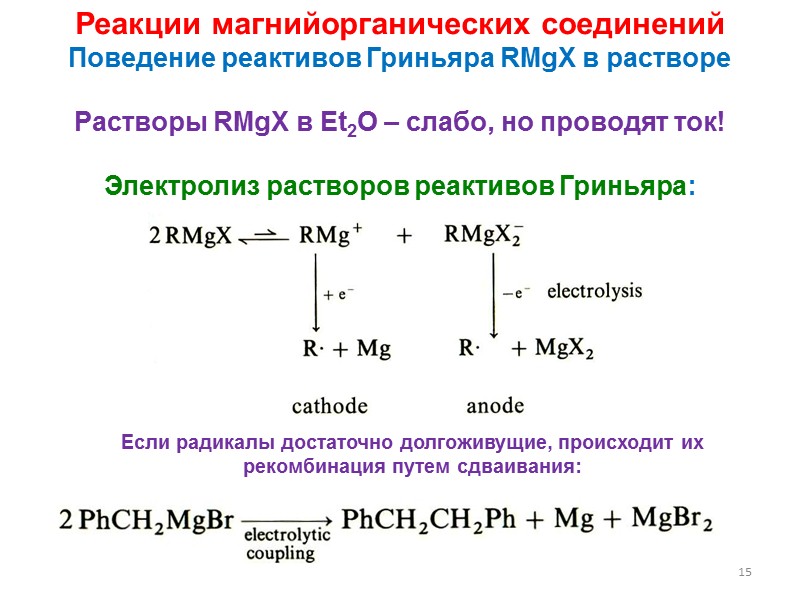
 15 Реакции магнийорганических соединений Поведение реактивов Гриньяра RMgX в растворе Растворы RMgX в Et2O – слабо, но проводят ток! Электролиз растворов реактивов Гриньяра: Если радикалы достаточно долгоживущие, происходит их рекомбинация путем сдваивания:
15 Реакции магнийорганических соединений Поведение реактивов Гриньяра RMgX в растворе Растворы RMgX в Et2O – слабо, но проводят ток! Электролиз растворов реактивов Гриньяра: Если радикалы достаточно долгоживущие, происходит их рекомбинация путем сдваивания:
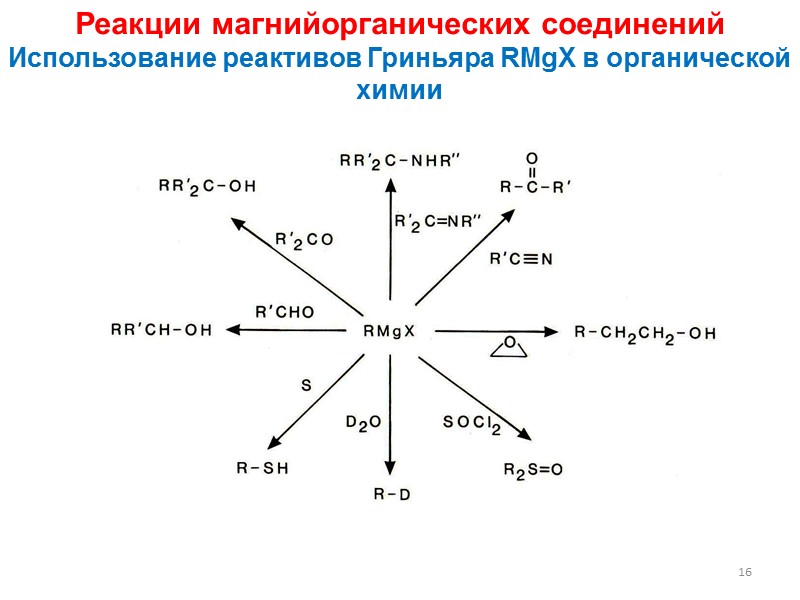
 16 Реакции магнийорганических соединений Использование реактивов Гриньяра RMgX в органической химии
16 Реакции магнийорганических соединений Использование реактивов Гриньяра RMgX в органической химии
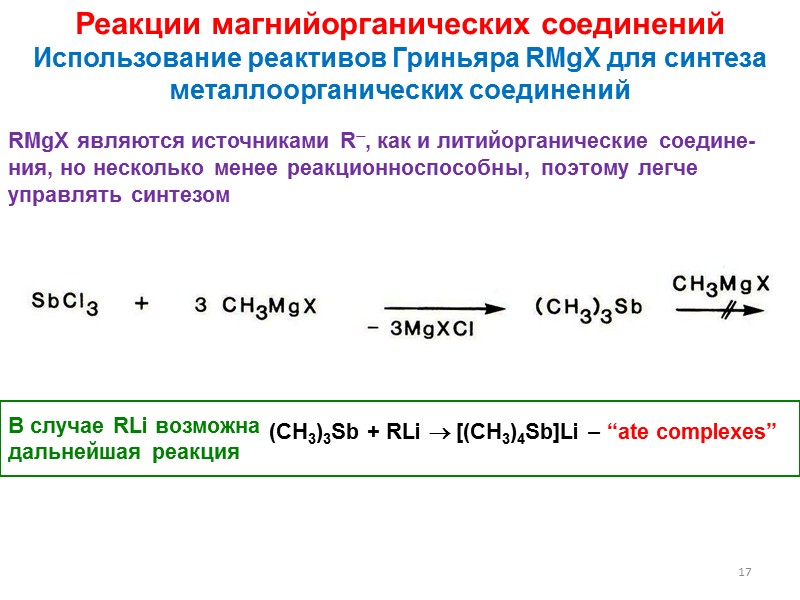
 17 Реакции магнийорганических соединений Использование реактивов Гриньяра RMgX для синтеза металлоорганических соединений RMgX являются источниками R, как и литийорганические соедине-ния, но несколько менее реакционноспособны, поэтому легче управлять синтезом (CH3)3Sb + RLi [(CH3)4Sb]Li – “ate complexes” В случае RLi возможна дальнейшая реакция
17 Реакции магнийорганических соединений Использование реактивов Гриньяра RMgX для синтеза металлоорганических соединений RMgX являются источниками R, как и литийорганические соедине-ния, но несколько менее реакционноспособны, поэтому легче управлять синтезом (CH3)3Sb + RLi [(CH3)4Sb]Li – “ate complexes” В случае RLi возможна дальнейшая реакция
 18 Еще один пример:
18 Еще один пример:
 19 Реакции магнийорганических соединений Бинарные магнийорганические соединения MgR2 В основном: MgR2 – источник R–. Химия подобна той, которую проявляют RMgX Преимущество по сравнению с RMgX: очень хорошая растворимость в углеводородах (алканы, ароматика). Недостаток: существенно сложнее синтезировать.
19 Реакции магнийорганических соединений Бинарные магнийорганические соединения MgR2 В основном: MgR2 – источник R–. Химия подобна той, которую проявляют RMgX Преимущество по сравнению с RMgX: очень хорошая растворимость в углеводородах (алканы, ароматика). Недостаток: существенно сложнее синтезировать.
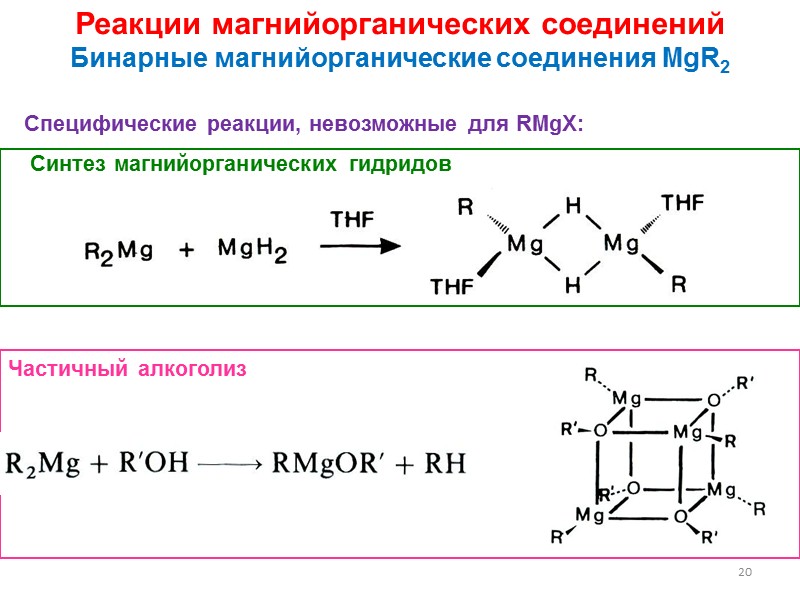
 20 Реакции магнийорганических соединений Бинарные магнийорганические соединения MgR2 Специфические реакции, невозможные для RMgX: Синтез магнийорганических гидридов Частичный алкоголиз
20 Реакции магнийорганических соединений Бинарные магнийорганические соединения MgR2 Специфические реакции, невозможные для RMgX: Синтез магнийорганических гидридов Частичный алкоголиз
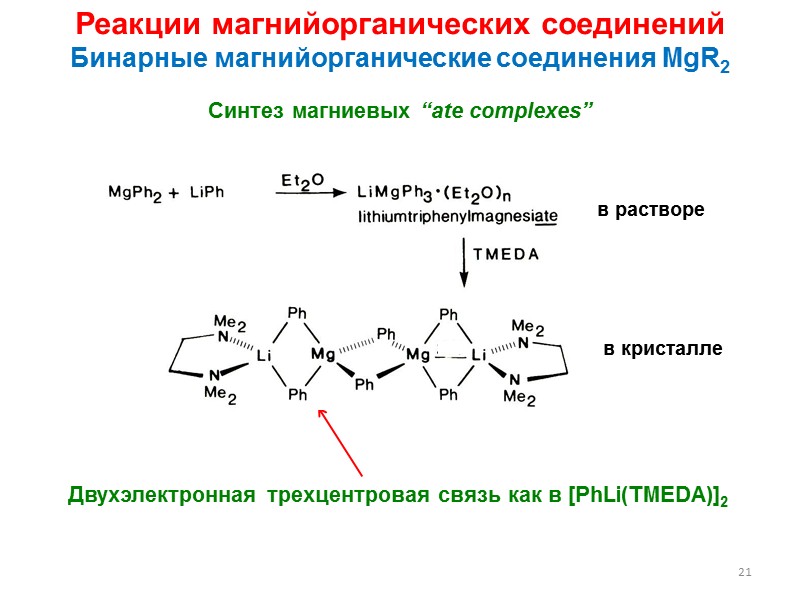
 21 Реакции магнийорганических соединений Бинарные магнийорганические соединения MgR2 Синтез магниевых “ate complexes” Двухэлектронная трехцентровая связь как в [PhLi(TMEDA)]2
21 Реакции магнийорганических соединений Бинарные магнийорганические соединения MgR2 Синтез магниевых “ate complexes” Двухэлектронная трехцентровая связь как в [PhLi(TMEDA)]2
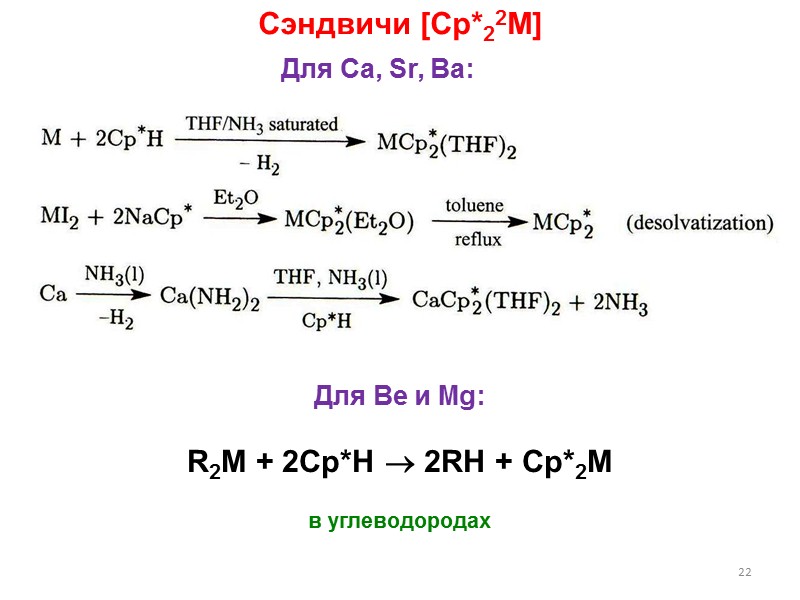
![>22 Сэндвичи [Cp*22M] R2M + 2Cp*H 2RH + Cp*2M в углеводородах >22 Сэндвичи [Cp*22M] R2M + 2Cp*H 2RH + Cp*2M в углеводородах](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_21.jpg) 22 Сэндвичи [Cp*22M] R2M + 2Cp*H 2RH + Cp*2M в углеводородах Для Ca, Sr, Ba: Для Be и Mg:
22 Сэндвичи [Cp*22M] R2M + 2Cp*H 2RH + Cp*2M в углеводородах Для Ca, Sr, Ba: Для Be и Mg:
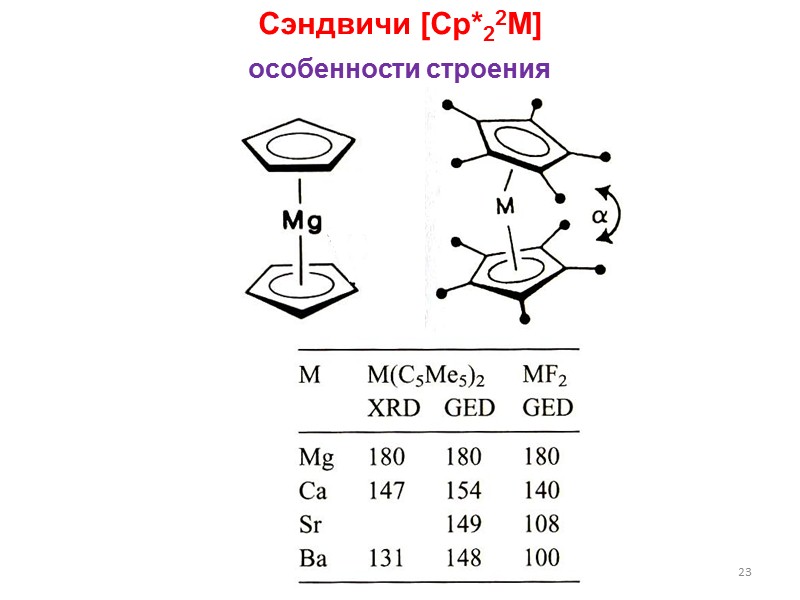
![>23 Сэндвичи [Cp*22M] особенности строения >23 Сэндвичи [Cp*22M] особенности строения](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_22.jpg) 23 Сэндвичи [Cp*22M] особенности строения
23 Сэндвичи [Cp*22M] особенности строения
 24 Как создать связь металл-металл?
24 Как создать связь металл-металл?
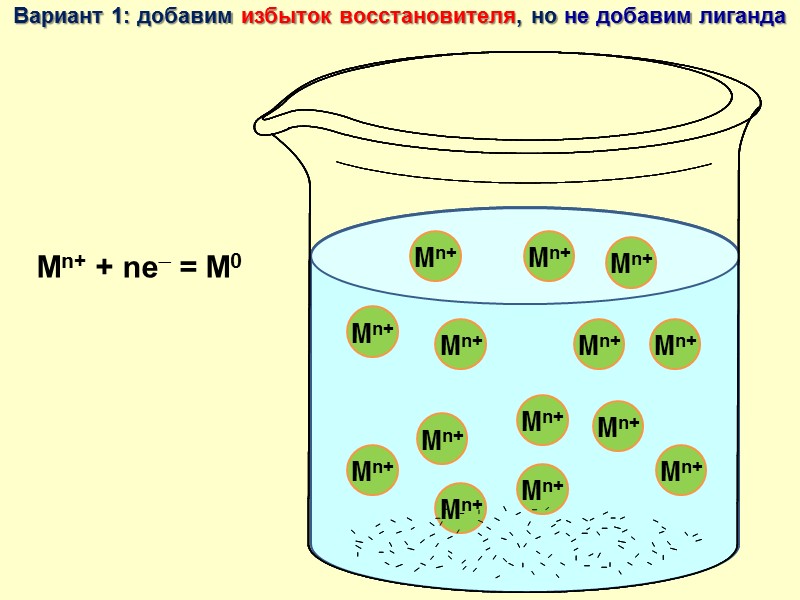
 Вариант 1: добавим избыток восстановителя, но не добавим лиганда Mn+ + ne = M0
Вариант 1: добавим избыток восстановителя, но не добавим лиганда Mn+ + ne = M0
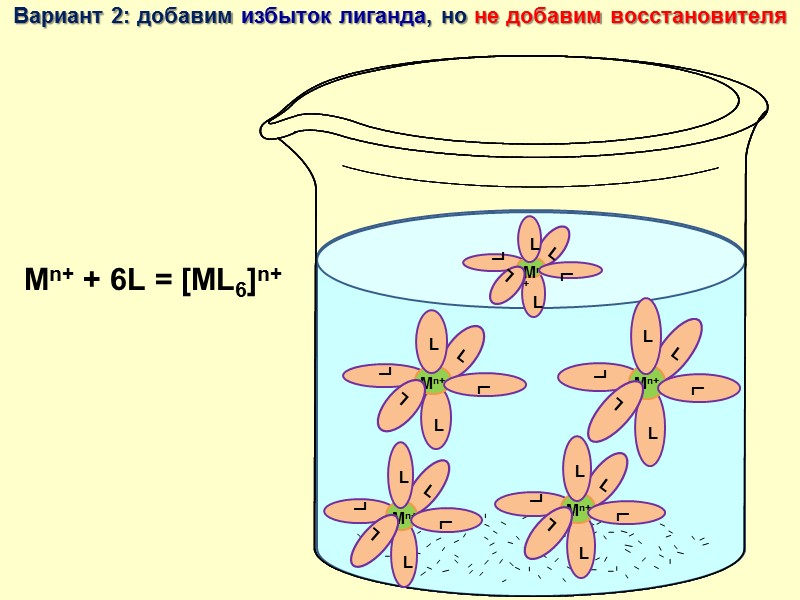
![>Вариант 2: добавим избыток лиганда, но не добавим восстановителя Mn+ + 6L = [ML6]n+ >Вариант 2: добавим избыток лиганда, но не добавим восстановителя Mn+ + 6L = [ML6]n+](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_25.jpg) Вариант 2: добавим избыток лиганда, но не добавим восстановителя Mn+ + 6L = [ML6]n+
Вариант 2: добавим избыток лиганда, но не добавим восстановителя Mn+ + 6L = [ML6]n+
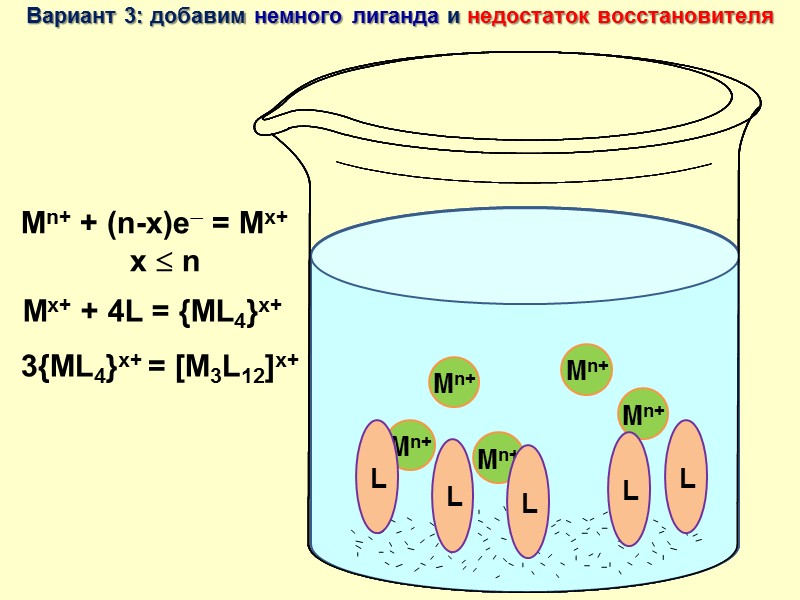
 Mn+ + (n-x)e = Mx+ x n Вариант 3: добавим немного лиганда и недостаток восстановителя Кластер!!! Mx+ + 4L = {ML4}x+ 3{ML4}x+ = [M3L12]x+
Mn+ + (n-x)e = Mx+ x n Вариант 3: добавим немного лиганда и недостаток восстановителя Кластер!!! Mx+ + 4L = {ML4}x+ 3{ML4}x+ = [M3L12]x+
 Вопросы, которые нужно решить при планировании синтеза кластера 1. Из чего исходить, чтобы получить нужные фрагменты? 2. Что есть «недостаток» восстановителя и «немного» лиганда? 3. Какие среду и условия нужно выбрать для проведения синтеза?
Вопросы, которые нужно решить при планировании синтеза кластера 1. Из чего исходить, чтобы получить нужные фрагменты? 2. Что есть «недостаток» восстановителя и «немного» лиганда? 3. Какие среду и условия нужно выбрать для проведения синтеза?
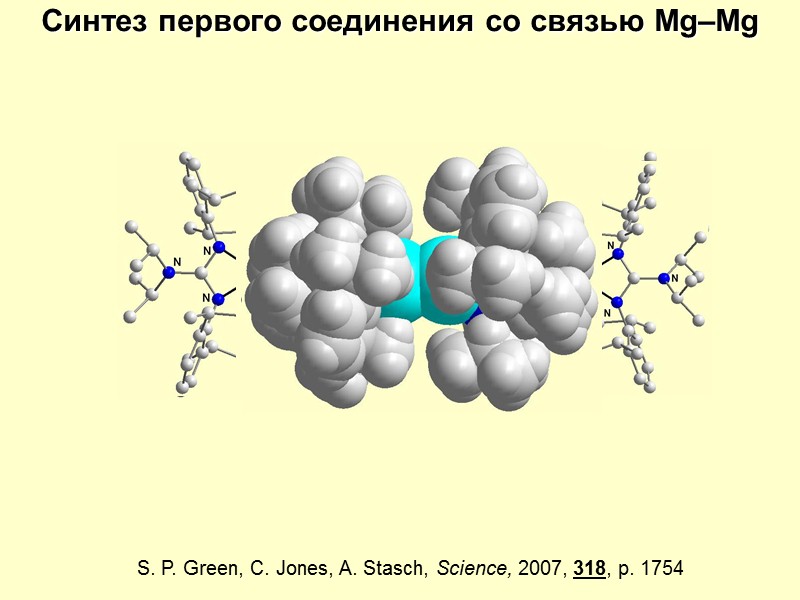
 Возможна ли связь Mg–Mg? Mg: 1s22s22p63s2 – электроны спарены, связь невозможна Mg2+: 1s22s22p63s0 – электронов нет, связь невозможна Mg1+: 1s22s22p63s1 – есть неспаренный электрон, связь возможна!!! Но как получить Mg1+ ??? 2 I-Mg-I + 2K I-Mg–Mg-I + 2KI K – e = K+ Mg2+ + e = Mg+
Возможна ли связь Mg–Mg? Mg: 1s22s22p63s2 – электроны спарены, связь невозможна Mg2+: 1s22s22p63s0 – электронов нет, связь невозможна Mg1+: 1s22s22p63s1 – есть неспаренный электрон, связь возможна!!! Но как получить Mg1+ ??? 2 I-Mg-I + 2K I-Mg–Mg-I + 2KI K – e = K+ Mg2+ + e = Mg+
 S. P. Green, C. Jones, A. Stasch, Science, 2007, 318, p. 1754 2K Синтез первого соединения со связью Mg–Mg 2KI
S. P. Green, C. Jones, A. Stasch, Science, 2007, 318, p. 1754 2K Синтез первого соединения со связью Mg–Mg 2KI
 Zn-органические соединения Методы синтеза 31
Zn-органические соединения Методы синтеза 31
![>32 Методы синтеза R2Zn – [1а], [2], [4] [1а] [4] [2] ZnCl2 + 2RLi >32 Методы синтеза R2Zn – [1а], [2], [4] [1а] [4] [2] ZnCl2 + 2RLi](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_31.jpg) 32 Методы синтеза R2Zn – [1а], [2], [4] [1а] [4] [2] ZnCl2 + 2RLi R2Zn + LiCl ZnCl2 + 2RMgX R2Zn + MgXCl 3Zn(OAc)2 + 2R3Al 3R2Zn + 2Al(OAc)3 Zn + R2Hg R2Zn + Hg C2H5I + Zn(Cu) “C2H5ZnI” + (C2H5)2Zn + ZnI2
32 Методы синтеза R2Zn – [1а], [2], [4] [1а] [4] [2] ZnCl2 + 2RLi R2Zn + LiCl ZnCl2 + 2RMgX R2Zn + MgXCl 3Zn(OAc)2 + 2R3Al 3R2Zn + 2Al(OAc)3 Zn + R2Hg R2Zn + Hg C2H5I + Zn(Cu) “C2H5ZnI” + (C2H5)2Zn + ZnI2
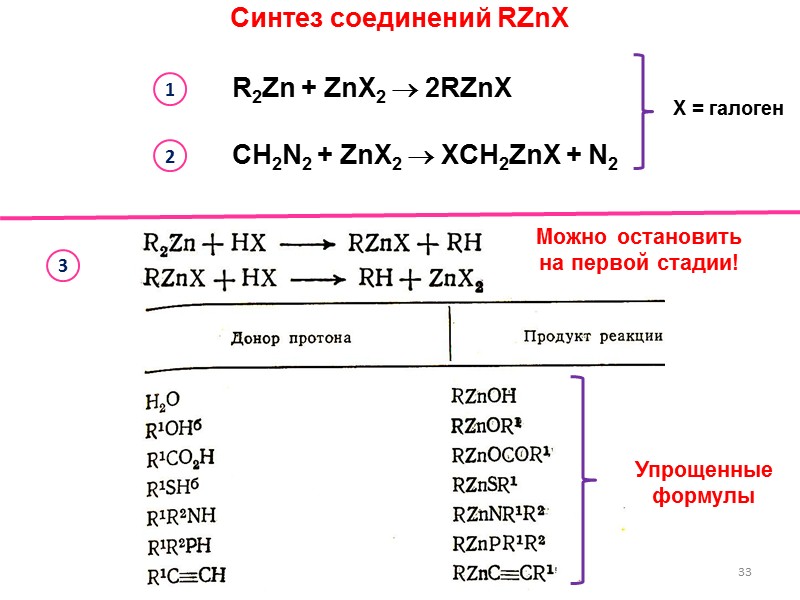
 Синтез соединений RZnX 33 Можно остановить на первой стадии! R2Zn + ZnX2 2RZnX 1 3 CH2N2 + ZnX2 XCH2ZnX + N2 2 X = галоген Упрощенные формулы
Синтез соединений RZnX 33 Можно остановить на первой стадии! R2Zn + ZnX2 2RZnX 1 3 CH2N2 + ZnX2 XCH2ZnX + N2 2 X = галоген Упрощенные формулы
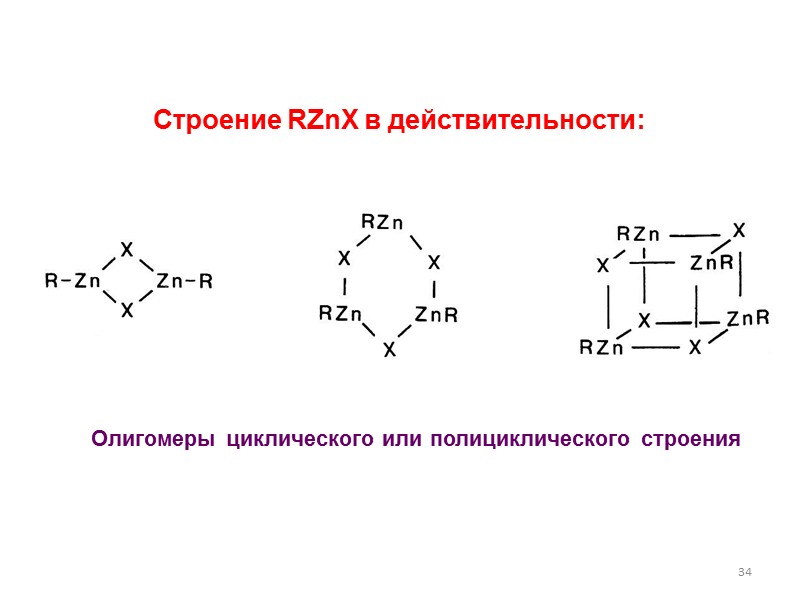
 34 Строение RZnX в действительности: Олигомеры циклического или полициклического строения
34 Строение RZnX в действительности: Олигомеры циклического или полициклического строения
 Zn-органические соединения Строение 35
Zn-органические соединения Строение 35
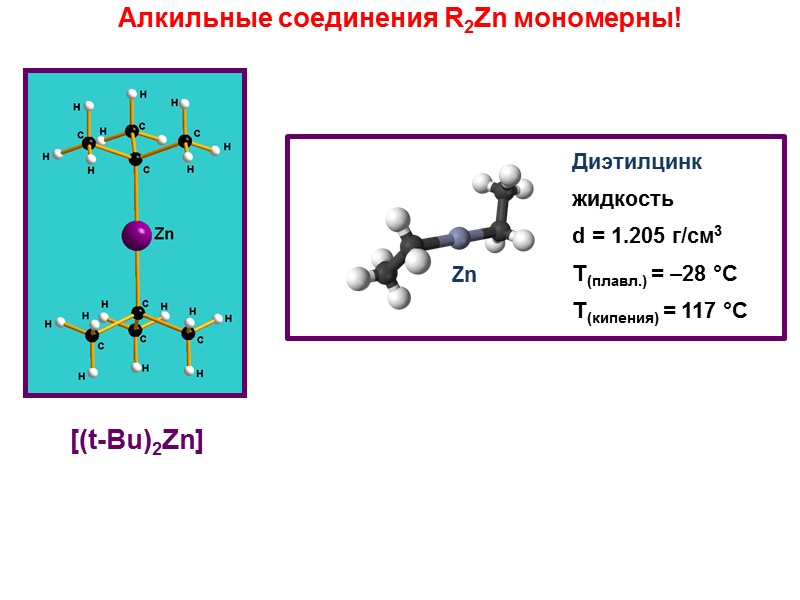
 Zn Диэтилцинк жидкость d = 1.205 г/см3 Т(плавл.) = –28 °C Т(кипения) = 117 °C Алкильные соединения R2Zn мономерны! [(t-Bu)2Zn]
Zn Диэтилцинк жидкость d = 1.205 г/см3 Т(плавл.) = –28 °C Т(кипения) = 117 °C Алкильные соединения R2Zn мономерны! [(t-Bu)2Zn]
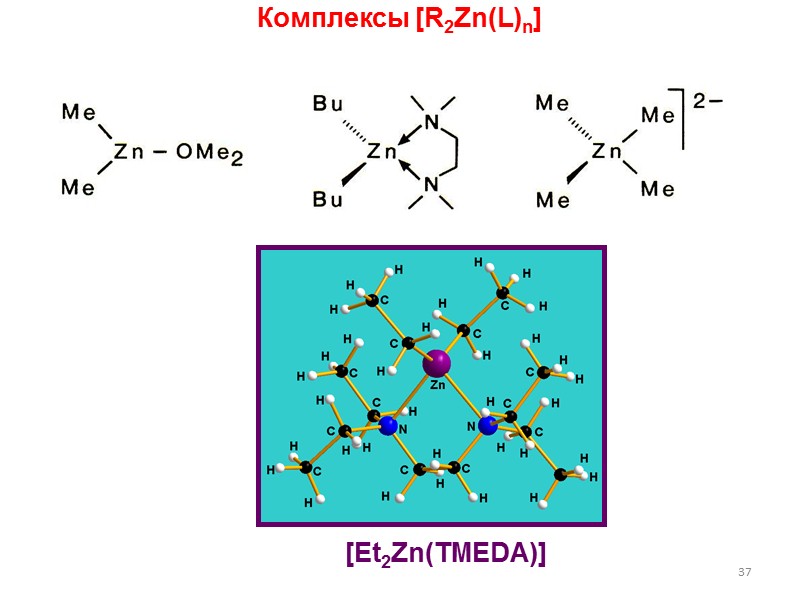
![>37 Комплексы [R2Zn(L)n] [Et2Zn(TMEDA)] >37 Комплексы [R2Zn(L)n] [Et2Zn(TMEDA)]](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_36.jpg) 37 Комплексы [R2Zn(L)n] [Et2Zn(TMEDA)]
37 Комплексы [R2Zn(L)n] [Et2Zn(TMEDA)]
 38 Арильные соединения Ar2Zn и их производные Могут быть димерными и мономерными в зависимости от природы Ar Дифенилцинк твердое в-во Т(плавл.) = 102–106 °C Т(кипения) = 280–285 °C
38 Арильные соединения Ar2Zn и их производные Могут быть димерными и мономерными в зависимости от природы Ar Дифенилцинк твердое в-во Т(плавл.) = 102–106 °C Т(кипения) = 280–285 °C
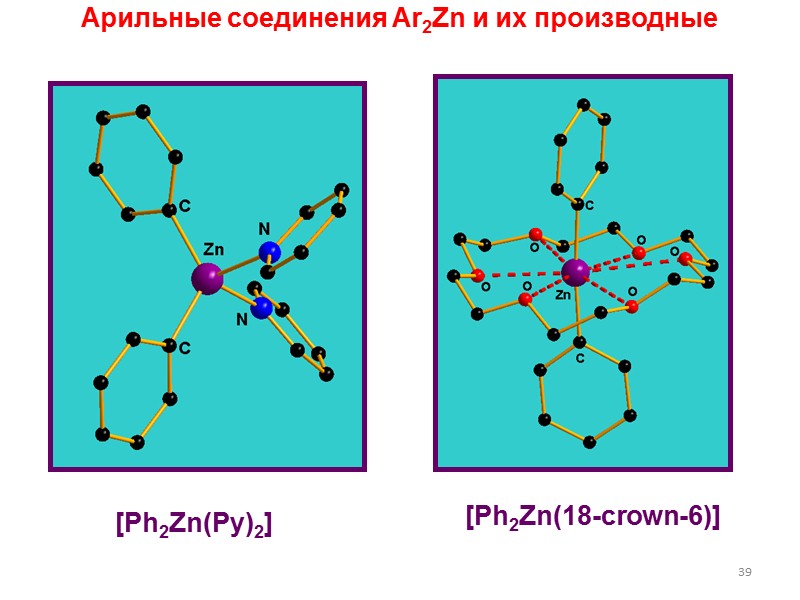
![>39 Арильные соединения Ar2Zn и их производные [Ph2Zn(Py)2] [Ph2Zn(18-crown-6)] >39 Арильные соединения Ar2Zn и их производные [Ph2Zn(Py)2] [Ph2Zn(18-crown-6)]](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_38.jpg) 39 Арильные соединения Ar2Zn и их производные [Ph2Zn(Py)2] [Ph2Zn(18-crown-6)]
39 Арильные соединения Ar2Zn и их производные [Ph2Zn(Py)2] [Ph2Zn(18-crown-6)]
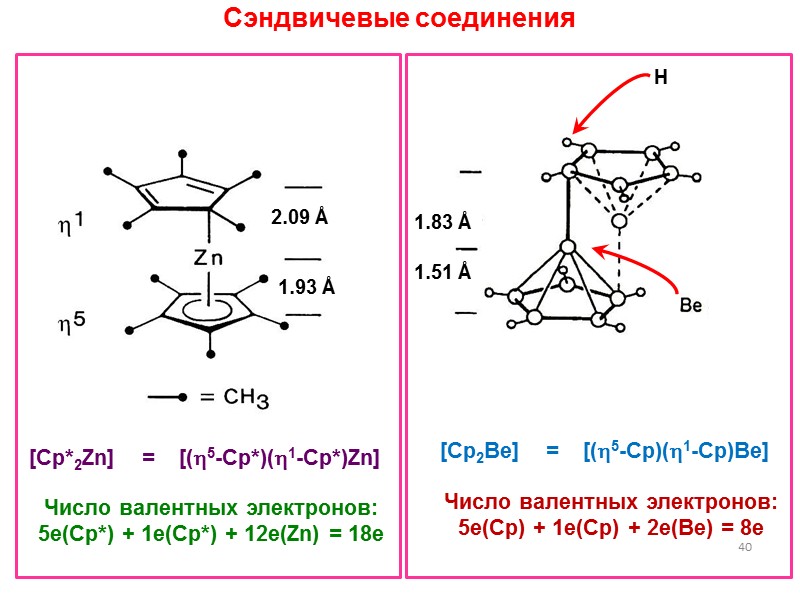
![>40 Сэндвичевые соединения [Cp*2Zn] = [(5-Cp*)(1-Cp*)Zn] Число валентных >40 Сэндвичевые соединения [Cp*2Zn] = [(5-Cp*)(1-Cp*)Zn] Число валентных](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_39.jpg) 40 Сэндвичевые соединения [Cp*2Zn] = [(5-Cp*)(1-Cp*)Zn] Число валентных электронов: 5e(Cp*) + 1e(Cp*) + 12e(Zn) = 18e 1.51 Å 1.83 Å 1.83 Å 1.83 Å H [Cp2Be] = [(5-Cp)(1-Cp)Be] Число валентных электронов: 5e(Cp) + 1e(Cp) + 2e(Be) = 8e
40 Сэндвичевые соединения [Cp*2Zn] = [(5-Cp*)(1-Cp*)Zn] Число валентных электронов: 5e(Cp*) + 1e(Cp*) + 12e(Zn) = 18e 1.51 Å 1.83 Å 1.83 Å 1.83 Å H [Cp2Be] = [(5-Cp)(1-Cp)Be] Число валентных электронов: 5e(Cp) + 1e(Cp) + 2e(Be) = 8e
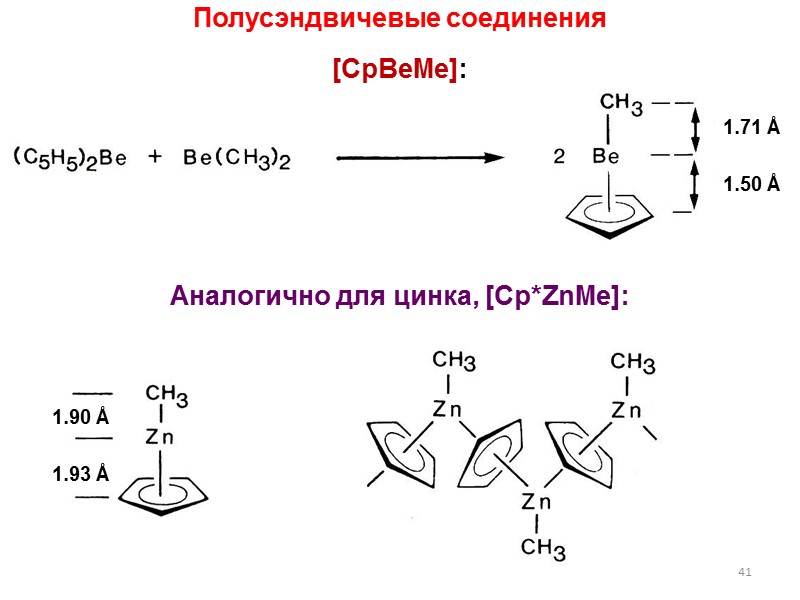
![>41 Полусэндвичевые соединения Аналогично для цинка, [Cp*ZnMe]: [CpBeMe]: 1.71 Å 1.50 Å 1.90 Å >41 Полусэндвичевые соединения Аналогично для цинка, [Cp*ZnMe]: [CpBeMe]: 1.71 Å 1.50 Å 1.90 Å](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_40.jpg) 41 Полусэндвичевые соединения Аналогично для цинка, [Cp*ZnMe]: [CpBeMe]: 1.71 Å 1.50 Å 1.90 Å 1.93 Å
41 Полусэндвичевые соединения Аналогично для цинка, [Cp*ZnMe]: [CpBeMe]: 1.71 Å 1.50 Å 1.90 Å 1.93 Å
 42 Декаметилдицинкоцен – первое соединение со связью Zn–Zn I.Resa, E. Carmona, E.Gutierrez-Puebla, A.Monge , Science, 2004, 305, p. 1136 d(Zn–Zn) = 2.30 Å, d(Zn–центр кольца) = 2.04 Å, Для сравнения: d(Zn–центр кольца) = 1.93 Å в [Cp*2Zn] и [Cp*ZnCH3]
42 Декаметилдицинкоцен – первое соединение со связью Zn–Zn I.Resa, E. Carmona, E.Gutierrez-Puebla, A.Monge , Science, 2004, 305, p. 1136 d(Zn–Zn) = 2.30 Å, d(Zn–центр кольца) = 2.04 Å, Для сравнения: d(Zn–центр кольца) = 1.93 Å в [Cp*2Zn] и [Cp*ZnCH3]
 Zn-органические соединения Реакции 43
Zn-органические соединения Реакции 43
 44 Реакция с гидридом цинка
44 Реакция с гидридом цинка
 45 «Мягкое» замещение галогенов В отличие от литий- и магнийорганики реакция протекает «чисто», не приводит к смеси продуктов разной степени замещения
45 «Мягкое» замещение галогенов В отличие от литий- и магнийорганики реакция протекает «чисто», не приводит к смеси продуктов разной степени замещения
 46 Реакция Реформатского превращение α-галоген-замещенных сложных эфиров в -гидроксо-замещенные сложные эфиры с наращиванием углеродной цепи Аналогия: RMgX + R’2C=O RR’2C–OMgX RR’2C–OMgX + H+ RR’2C–OH Для реакции может быть использован цинк Рике.
46 Реакция Реформатского превращение α-галоген-замещенных сложных эфиров в -гидроксо-замещенные сложные эфиры с наращиванием углеродной цепи Аналогия: RMgX + R’2C=O RR’2C–OMgX RR’2C–OMgX + H+ RR’2C–OH Для реакции может быть использован цинк Рике.
 47 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля (Knochel ) Преимущества цинкорганических соединений: могут быть получены с очень большим набором функциональных групп! Соль [CuCN2LiX] может быть использована в каталитических кол-вах. [CuCN2LiX], в отличие от CuCN, прилично растворяется в ТГФ. Строение FGR–Cu(CN)ZnX2LiX не установлено, но методика работает.
47 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля (Knochel ) Преимущества цинкорганических соединений: могут быть получены с очень большим набором функциональных групп! Соль [CuCN2LiX] может быть использована в каталитических кол-вах. [CuCN2LiX], в отличие от CuCN, прилично растворяется в ТГФ. Строение FGR–Cu(CN)ZnX2LiX не установлено, но методика работает.
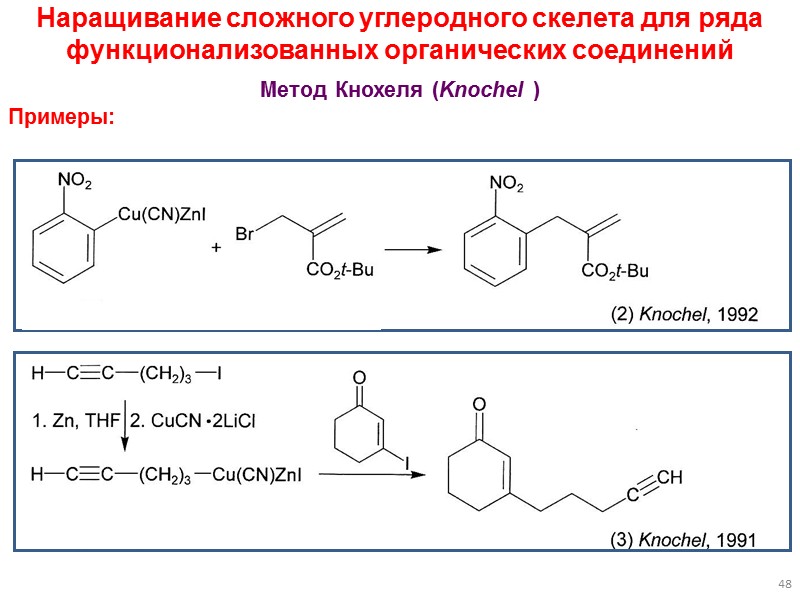
 48 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля (Knochel ) Примеры:
48 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля (Knochel ) Примеры:
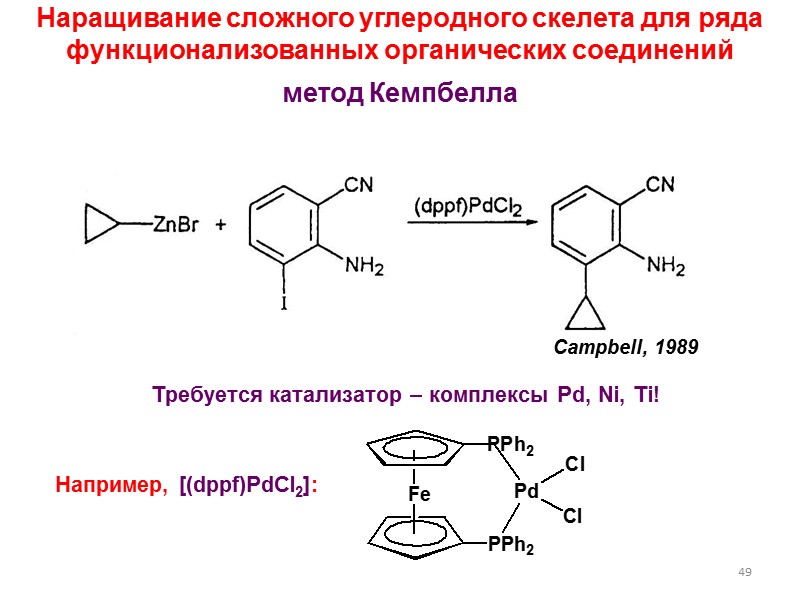
 49 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений метод Кемпбелла Требуется катализатор – комплексы Pd, Ni, Ti! Например, [(dppf)PdCl2]:
49 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений метод Кемпбелла Требуется катализатор – комплексы Pd, Ni, Ti! Например, [(dppf)PdCl2]:
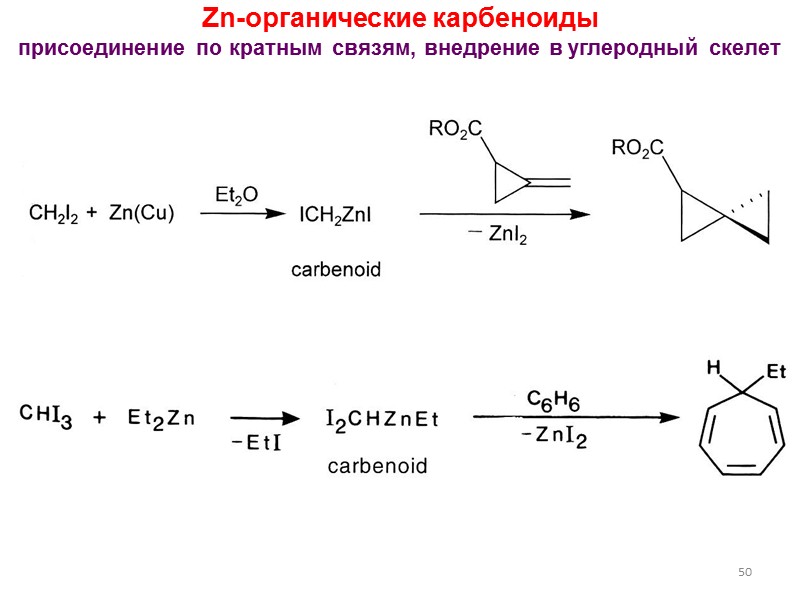
 50 Zn-органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет
50 Zn-органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет
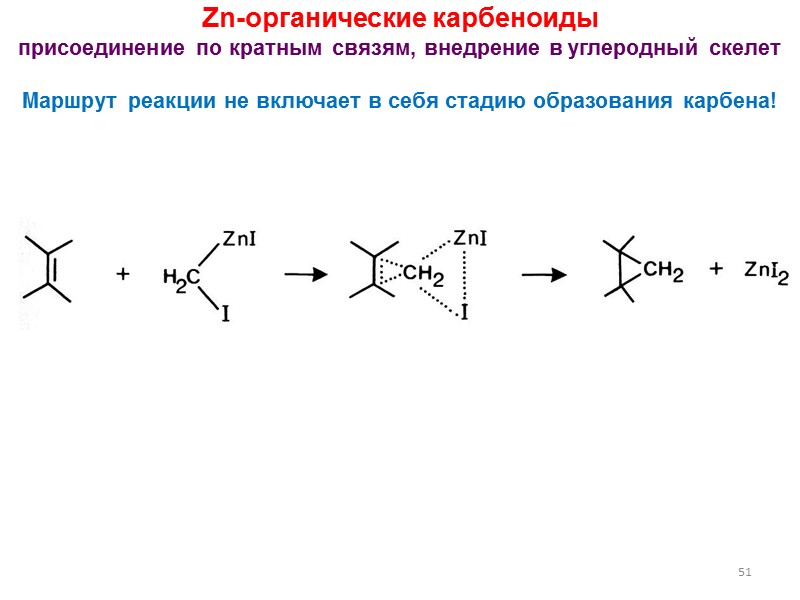
 51 Zn-органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции не включает в себя стадию образования карбена!
51 Zn-органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции не включает в себя стадию образования карбена!
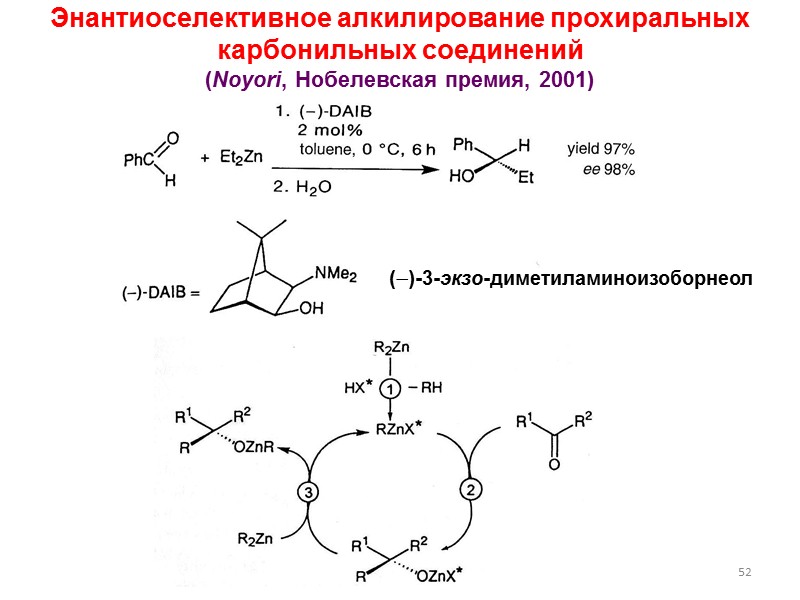
 52 ()-3-экзо-диметиламиноизоборнеол Энантиоселективное алкилирование прохиральных карбонильных соединений (Noyori, Нобелевская премия, 2001)
52 ()-3-экзо-диметиламиноизоборнеол Энантиоселективное алкилирование прохиральных карбонильных соединений (Noyori, Нобелевская премия, 2001)
 53 Hg-органические соединения Синтез, строение и свойства
53 Hg-органические соединения Синтез, строение и свойства
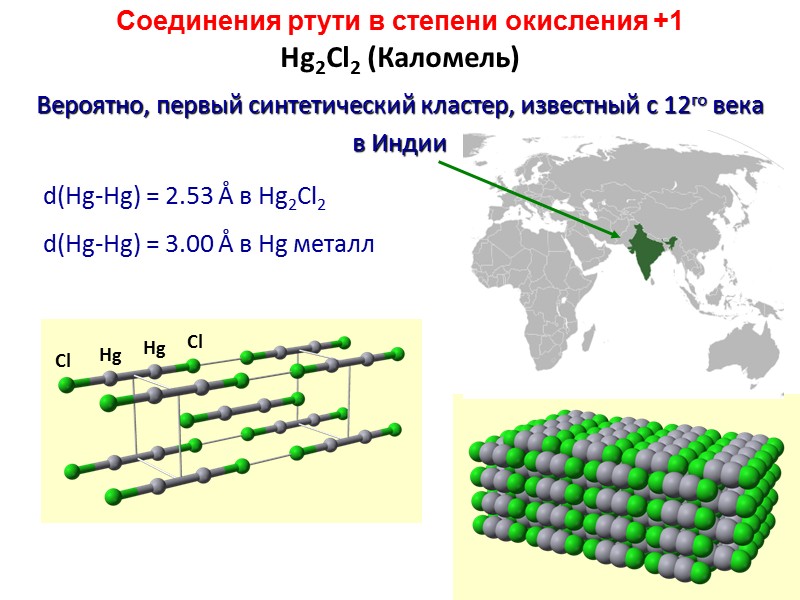
 Hg2Cl2 (Каломель) Вероятно, первый синтетический кластер, известный с 12го века в Индии d(Hg-Hg) = 2.53 Å в Hg2Cl2 d(Hg-Hg) = 3.00 Å в Hg металл Соединения ртути в степени окисления +1
Hg2Cl2 (Каломель) Вероятно, первый синтетический кластер, известный с 12го века в Индии d(Hg-Hg) = 2.53 Å в Hg2Cl2 d(Hg-Hg) = 3.00 Å в Hg металл Соединения ртути в степени окисления +1
 55 Металлоорганические соединения ртути в степени окисления +1 По сути, отсутстствуют! Соединение типа R–Hg–Hg–R надежно охарактеризовано только одно: R = Si(SiMe2SiMe3)3 (Apeloig, 1999)
55 Металлоорганические соединения ртути в степени окисления +1 По сути, отсутстствуют! Соединение типа R–Hg–Hg–R надежно охарактеризовано только одно: R = Si(SiMe2SiMe3)3 (Apeloig, 1999)
![>56 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr солнечный свет (история) [1а] >56 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr солнечный свет (история) [1а]](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_55.jpg) 56 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr солнечный свет (история) [1а] [1б] Металлоорганические соединения ртути в степени окисления +2 [12] [4]
56 2Na + Hg + 2CH3Br (CH3)2Hg + 2NaBr солнечный свет (история) [1а] [1б] Металлоорганические соединения ртути в степени окисления +2 [12] [4]
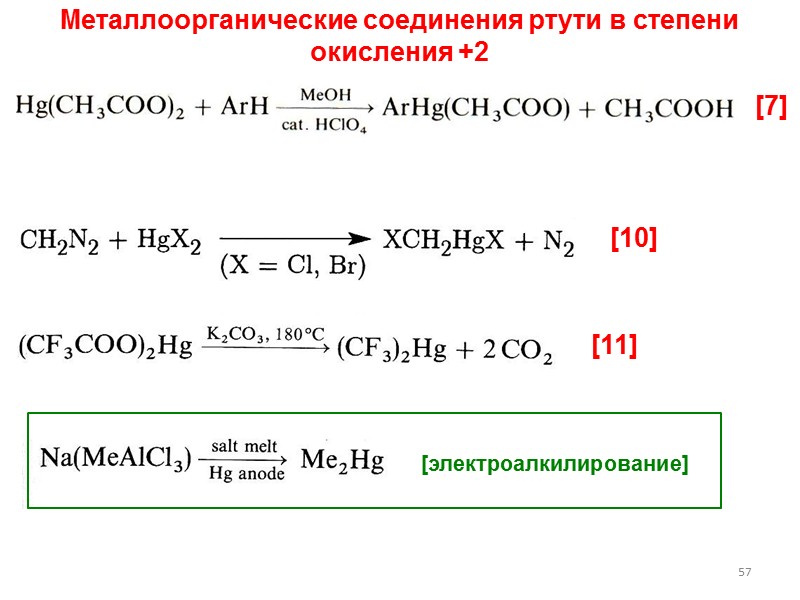
![>57 [7] [10] [11] [электроалкилирование] Металлоорганические соединения ртути в степени окисления +2 >57 [7] [10] [11] [электроалкилирование] Металлоорганические соединения ртути в степени окисления +2](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_56.jpg) 57 [7] [10] [11] [электроалкилирование] Металлоорганические соединения ртути в степени окисления +2
57 [7] [10] [11] [электроалкилирование] Металлоорганические соединения ртути в степени окисления +2
 58 Свойства связи Hg–C, общие свойства R2Hg и RHgX Связь Hg–C практически неполярна. Соединения R2Hg и RHgX абсолютно устойчивы к воде и кислороду воздуха. Легкость восстановления Hg(II) до Hg(0) обеспечивает легкость трансметаллирования.
58 Свойства связи Hg–C, общие свойства R2Hg и RHgX Связь Hg–C практически неполярна. Соединения R2Hg и RHgX абсолютно устойчивы к воде и кислороду воздуха. Легкость восстановления Hg(II) до Hg(0) обеспечивает легкость трансметаллирования.
 59 (CH3)2Hg CH3Hg + CH3 D1(Hg – C) = 214 кДж/моль (CH3)Hg Hg + CH3 D2(Hg – C) = 29 кДж/моль Применение: генерация свободных углеводородных радикалов Металлоорганические соединения ртути в степени окисления +2
59 (CH3)2Hg CH3Hg + CH3 D1(Hg – C) = 214 кДж/моль (CH3)Hg Hg + CH3 D2(Hg – C) = 29 кДж/моль Применение: генерация свободных углеводородных радикалов Металлоорганические соединения ртути в степени окисления +2
 60 Свойства связи Hg–C, общие свойства R2Hg и RHgX В R2Hg у ртути практически отсутствуют свойства кислоты Льюиса: известны комплексы с дополнительными лигандами только для R = сильный акцептор (CF3, например) [(CF3)2Hg(dppe)] (dppe = Ph2PCH2CH2PPh2) Координация лигандов к атому ртути в RHgX приводит к «диспропорционированию»:
60 Свойства связи Hg–C, общие свойства R2Hg и RHgX В R2Hg у ртути практически отсутствуют свойства кислоты Льюиса: известны комплексы с дополнительными лигандами только для R = сильный акцептор (CF3, например) [(CF3)2Hg(dppe)] (dppe = Ph2PCH2CH2PPh2) Координация лигандов к атому ртути в RHgX приводит к «диспропорционированию»:
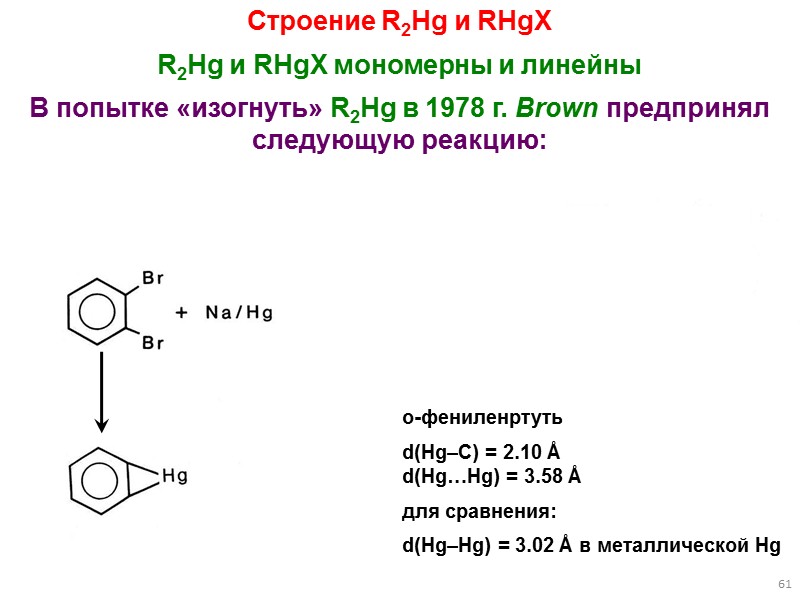
 61 Строение R2Hg и RHgX R2Hg и RHgX мономерны и линейны В попытке «изогнуть» R2Hg в 1978 г. Brown предпринял следующую реакцию: о-фениленртуть d(Hg–C) = 2.10 Å d(Hg…Hg) = 3.58 Å для сравнения: d(Hg–Hg) = 3.02 Å в металлической Hg
61 Строение R2Hg и RHgX R2Hg и RHgX мономерны и линейны В попытке «изогнуть» R2Hg в 1978 г. Brown предпринял следующую реакцию: о-фениленртуть d(Hg–C) = 2.10 Å d(Hg…Hg) = 3.58 Å для сравнения: d(Hg–Hg) = 3.02 Å в металлической Hg
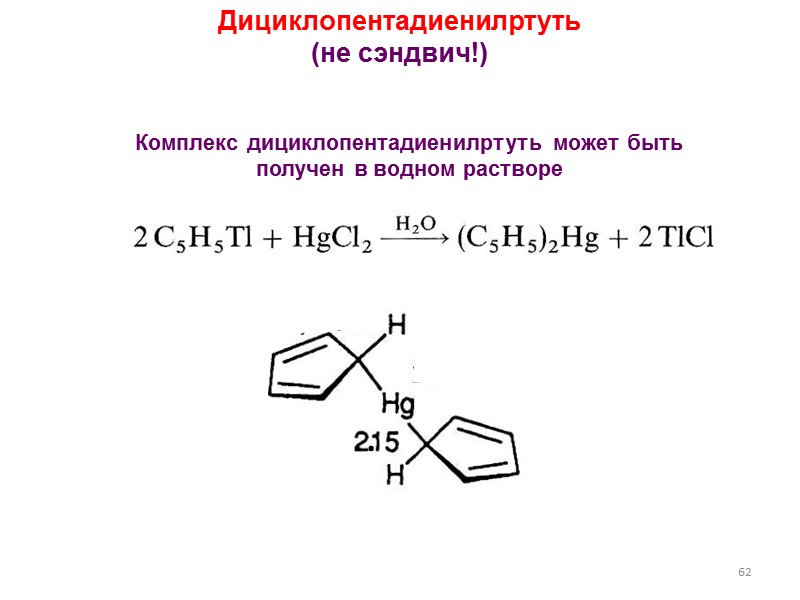
 62 Дициклопентадиенилртуть (не сэндвич!) Комплекс дициклопентадиенилртуть может быть получен в водном растворе
62 Дициклопентадиенилртуть (не сэндвич!) Комплекс дициклопентадиенилртуть может быть получен в водном растворе
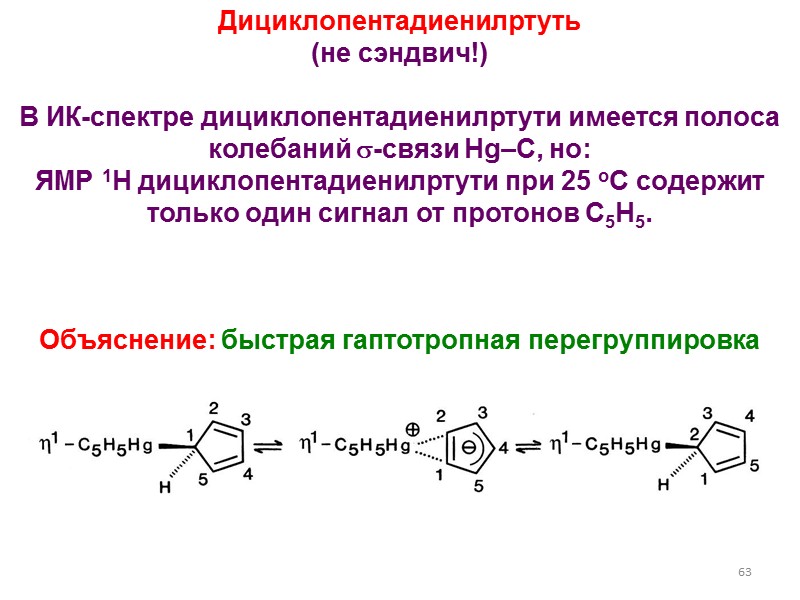
 63 Дициклопентадиенилртуть (не сэндвич!) В ИК-спектре дициклопентадиенилртути имеется полоса колебаний -связи Hg–C, но: ЯМР 1H дициклопентадиенилртути при 25 оС содержит только один сигнал от протонов C5H5. Объяснение: быстрая гаптотропная перегруппировка
63 Дициклопентадиенилртуть (не сэндвич!) В ИК-спектре дициклопентадиенилртути имеется полоса колебаний -связи Hg–C, но: ЯМР 1H дициклопентадиенилртути при 25 оС содержит только один сигнал от протонов C5H5. Объяснение: быстрая гаптотропная перегруппировка
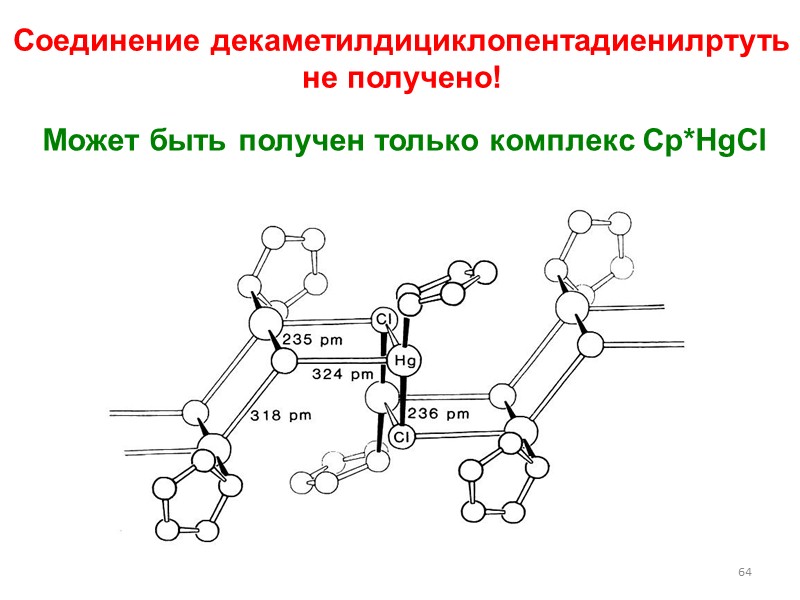
 64 Соединение декаметилдициклопентадиенилртуть не получено! Может быть получен только комплекс Cp*HgCl
64 Соединение декаметилдициклопентадиенилртуть не получено! Может быть получен только комплекс Cp*HgCl
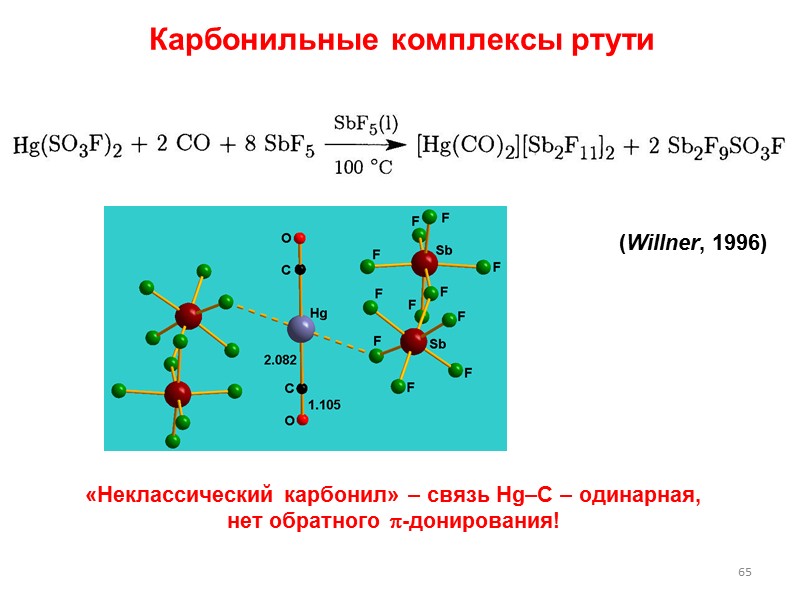
 65 Карбонильные комплексы ртути (Willner, 1996) «Неклассический карбонил» – связь Hg–C – одинарная, нет обратного -донирования!
65 Карбонильные комплексы ртути (Willner, 1996) «Неклассический карбонил» – связь Hg–C – одинарная, нет обратного -донирования!
![>66 Немного подробнее о меркурировании Электрофильное замещение H+ на [Hg(OAc)]+ кроме аренов могут >66 Немного подробнее о меркурировании Электрофильное замещение H+ на [Hg(OAc)]+ кроме аренов могут](https://present5.com/presentacii/20170502/lectures_4_5.ppt_images/lectures_4_5.ppt_65.jpg) 66 Немного подробнее о меркурировании Электрофильное замещение H+ на [Hg(OAc)]+ кроме аренов могут реагировать алкины, нитроалканы, 1,3-дикетоны т.е. соединения с достаточной C–H кислотностью Катализ хлорной кислотой:
66 Немного подробнее о меркурировании Электрофильное замещение H+ на [Hg(OAc)]+ кроме аренов могут реагировать алкины, нитроалканы, 1,3-дикетоны т.е. соединения с достаточной C–H кислотностью Катализ хлорной кислотой:
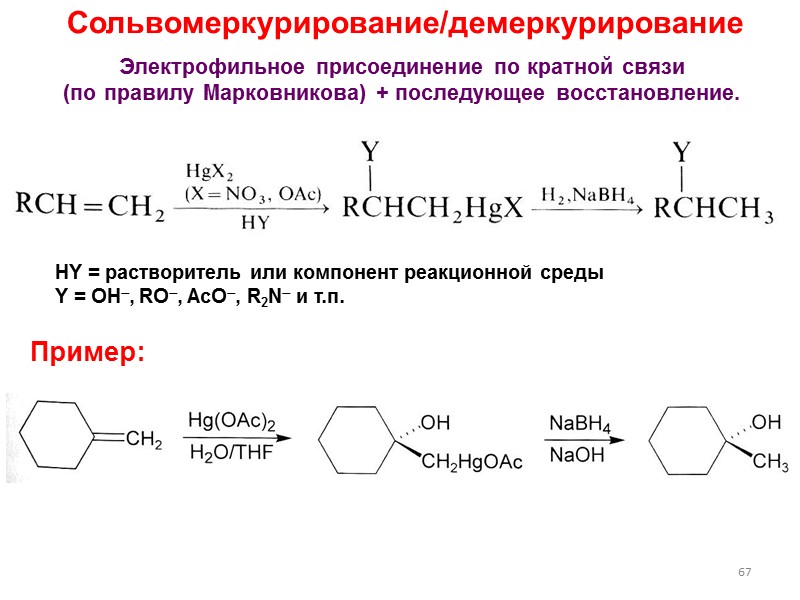
 67 Сольвомеркурирование/демеркурирование HY = растворитель или компонент реакционной среды Y = OH, RO, AcO, R2N и т.п. Электрофильное присоединение по кратной связи (по правилу Марковникова) + последующее восстановление. Пример:
67 Сольвомеркурирование/демеркурирование HY = растворитель или компонент реакционной среды Y = OH, RO, AcO, R2N и т.п. Электрофильное присоединение по кратной связи (по правилу Марковникова) + последующее восстановление. Пример:
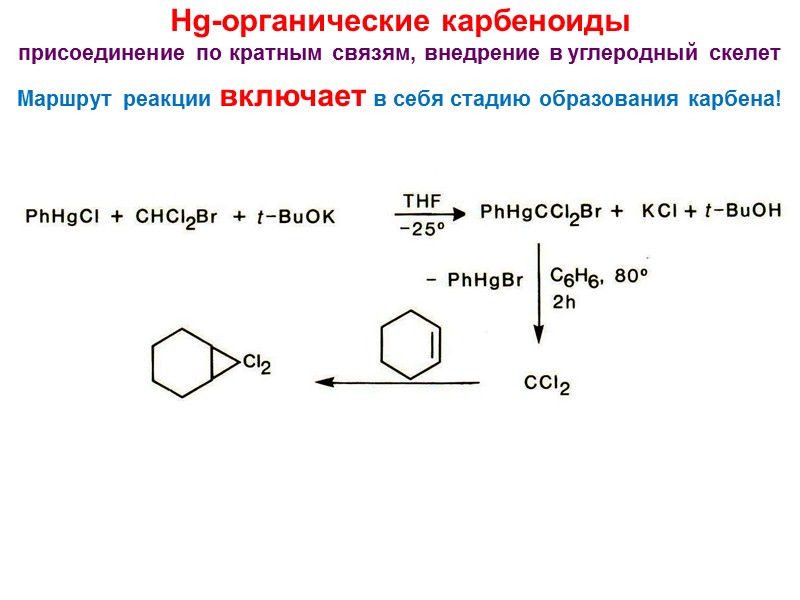
 Hg-органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции включает в себя стадию образования карбена!
Hg-органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции включает в себя стадию образования карбена!
 69 69 Hg-органические карбеноиды Циклопропанирование Реакция протекает в мягких условиях, но есть «но»: Нельзя использовать алкены (-ины) с группировками –COOH, –OH и –NR2 Промежуточный продукт PhHgCX2X’ не может быть использован “in situ”, он должен быть выделен
69 69 Hg-органические карбеноиды Циклопропанирование Реакция протекает в мягких условиях, но есть «но»: Нельзя использовать алкены (-ины) с группировками –COOH, –OH и –NR2 Промежуточный продукт PhHgCX2X’ не может быть использован “in situ”, он должен быть выделен
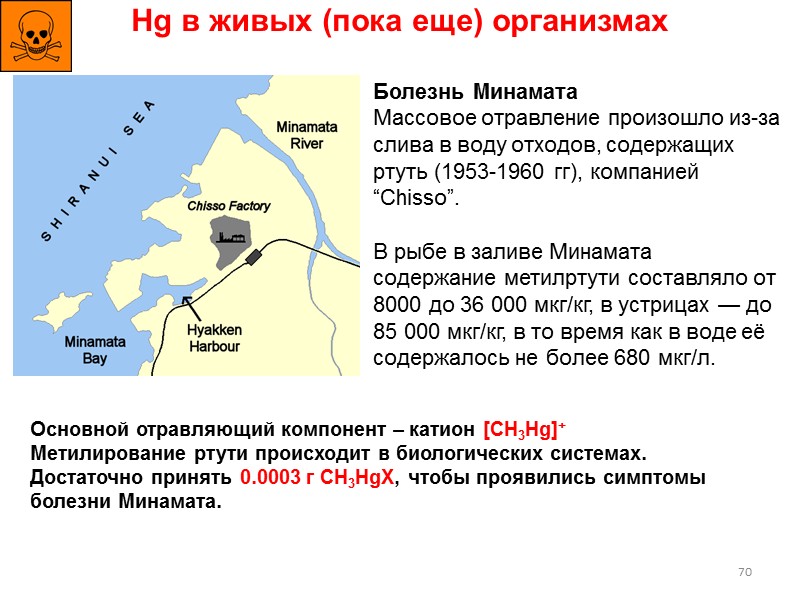
 70 Hg в живых (пока еще) организмах Болезнь Минамата Массовое отравление произошло из-за слива в воду отходов, содержащих ртуть (1953-1960 гг), компанией “Chisso”. В рыбе в заливе Минамата содержание метилртути составляло от 8000 до 36 000 мкг/кг, в устрицах — до 85 000 мкг/кг, в то время как в воде её содержалось не более 680 мкг/л. Основной отравляющий компонент – катион [CH3Hg]+ Метилирование ртути происходит в биологических системах. Достаточно принять 0.0003 г CH3HgX, чтобы проявились симптомы болезни Минамата.
70 Hg в живых (пока еще) организмах Болезнь Минамата Массовое отравление произошло из-за слива в воду отходов, содержащих ртуть (1953-1960 гг), компанией “Chisso”. В рыбе в заливе Минамата содержание метилртути составляло от 8000 до 36 000 мкг/кг, в устрицах — до 85 000 мкг/кг, в то время как в воде её содержалось не более 680 мкг/л. Основной отравляющий компонент – катион [CH3Hg]+ Метилирование ртути происходит в биологических системах. Достаточно принять 0.0003 г CH3HgX, чтобы проявились симптомы болезни Минамата.
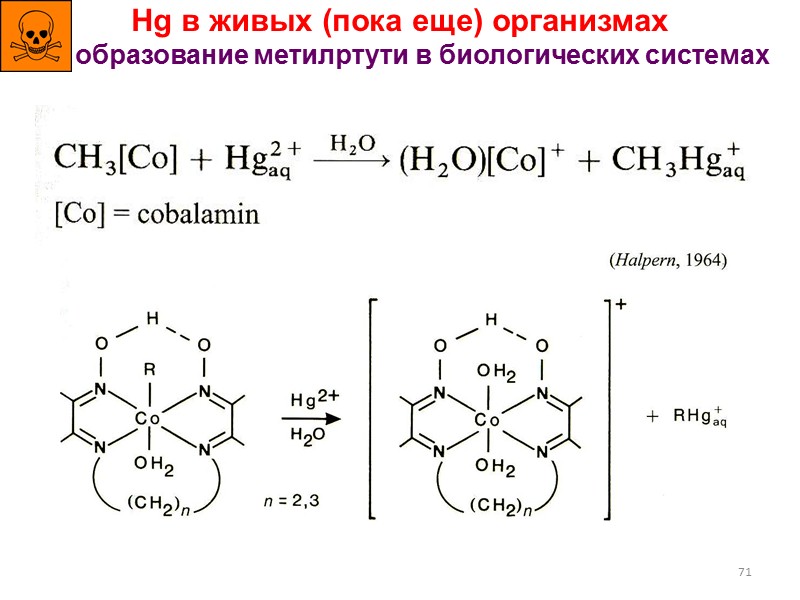
 71 Hg в живых (пока еще) организмах образование метилртути в биологических системах
71 Hg в живых (пока еще) организмах образование метилртути в биологических системах
 72 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему
72 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему
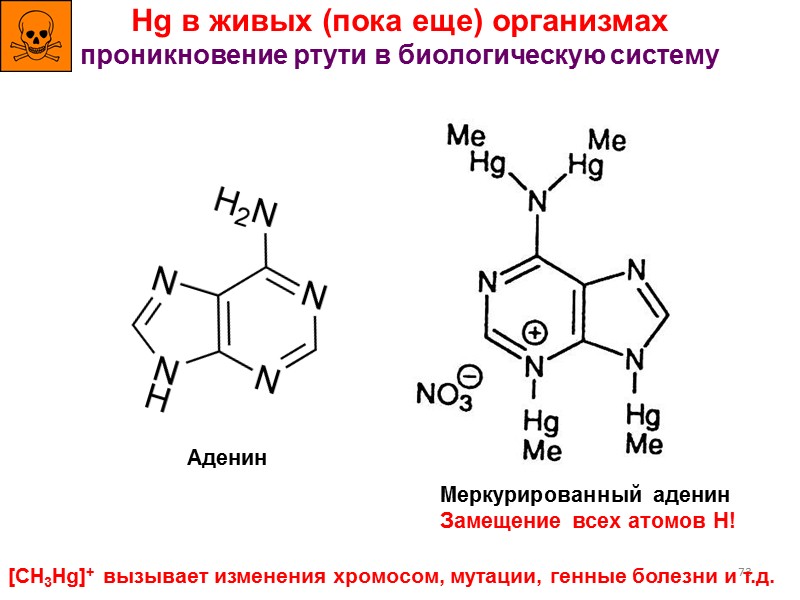
 73 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему Аденин Меркурированный аденин Замещение всех атомов H! [CH3Hg]+ вызывает изменения хромосом, мутации, генные болезни и т.д.
73 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему Аденин Меркурированный аденин Замещение всех атомов H! [CH3Hg]+ вызывает изменения хромосом, мутации, генные болезни и т.д.
 74 Hg в живых (пока еще) организмах Диметилртуть Hg(CH3)2 В 1997 году зафиксирован случай, когда после попадания нескольких капель Me2Hg на руки исследователя, он внезапно умер через 10 месяцев! Me2Hg проникает сквозь латексные перчатки! При попадании Me2Hg на перчатки, до кожи она добирается в течение нескольких секунд! Если кто-то по соседству начнет заниматься ртутьорганикой, сообщите заранее, чтоб успеть уехать подальше!
74 Hg в живых (пока еще) организмах Диметилртуть Hg(CH3)2 В 1997 году зафиксирован случай, когда после попадания нескольких капель Me2Hg на руки исследователя, он внезапно умер через 10 месяцев! Me2Hg проникает сквозь латексные перчатки! При попадании Me2Hg на перчатки, до кожи она добирается в течение нескольких секунд! Если кто-то по соседству начнет заниматься ртутьорганикой, сообщите заранее, чтоб успеть уехать подальше!
