1 Лекция «Буферные растворы Кафедра общей и















![28]PONa. H[ ]HPONa[ lg 21, 736, 7 42 42 ]кислота[ ]соль[ lg 15, 0 28]PONa. H[ ]HPONa[ lg 21, 736, 7 42 42 ]кислота[ ]соль[ lg 15, 0](http://present5.com/presentforday2/20161222/4.0_bufery_images/4.0_bufery_27.jpg)





![362 3 p. СO ][HCO lg 11, 6 p. H Уравнение Гендерсона-Гассельбаха (для расчета 362 3 p. СO ][HCO lg 11, 6 p. H Уравнение Гендерсона-Гассельбаха (для расчета](http://present5.com/presentforday2/20161222/4.0_bufery_images/4.0_bufery_35.jpg)

















4.0_bufery.ppt
- Размер: 4.4 Мб
- Автор:
- Количество слайдов: 63
Описание презентации 1 Лекция «Буферные растворы Кафедра общей и по слайдам
 1 Лекция «Буферные растворы Кафедра общей и медицинской химии
1 Лекция «Буферные растворы Кафедра общей и медицинской химии
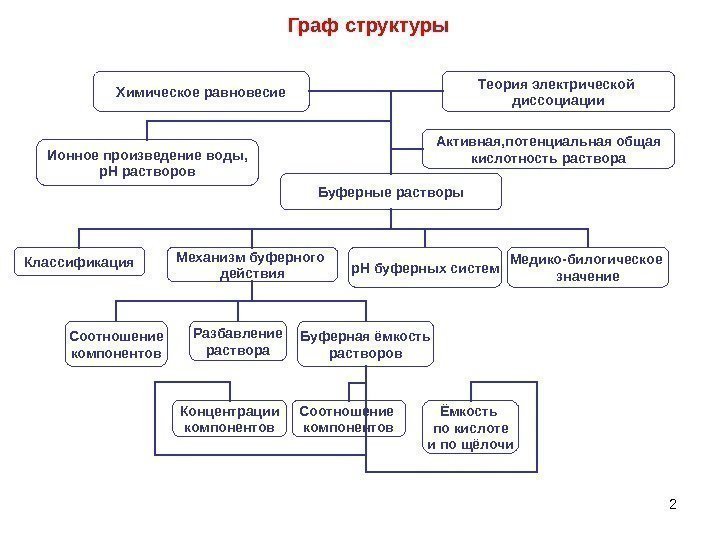
 2 Граф структуры Химическое равновесие Теория электрической диссоциации Буферные растворы Классификация Механизм буферного действия. Ионное произведение воды, р. Н растворов Активная, потенциальная общая кислотность раствора Буферная ёмкость растворов. Разбавление раствора. Соотношение компонентов р. Н буферных систем Медико-билогическое значение Соотношение компонентов. Концентрации компонентов Ёмкость по кислоте и по щёлочи
2 Граф структуры Химическое равновесие Теория электрической диссоциации Буферные растворы Классификация Механизм буферного действия. Ионное произведение воды, р. Н растворов Активная, потенциальная общая кислотность раствора Буферная ёмкость растворов. Разбавление раствора. Соотношение компонентов р. Н буферных систем Медико-билогическое значение Соотношение компонентов. Концентрации компонентов Ёмкость по кислоте и по щёлочи
 3 Теории кислот и оснований
3 Теории кислот и оснований
 4 1. По Аррениусу: Нобелевская премия по химии «как факт признания особого значения его теории электролитической диссоциации для развития химии» . Сванте Аррениус (19. 02. 1859 — 2. 10. 1927) Кислоты — электролиты, диссоциирующие в растворах с образованием ионов Н + ; Основания — электролиты, диссоциирующие в растворах с образованием гидроксид-ионов ОН — ; Амфолиты — (амфотерные гидроксиды) электролиты, диссоциирующие в растворах с образованием как водород-ионов Н + , так и гидроксид-ионов ОН —
4 1. По Аррениусу: Нобелевская премия по химии «как факт признания особого значения его теории электролитической диссоциации для развития химии» . Сванте Аррениус (19. 02. 1859 — 2. 10. 1927) Кислоты — электролиты, диссоциирующие в растворах с образованием ионов Н + ; Основания — электролиты, диссоциирующие в растворах с образованием гидроксид-ионов ОН — ; Амфолиты — (амфотерные гидроксиды) электролиты, диссоциирующие в растворах с образованием как водород-ионов Н + , так и гидроксид-ионов ОН —
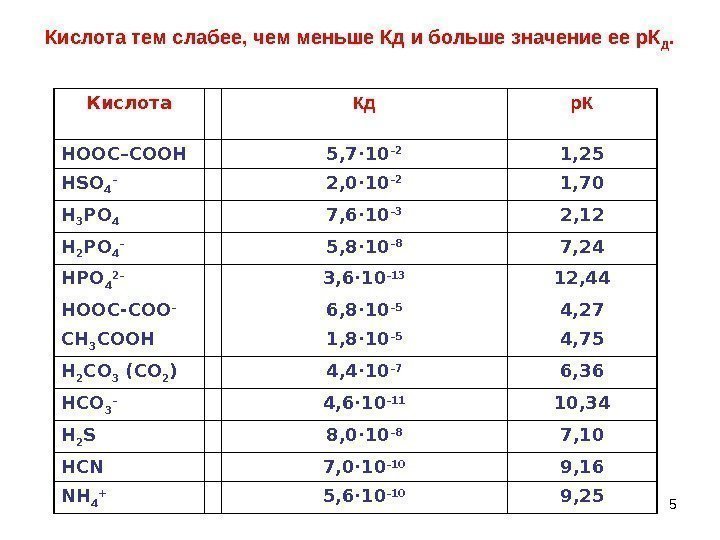
 5 Кислота тем слабее, чем меньше Кд и больше значение ее р. К Д. Кислота Кд р. К НООС–СООН 5, 7· 10 – 2 1, 25 HSO 4 – 2, 0 · 10 – 2 1, 70 Н 3 РО 4 7, 6 · 10 – 3 2, 12 Н 2 РО 4 – 5, 8 · 10 – 8 7, 24 HPO 4 2– 3, 6 · 10 – 13 12, 44 HOOC-COO – 6, 8 · 10 – 5 4, 27 СН 3 СООН 1, 8 · 10 – 5 4, 75 Н 2 СО 3 (СО 2 ) 4, 4 · 10 – 7 6, 36 HCO 3 – 4, 6 · 10 – 11 10, 34 H 2 S 8, 0 · 10 – 8 7, 10 HCN 7, 0 · 10 – 10 9, 16 NH 4 + 5, 6 · 10 – 10 9,
5 Кислота тем слабее, чем меньше Кд и больше значение ее р. К Д. Кислота Кд р. К НООС–СООН 5, 7· 10 – 2 1, 25 HSO 4 – 2, 0 · 10 – 2 1, 70 Н 3 РО 4 7, 6 · 10 – 3 2, 12 Н 2 РО 4 – 5, 8 · 10 – 8 7, 24 HPO 4 2– 3, 6 · 10 – 13 12, 44 HOOC-COO – 6, 8 · 10 – 5 4, 27 СН 3 СООН 1, 8 · 10 – 5 4, 75 Н 2 СО 3 (СО 2 ) 4, 4 · 10 – 7 6, 36 HCO 3 – 4, 6 · 10 – 11 10, 34 H 2 S 8, 0 · 10 – 8 7, 10 HCN 7, 0 · 10 – 10 9, 16 NH 4 + 5, 6 · 10 – 10 9,
 6 Недостатки C Н 3 СООН в воде – слабая кислота: CH 3 COOH ↔ CH 3 COO — + H + в жидком HF – основание: HF + CH 3 COOH ↔ CH 3 COOH 2 + + F — Исследования подобного типа реакций и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, в других – как основания.
6 Недостатки C Н 3 СООН в воде – слабая кислота: CH 3 COOH ↔ CH 3 COO — + H + в жидком HF – основание: HF + CH 3 COOH ↔ CH 3 COOH 2 + + F — Исследования подобного типа реакций и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, в других – как основания.
 7 2. По Бренстеду: БРЕНСТЕД Йоханнес ( 22. 11 1879 – 17. 12 1947) Кислота (донор протонов ) — вещество, молекулярные частицы или ионы которого, способны отдавать протоны Основание ( акцептор протонов. ) — вещество, молекулярные частицы или ионы которого, способны присоединять протоны
7 2. По Бренстеду: БРЕНСТЕД Йоханнес ( 22. 11 1879 – 17. 12 1947) Кислота (донор протонов ) — вещество, молекулярные частицы или ионы которого, способны отдавать протоны Основание ( акцептор протонов. ) — вещество, молекулярные частицы или ионы которого, способны присоединять протоны
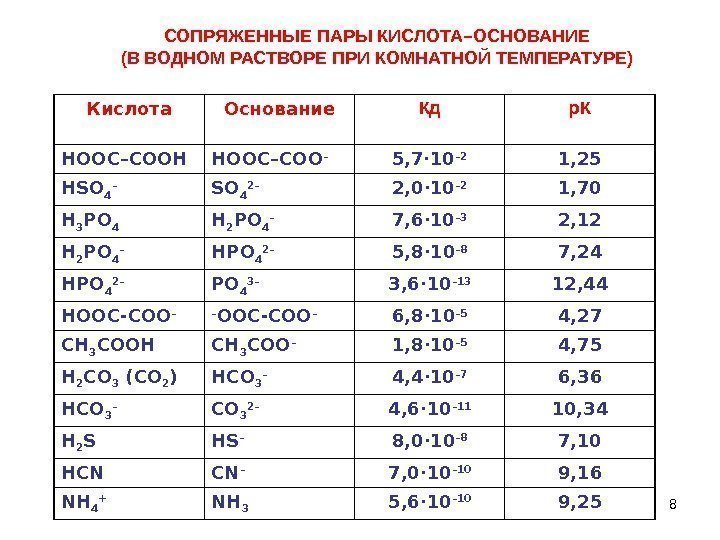
 8 СОПРЯЖЕННЫЕ ПАРЫ КИСЛОТА–ОСНОВАНИЕ (В ВОДНОМ РАСТВОРЕ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ) Кислота Основание Кд р. К НООС–СООН НООС–СОО – 5, 7· 10 – 2 1, 25 HSO 4 – SO 4 2– 2, 0 · 10 – 2 1, 70 Н 3 РО 4 H 2 PO 4 – 7, 6 · 10 – 3 2, 12 Н 2 РО 4 – НР O 4 2– 5, 8 · 10 – 8 7, 24 HPO 4 2– PO 4 3– 3, 6 · 10 – 13 12, 44 HOOC-COO – – OOC-COO – 6, 8 · 10 – 5 4, 27 СН 3 СООН СН 3 СОО – 1, 8 · 10 – 5 4, 75 Н 2 СО 3 (СО 2 ) НСО 3 – 4, 4 · 10 – 7 6, 36 HCO 3 – CO 3 2– 4, 6 · 10 – 11 10, 34 H 2 S HS – 8, 0 · 10 – 8 7, 10 HCN CN – 7, 0 · 10 – 10 9, 16 NH 4 + NH 3 5, 6 · 10 – 10 9,
8 СОПРЯЖЕННЫЕ ПАРЫ КИСЛОТА–ОСНОВАНИЕ (В ВОДНОМ РАСТВОРЕ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ) Кислота Основание Кд р. К НООС–СООН НООС–СОО – 5, 7· 10 – 2 1, 25 HSO 4 – SO 4 2– 2, 0 · 10 – 2 1, 70 Н 3 РО 4 H 2 PO 4 – 7, 6 · 10 – 3 2, 12 Н 2 РО 4 – НР O 4 2– 5, 8 · 10 – 8 7, 24 HPO 4 2– PO 4 3– 3, 6 · 10 – 13 12, 44 HOOC-COO – – OOC-COO – 6, 8 · 10 – 5 4, 27 СН 3 СООН СН 3 СОО – 1, 8 · 10 – 5 4, 75 Н 2 СО 3 (СО 2 ) НСО 3 – 4, 4 · 10 – 7 6, 36 HCO 3 – CO 3 2– 4, 6 · 10 – 11 10, 34 H 2 S HS – 8, 0 · 10 – 8 7, 10 HCN CN – 7, 0 · 10 – 10 9, 16 NH 4 + NH 3 5, 6 · 10 – 10 9,
 9 Классификация кислот 1) нейтральные — НС l , H 2 SO 4 , Н 3 РО 4 : H 2 SO 4 Н + + HSO 4 – 2) катионные — положительные ионы — NH 4 + , H 3 O + : NH 4 + NH 3 + Н + 3) анионные — отрицательные ионы — HSO 4 – , H 2 PO 4 – , HPO 4 2– : HSO 4 – Н + + SO 4 2–
9 Классификация кислот 1) нейтральные — НС l , H 2 SO 4 , Н 3 РО 4 : H 2 SO 4 Н + + HSO 4 – 2) катионные — положительные ионы — NH 4 + , H 3 O + : NH 4 + NH 3 + Н + 3) анионные — отрицательные ионы — HSO 4 – , H 2 PO 4 – , HPO 4 2– : HSO 4 – Н + + SO 4 2–
 10 Классификация оснований 1) нейтральные — NH 3 , H 2 O , С 2 Н 5 ОН : NH 3 + Н + NH 4 + 2) анионные — отрицательные ионы — С l – , СН 3 СОО – , ОН – : СН 3 СОО – + Н + СН 3 СООН 3) катионные — положительные ионы — А l ( O Н) 2 + : А l ( O Н) 2 + + Н + А l. O Н 2+ + Н 2 О
10 Классификация оснований 1) нейтральные — NH 3 , H 2 O , С 2 Н 5 ОН : NH 3 + Н + NH 4 + 2) анионные — отрицательные ионы — С l – , СН 3 СОО – , ОН – : СН 3 СОО – + Н + СН 3 СООН 3) катионные — положительные ионы — А l ( O Н) 2 + : А l ( O Н) 2 + + Н + А l. O Н 2+ + Н 2 О
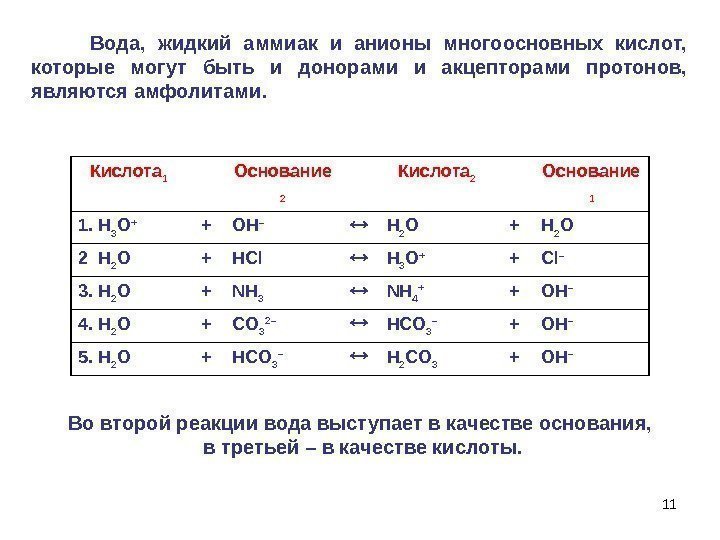
 11 Вода, жидкий аммиак и анионы многоосновных кислот, которые могут быть и донорами и акцепторами протонов, являются амфолитами. Во второй реакции вода выступает в качестве основания, в третьей – в качестве кислоты. Кислота 1 Основание 2 Кислота 2 Основание 1 1. H 3 O + + OH – H 2 O + H 2 O 2 H 2 O + HCl H 3 O + + Cl – 3. H 2 O + NH 3 NH 4 + + OH – 4. H 2 O + CO 3 2– HCO 3 – + OH – 5. H 2 O + HCO 3 – H 2 CO 3 + OH –
11 Вода, жидкий аммиак и анионы многоосновных кислот, которые могут быть и донорами и акцепторами протонов, являются амфолитами. Во второй реакции вода выступает в качестве основания, в третьей – в качестве кислоты. Кислота 1 Основание 2 Кислота 2 Основание 1 1. H 3 O + + OH – H 2 O + H 2 O 2 H 2 O + HCl H 3 O + + Cl – 3. H 2 O + NH 3 NH 4 + + OH – 4. H 2 O + CO 3 2– HCO 3 – + OH – 5. H 2 O + HCO 3 – H 2 CO 3 + OH –
 12 3. По Льюису ЛЬЮИС Гилберт Ньютон (23. 10 1875– 23. 03 1946) Во время первой мировой войны – полковник Военно-химической службы США (разрабатывал способы защиты от отравляющих газов). Кислота — вещество, принимающее электронные пары – акцептор электронов ; Основание — вещество, поставляющее электроны для образования химической связи – донор электронов.
12 3. По Льюису ЛЬЮИС Гилберт Ньютон (23. 10 1875– 23. 03 1946) Во время первой мировой войны – полковник Военно-химической службы США (разрабатывал способы защиты от отравляющих газов). Кислота — вещество, принимающее электронные пары – акцептор электронов ; Основание — вещество, поставляющее электроны для образования химической связи – донор электронов.
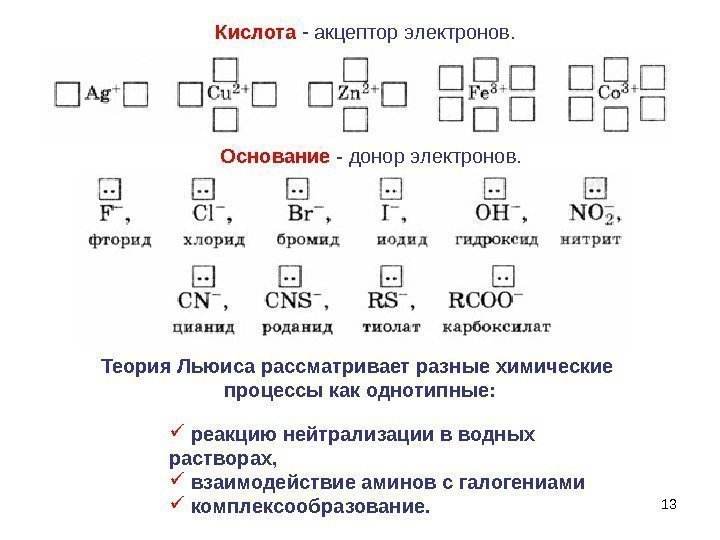
 13 Кислота — акцептор электронов. реакцию нейтрализации в водных растворах, взаимодействие аминов с галогениами комплексообразование. Основание — донор электронов. Теория Льюиса рассматривает разные химические процессы как однотипные:
13 Кислота — акцептор электронов. реакцию нейтрализации в водных растворах, взаимодействие аминов с галогениами комплексообразование. Основание — донор электронов. Теория Льюиса рассматривает разные химические процессы как однотипные:
 14 Значение постоянства кислотности жидких сред для жизнедеятельности человеческого организма : Ионы водорода оказывают каталитическое действие на многие биохимические превращения; Ферменты и гормоны проявляют биологическую активность только в строго определенном интервале значений р. Н; Минимальные изменения концентрации ионов водорода в крови и межтканевых жидкостях ощутимо влияют на величину осмотического давления; Необходимость в приготовлении буферных растворов для введения в организм, и моделирования биопроцессов.
14 Значение постоянства кислотности жидких сред для жизнедеятельности человеческого организма : Ионы водорода оказывают каталитическое действие на многие биохимические превращения; Ферменты и гормоны проявляют биологическую активность только в строго определенном интервале значений р. Н; Минимальные изменения концентрации ионов водорода в крови и межтканевых жидкостях ощутимо влияют на величину осмотического давления; Необходимость в приготовлении буферных растворов для введения в организм, и моделирования биопроцессов.
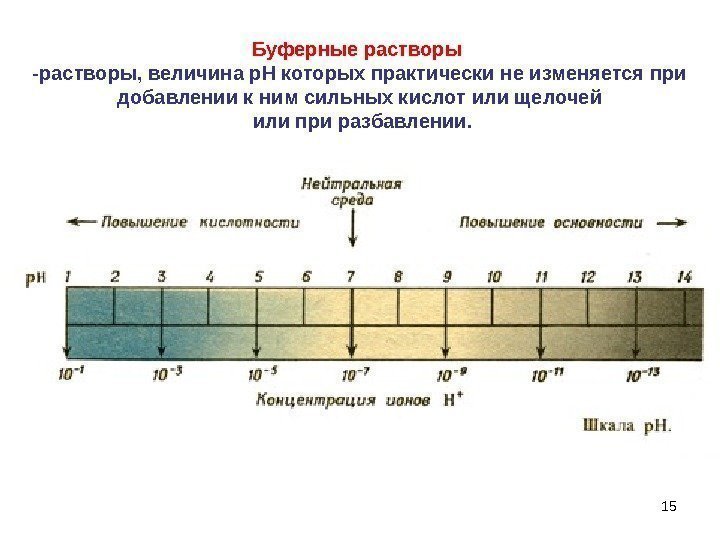
 15 Буферные растворы -растворы, величина р. Н которых практически не изменяется при добавлении к ним сильных кислот или щелочей или при разбавлении.
15 Буферные растворы -растворы, величина р. Н которых практически не изменяется при добавлении к ним сильных кислот или щелочей или при разбавлении.
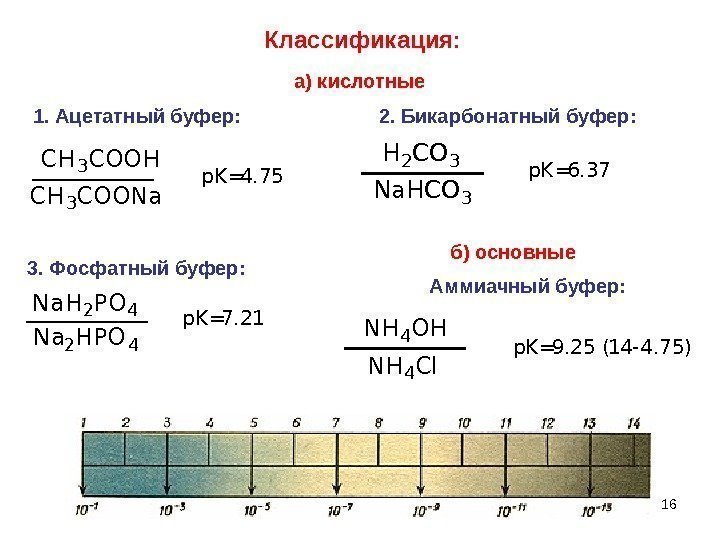
 16 Na. H 2 PO 4 Na 2 HPO 4 p. K=7. 21 p. K=4. 75 C H 3 C O O H C H 3 C O O N ap. K=6. 37 N a H C O 3 H 2 C O 3 p K = 9. 2 5 ( 1 4 — 4. 7 5 ) N H 4 C l. N H 4 O H 1. Ацетатный буфер: 3. Фосфатный буфер: 2. Бикарбонатный буфер: Аммиачный буфер: Классификация: а) кислотные б) основные
16 Na. H 2 PO 4 Na 2 HPO 4 p. K=7. 21 p. K=4. 75 C H 3 C O O H C H 3 C O O N ap. K=6. 37 N a H C O 3 H 2 C O 3 p K = 9. 2 5 ( 1 4 — 4. 7 5 ) N H 4 C l. N H 4 O H 1. Ацетатный буфер: 3. Фосфатный буфер: 2. Бикарбонатный буфер: Аммиачный буфер: Классификация: а) кислотные б) основные
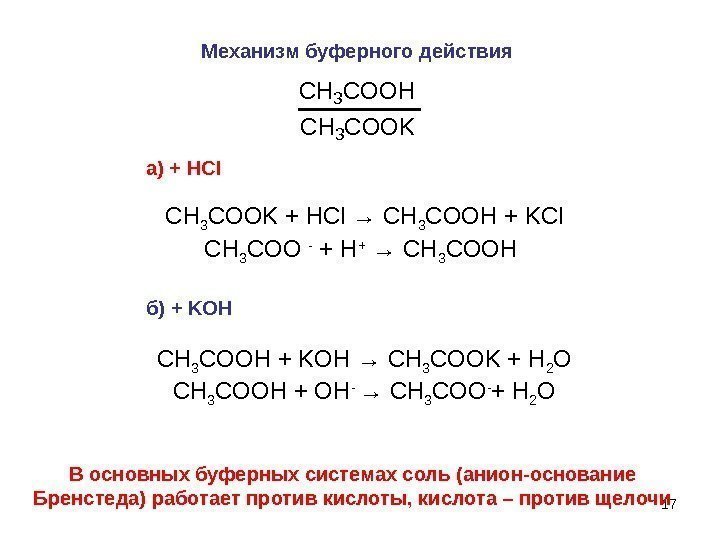
 17 Механизм буферного действия. CH 3 COOH CH 3 COOK а ) + HCl С H 3 COOK + HCl → С H 3 COOH + KCl С H 3 COO — + H + → С H 3 COOH б ) + KOH С H 3 COO Н + KOH → С H 3 COOK + Н 2 О С H 3 COO Н + OH — → С H 3 COO — + Н 2 О В основных буферных системах соль (анион-основание Бренстеда) работает против кислоты, кислота – против щелочи
17 Механизм буферного действия. CH 3 COOH CH 3 COOK а ) + HCl С H 3 COOK + HCl → С H 3 COOH + KCl С H 3 COO — + H + → С H 3 COOH б ) + KOH С H 3 COO Н + KOH → С H 3 COOK + Н 2 О С H 3 COO Н + OH — → С H 3 COO — + Н 2 О В основных буферных системах соль (анион-основание Бренстеда) работает против кислоты, кислота – против щелочи
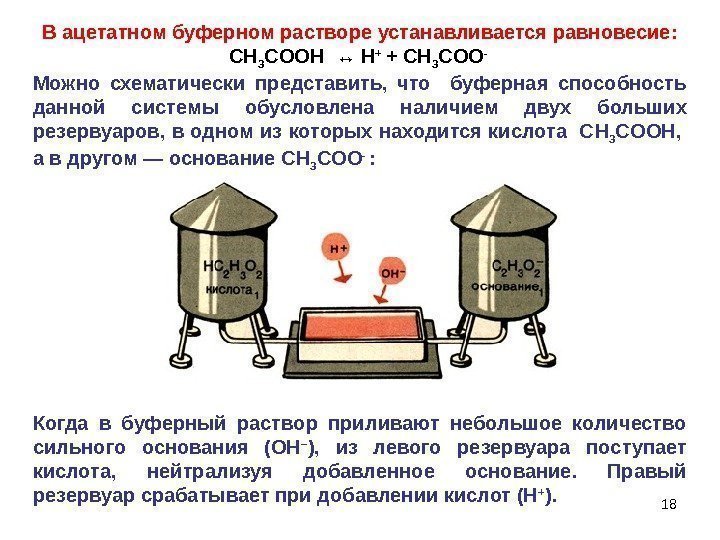
 18 В ацетатном буферном растворе устанавливается равновесие : С H 3 COOH ↔ H + + С H 3 COO — Можно схематически представить, что буферная способность данной системы обусловлена наличием двух больших резервуаров, в одном из которых находится кислота С H 3 COOH , а в другом — основание С H 3 COO — : Когда в буферный раствор приливают небольшое количество сильного основания (ОН – ), из левого резервуара поступает кислота, нейтрализуя добавленное основание. Правый резервуар срабатывает при добавлении кислот (Н + ).
18 В ацетатном буферном растворе устанавливается равновесие : С H 3 COOH ↔ H + + С H 3 COO — Можно схематически представить, что буферная способность данной системы обусловлена наличием двух больших резервуаров, в одном из которых находится кислота С H 3 COOH , а в другом — основание С H 3 COO — : Когда в буферный раствор приливают небольшое количество сильного основания (ОН – ), из левого резервуара поступает кислота, нейтрализуя добавленное основание. Правый резервуар срабатывает при добавлении кислот (Н + ).
 19 Добавим 1 каплю (0, 05 мл) 1 н НС l к 1 л воды ( безбуферный раствор, р. Н=7) и рассчитаем изменение р. Н: 1000 мл – 1 моль-экв. H + 0, 05 мл — х х = 0, 05/1000 = 5· 10 -5 моль-экв р. Н = — lg 5· 10 -5 = 4, 6 Вывод! Буферные системы крови обладают колоссальной буферной емкостью!За сутки организм человека вырабатывает ~ 30 л 1 н НС l (600000 капель!), а изменение р. Н на 0. 6 единиц приводит к летальному исходу! Изменение р. Н составит 7 — 4. 6 = 2. 4 единицы1 капля V 0. 05 мл
19 Добавим 1 каплю (0, 05 мл) 1 н НС l к 1 л воды ( безбуферный раствор, р. Н=7) и рассчитаем изменение р. Н: 1000 мл – 1 моль-экв. H + 0, 05 мл — х х = 0, 05/1000 = 5· 10 -5 моль-экв р. Н = — lg 5· 10 -5 = 4, 6 Вывод! Буферные системы крови обладают колоссальной буферной емкостью!За сутки организм человека вырабатывает ~ 30 л 1 н НС l (600000 капель!), а изменение р. Н на 0. 6 единиц приводит к летальному исходу! Изменение р. Н составит 7 — 4. 6 = 2. 4 единицы1 капля V 0. 05 мл
 20 Вывод формул для расчета р. Н к c кисл кк cc кисл д к c кисл д ск кисл д с кисл д к 3 c 3 33 кисл д 33 33 n n lgp. Kp. H ·VN lgp. Kp. H С С lg. Кpp. H С С lg. Кlg][Hlg С ·СК ]H[ C]COOHCH[ , C]COOCH[ COOH][CH ]][HCOO[CH К KCOOCHCOOKCH НCOOCHCOOHCH
20 Вывод формул для расчета р. Н к c кисл кк cc кисл д к c кисл д ск кисл д с кисл д к 3 c 3 33 кисл д 33 33 n n lgp. Kp. H ·VN lgp. Kp. H С С lg. Кpp. H С С lg. Кlg][Hlg С ·СК ]H[ C]COOHCH[ , C]COOCH[ COOH][CH ]][HCOO[CH К KCOOCHCOOKCH НCOOCHCOOHCH
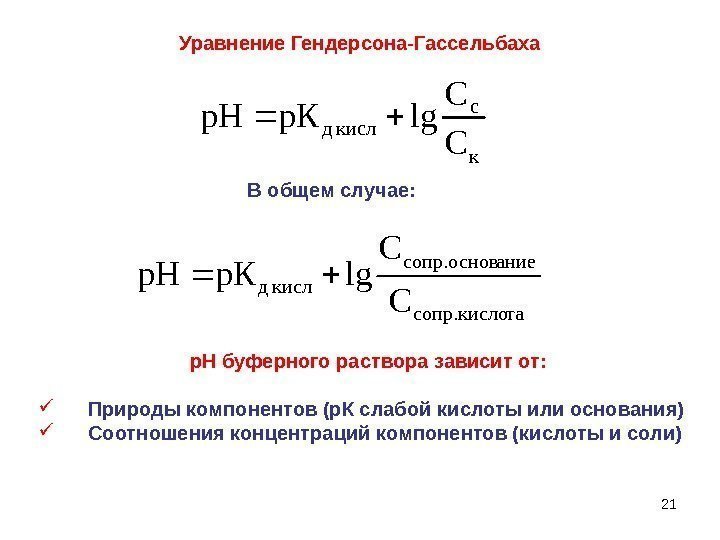
 21 Уравнение Гендерсона-Гассельбахак c кисл д С С lg. Кpp. H р. Н буферного раствора зависит от: Природы компонентов (р. К слабой кислоты или основания) Соотношения концентраций компонентов (кислоты и соли) тасопр. кисло аниеcопр. основ кисл д С С lg. Кpp. HВ общем случае:
21 Уравнение Гендерсона-Гассельбахак c кисл д С С lg. Кpp. H р. Н буферного раствора зависит от: Природы компонентов (р. К слабой кислоты или основания) Соотношения концентраций компонентов (кислоты и соли) тасопр. кисло аниеcопр. основ кисл д С С lg. Кpp. HВ общем случае:
 22 Уравнение нельзя применять : если концентрации компонентов отличаются более чем в 100 раз; если кислота (основание) слишком сильные — р. К а 11 (нельзя пренебрегать гидролизом ). Для основного буферного раствора: с осн д СC lgp. K 14 p. H
22 Уравнение нельзя применять : если концентрации компонентов отличаются более чем в 100 раз; если кислота (основание) слишком сильные — р. К а 11 (нельзя пренебрегать гидролизом ). Для основного буферного раствора: с осн д СC lgp. K 14 p. H
 23 Соотношение компонентов 1: 1 р. Н = р. КПонятие «идеального» буферного раствора.
23 Соотношение компонентов 1: 1 р. Н = р. КПонятие «идеального» буферного раствора.
 24 Одинаково хорошо противостоят как добавлению кислоты, так и добавлению щелочи. Понятие «идеального» буферного раствора.
24 Одинаково хорошо противостоят как добавлению кислоты, так и добавлению щелочи. Понятие «идеального» буферного раствора.
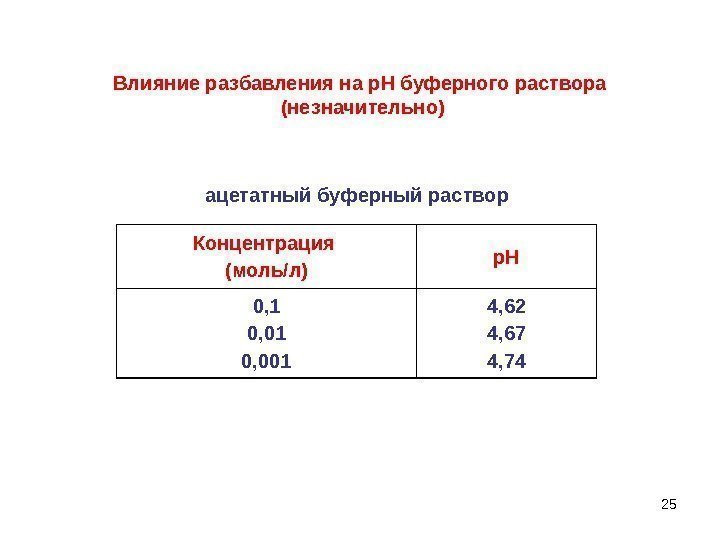
 25 Концентрация (моль/л) р. Н 0, 1 0, 001 4, 62 4, 67 4, 74 Влияние разбавления на р. Н буферного раствора (незначительно) ацетатный буферный раствор
25 Концентрация (моль/л) р. Н 0, 1 0, 001 4, 62 4, 67 4, 74 Влияние разбавления на р. Н буферного раствора (незначительно) ацетатный буферный раствор
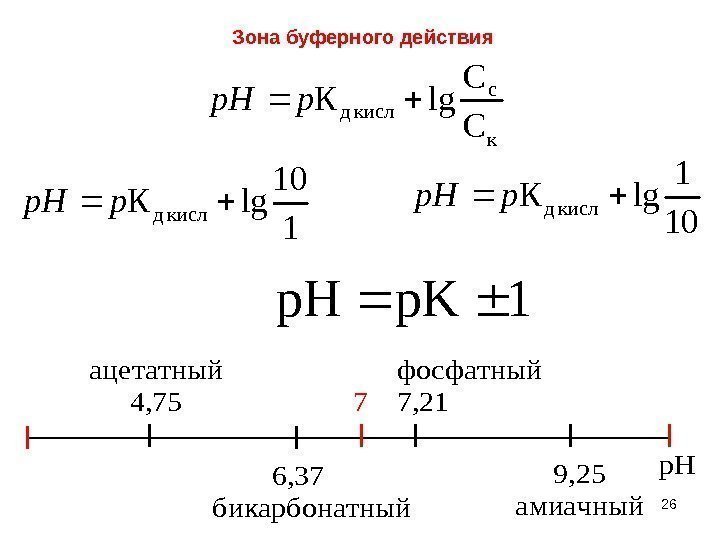
 26 Зона буферного действияацетатный 4, 75 6, 37 бикарбонатный 7 фосфатный 7, 21 9, 25 амиачный р. Н 1 p. Kp. H к c кисл д С С lg. Кpp. H 10 1 lg. Ккисл дpp. H 1 10 lg. Ккисл дpp. H
26 Зона буферного действияацетатный 4, 75 6, 37 бикарбонатный 7 фосфатный 7, 21 9, 25 амиачный р. Н 1 p. Kp. H к c кисл д С С lg. Кpp. H 10 1 lg. Ккисл дpp. H 1 10 lg. Ккисл дpp. H
 27 Приготовление буферных растворов с заданным значением р. Н Задача. Приготовить раствор с р. Н = 7, 36. Необходимо изменить соотношение компонентов в пользу соли (значение р. Н находится в более щелочной области, чем р. К) 42 42 HPONa. H Выбираем фосфатный буфер, поскольку р. Н попадает в зону действия 6. 21 – 8. 21 ацетатный 4, 75 6, 37 бикарбонатный 7 фосфатный 7, 21 9, 25 амиачный р. Н
27 Приготовление буферных растворов с заданным значением р. Н Задача. Приготовить раствор с р. Н = 7, 36. Необходимо изменить соотношение компонентов в пользу соли (значение р. Н находится в более щелочной области, чем р. К) 42 42 HPONa. H Выбираем фосфатный буфер, поскольку р. Н попадает в зону действия 6. 21 – 8. 21 ацетатный 4, 75 6, 37 бикарбонатный 7 фосфатный 7, 21 9, 25 амиачный р. Н
![28]PONa. H[ ]HPONa[ lg 21, 736, 7 42 42 ]кислота[ ]соль[ lg 15, 0 28]PONa. H[ ]HPONa[ lg 21, 736, 7 42 42 ]кислота[ ]соль[ lg 15, 0](http://present5.com/presentforday2/20161222/4.0_bufery_images/4.0_bufery_27.jpg) 28]PONa. H[ ]HPONa[ lg 21, 736, 7 42 42 ]кислота[ ]соль[ lg 15, 0 1 41, 1 10 ]PONa. H[ ]HPONa[ ]кислота[ ]соль[15. 0 42 42 Рассчитаем, во сколько раз концентрация соли должна быть больше:
28]PONa. H[ ]HPONa[ lg 21, 736, 7 42 42 ]кислота[ ]соль[ lg 15, 0 1 41, 1 10 ]PONa. H[ ]HPONa[ ]кислота[ ]соль[15. 0 42 42 Рассчитаем, во сколько раз концентрация соли должна быть больше:
 29 Буферная ёмкость В – число моль-экв сильной кислоты или щелочи, которое нужно добавить к 1 л буферной системы, чтобы изменить р. Н на единицу буфэлэл. Vp. H VC B · · Буферная ёмкость зависит от: Абсолютных концентраций компонентов
29 Буферная ёмкость В – число моль-экв сильной кислоты или щелочи, которое нужно добавить к 1 л буферной системы, чтобы изменить р. Н на единицу буфэлэл. Vp. H VC B · · Буферная ёмкость зависит от: Абсолютных концентраций компонентов
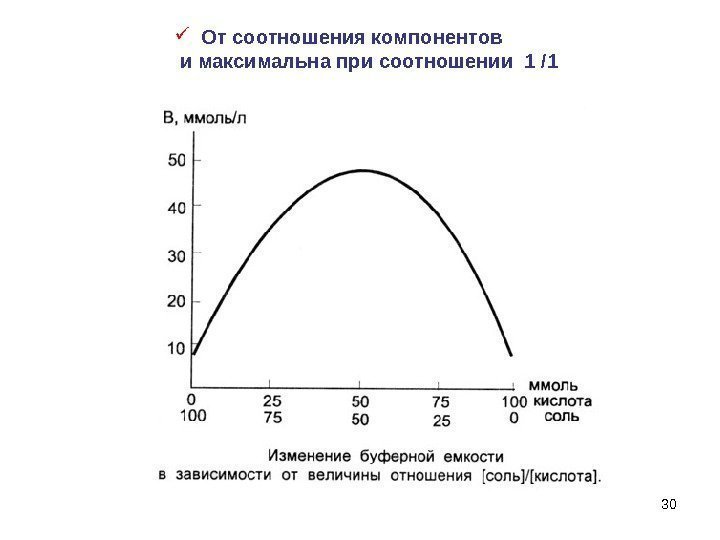
 30 От соотношения компонентов и максимальна при соотношении 1 /
30 От соотношения компонентов и максимальна при соотношении 1 /
 31 Буферные растворы, у которых р. Н р. К, (более щелочное по отношению к р. К) имеют большую буферную емкость по кислоте. к c С С lgp. Kp. H ацетатный 4, 75 6, 37 бикарбонатный 7 фосфатный 7, 21 9, 25 амиачный р. Н
31 Буферные растворы, у которых р. Н р. К, (более щелочное по отношению к р. К) имеют большую буферную емкость по кислоте. к c С С lgp. Kp. H ацетатный 4, 75 6, 37 бикарбонатный 7 фосфатный 7, 21 9, 25 амиачный р. Н
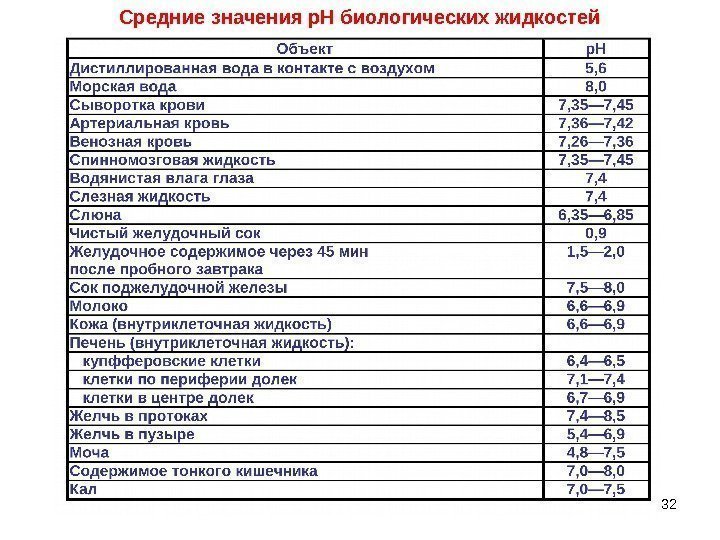
 32 Средние значения р. Н биологических жидкостей
32 Средние значения р. Н биологических жидкостей
 33 Буферные системы крови Из кишечника и тканей в кровь при обмене веществ постоянно поступают различные кислоты: угольная, молочная, масляная … и , в меньшей степени , основания: аммиак, креатин. Благодаря наличию буферных систем, р. Н крови остается постоянным 7. 4 ± 0. 04 В организме человека в спокойном состоянии ежесуточно образуется количество кислоты, эквивалентное ≈ 30 л 1 н НС I ! !!!
33 Буферные системы крови Из кишечника и тканей в кровь при обмене веществ постоянно поступают различные кислоты: угольная, молочная, масляная … и , в меньшей степени , основания: аммиак, креатин. Благодаря наличию буферных систем, р. Н крови остается постоянным 7. 4 ± 0. 04 В организме человека в спокойном состоянии ежесуточно образуется количество кислоты, эквивалентное ≈ 30 л 1 н НС I ! !!!
 34 Защитные функции по поддержанию постоянства р. Н выполняют 4 буферные системы: Бикарбонатная Фосфатная Белковая Гемоглобиновая
34 Защитные функции по поддержанию постоянства р. Н выполняют 4 буферные системы: Бикарбонатная Фосфатная Белковая Гемоглобиновая
 35 I. Бикарбонатная буферная система: 32 3 COH HCO 322 3 COHCO 376 p. K 10· 37, 4 7, K 11, 610767 K 7 p. K ·, С учётом растворенного СО 2 (37 o С)
35 I. Бикарбонатная буферная система: 32 3 COH HCO 322 3 COHCO 376 p. K 10· 37, 4 7, K 11, 610767 K 7 p. K ·, С учётом растворенного СО 2 (37 o С)
![362 3 p. СO ][HCO lg 11, 6 p. H Уравнение Гендерсона-Гассельбаха (для расчета 362 3 p. СO ][HCO lg 11, 6 p. H Уравнение Гендерсона-Гассельбаха (для расчета](http://present5.com/presentforday2/20161222/4.0_bufery_images/4.0_bufery_35.jpg) 362 3 p. СO ][HCO lg 11, 6 p. H Уравнение Гендерсона-Гассельбаха (для расчета р. Н крови) р. СО 2 – альвеолярное давление (парциальное давление СО 2 воздуха, находящегося в равновесии с кровью)
362 3 p. СO ][HCO lg 11, 6 p. H Уравнение Гендерсона-Гассельбаха (для расчета р. Н крови) р. СО 2 – альвеолярное давление (парциальное давление СО 2 воздуха, находящегося в равновесии с кровью)
 374, 7 120 lg 6, 11 p. H 4, 7 2, 1 9, 23 lg 6, 11 p. H 1, 2 рт. столба мм 40· 03, 0 p. CO· л/ммоль 9, 23]HCO[ крови 2 3 Поскольку [НСО 3 – ]: [СО 2 ]=20: 1, а HCO 3 — работает против кислоты, бикарбонатная система имеет буферную емкость по кислоте значительно больше буферной емкости по основанию. Это отвечает особенностям метаболизма организма. Расчёт р. Н крови
374, 7 120 lg 6, 11 p. H 4, 7 2, 1 9, 23 lg 6, 11 p. H 1, 2 рт. столба мм 40· 03, 0 p. CO· л/ммоль 9, 23]HCO[ крови 2 3 Поскольку [НСО 3 – ]: [СО 2 ]=20: 1, а HCO 3 — работает против кислоты, бикарбонатная система имеет буферную емкость по кислоте значительно больше буферной емкости по основанию. Это отвечает особенностям метаболизма организма. Расчёт р. Н крови
 38 Механизм действия бикарбонатной буферной системы При увеличении в крови концентрации ионов Н + происходит выделение С O 2 , который выводится из организма в процессе дыхания через легкие: H + + HCO 3 – H 2 CO 3 CO 2 + H 2 O При поступлении в кровь оснований, они связываются угольной кислотой, и равновесие смещается в сторону образования НСО 3 – : OH – + H 2 CO 3 HCO 3 – + H 2 O Нарушение кислотно-основного равновесия в организме компенсируется бикарбонатной буферной системы (за 10 -15 мин). Соотношение [НСО 3 – ]/[Н 2 СО 3 ] изменяется и приходит в норму за счет легочной вентиляции в течение 10 18 часов. ‑ Бикарбонатный буфер — основной буферной системой плазмы крови и содержится также в эритроцитах, межклеточной жидкости и в почечной ткани.
38 Механизм действия бикарбонатной буферной системы При увеличении в крови концентрации ионов Н + происходит выделение С O 2 , который выводится из организма в процессе дыхания через легкие: H + + HCO 3 – H 2 CO 3 CO 2 + H 2 O При поступлении в кровь оснований, они связываются угольной кислотой, и равновесие смещается в сторону образования НСО 3 – : OH – + H 2 CO 3 HCO 3 – + H 2 O Нарушение кислотно-основного равновесия в организме компенсируется бикарбонатной буферной системы (за 10 -15 мин). Соотношение [НСО 3 – ]/[Н 2 СО 3 ] изменяется и приходит в норму за счет легочной вентиляции в течение 10 18 часов. ‑ Бикарбонатный буфер — основной буферной системой плазмы крови и содержится также в эритроцитах, межклеточной жидкости и в почечной ткани.
 39 II. Фосфатная буферная система: К 2 НРО 4 и КН 2 РО 4 — в клетках Na 2 HPO 4 и Na. H 2 PO 4 — в плазме крови и межклеточной жидкости Фосфатная буферная система также имеет буферную емкость по кислоте больше, чем по основанию. Уравнение буферного действия: В норме отношение форм [НРО 4 2– ]/[ H 2 PO 4 – ]=4: 1. Фосфатная буферная система содержится как в крови, так и в клеточной жидкости других тканей, особенно почек и пищеварительных желез ]POH[ ]НРO[ lg 8, 6 р. Н
39 II. Фосфатная буферная система: К 2 НРО 4 и КН 2 РО 4 — в клетках Na 2 HPO 4 и Na. H 2 PO 4 — в плазме крови и межклеточной жидкости Фосфатная буферная система также имеет буферную емкость по кислоте больше, чем по основанию. Уравнение буферного действия: В норме отношение форм [НРО 4 2– ]/[ H 2 PO 4 – ]=4: 1. Фосфатная буферная система содержится как в крови, так и в клеточной жидкости других тканей, особенно почек и пищеварительных желез ]POH[ ]НРO[ lg 8, 6 р. Н
 40 Механизм действия При увеличении ионов Н + во внутриклеточной жидкости, в результате переработки мясной пищи образующийся избыточный дигидрофосфат выводится почками. р. Н мочи уменьшается. H + + HPO 4 2– H 2 PO 4 – При употреблении растительной пищи в организме накапливаются основания. Они нейтрализуются ионами Н 2 РО 4 — , и образующийся дигидрофосфат выводится почками. р. Н мочи повышается: OH – + H 2 PO 4 – HPO 4 2– + H 2 O В отличие от гидрокарбонатной, фосфатная система более «консервативна» . Избыточные продукты нейтрализации выводятся через почки и полное восстановление отношения [НРО 4 2– ]/[ H 2 PO 4 – ] происходит только через 2 -3 суток.
40 Механизм действия При увеличении ионов Н + во внутриклеточной жидкости, в результате переработки мясной пищи образующийся избыточный дигидрофосфат выводится почками. р. Н мочи уменьшается. H + + HPO 4 2– H 2 PO 4 – При употреблении растительной пищи в организме накапливаются основания. Они нейтрализуются ионами Н 2 РО 4 — , и образующийся дигидрофосфат выводится почками. р. Н мочи повышается: OH – + H 2 PO 4 – HPO 4 2– + H 2 O В отличие от гидрокарбонатной, фосфатная система более «консервативна» . Избыточные продукты нейтрализации выводятся через почки и полное восстановление отношения [НРО 4 2– ]/[ H 2 PO 4 – ] происходит только через 2 -3 суток.
 41 Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений р. Н мочи ( 4, 8 до 7, 5. )
41 Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений р. Н мочи ( 4, 8 до 7, 5. )
 42 III. Белковая буферная система: В результате ионизации аминогрупп и карбоксильных групп белки существуют в водных растворах в виде биполярного иона R ± : NH 2 – Pt –СООН ( R ) NH 3 + – Pt – COO – ( R ± )NH 2 — Pt-COOH NH 2 -Pt-COONa Белки составляют 20% массы клеток и тканей, поэтому белковая буферная система является одной из мощных буферных систем организма. р I ( ИЭТ) – изоэлектрическая точка белка – значение р. Н, при котором молекула белка, в целом, электронейтральна
42 III. Белковая буферная система: В результате ионизации аминогрупп и карбоксильных групп белки существуют в водных растворах в виде биполярного иона R ± : NH 2 – Pt –СООН ( R ) NH 3 + – Pt – COO – ( R ± )NH 2 — Pt-COOH NH 2 -Pt-COONa Белки составляют 20% массы клеток и тканей, поэтому белковая буферная система является одной из мощных буферных систем организма. р I ( ИЭТ) – изоэлектрическая точка белка – значение р. Н, при котором молекула белка, в целом, электронейтральна
 43 COOHPt. NHHCOOPt. NH 33 OHCOOPt. NH 223 Механизм действия При добавлении сильной кислоты протон присоединяется к -СО O – — группе с образованием катиона R + : При добавлении щелочи группа NH 3 + отдает протон, и образует анион R – :
43 COOHPt. NHHCOOPt. NH 33 OHCOOPt. NH 223 Механизм действия При добавлении сильной кислоты протон присоединяется к -СО O – — группе с образованием катиона R + : При добавлении щелочи группа NH 3 + отдает протон, и образует анион R – :
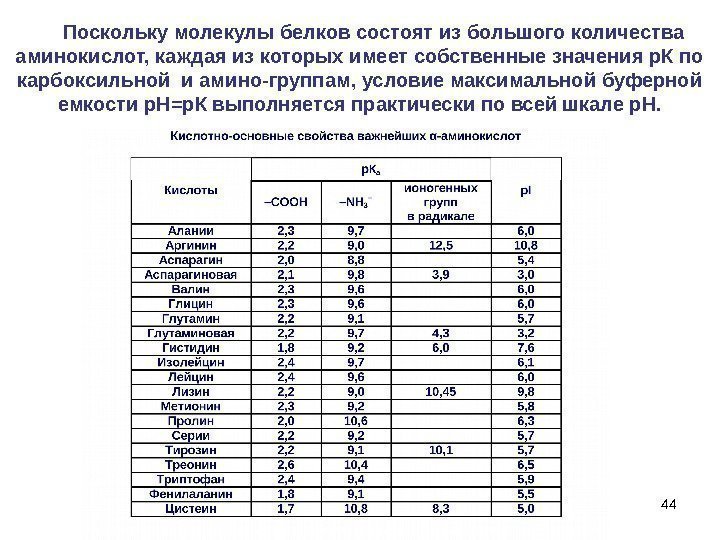
 44 Поскольку молекулы белков состоят из большого количества аминокислот, каждая из которых имеет собственные значения р. К по карбоксильной и амино-группам, условие максимальной буферной емкости р. Н=р. К выполняется практически по всей шкале р. Н.
44 Поскольку молекулы белков состоят из большого количества аминокислот, каждая из которых имеет собственные значения р. К по карбоксильной и амино-группам, условие максимальной буферной емкости р. Н=р. К выполняется практически по всей шкале р. Н.
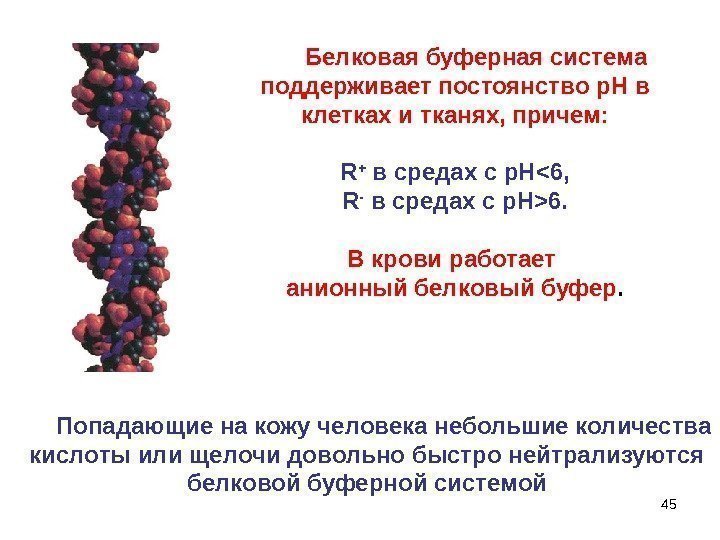
 45 Белковая буферная система поддерживает постоянство р. Н в клетках и тканях, причем: R + в средах с р. Н 6. В крови работает анионный белковый буфер. Попадающие на кожу человека небольшие количества кислоты или щелочи довольно быстро нейтрализуются белковой буферной системой
45 Белковая буферная система поддерживает постоянство р. Н в клетках и тканях, причем: R + в средах с р. Н 6. В крови работает анионный белковый буфер. Попадающие на кожу человека небольшие количества кислоты или щелочи довольно быстро нейтрализуются белковой буферной системой
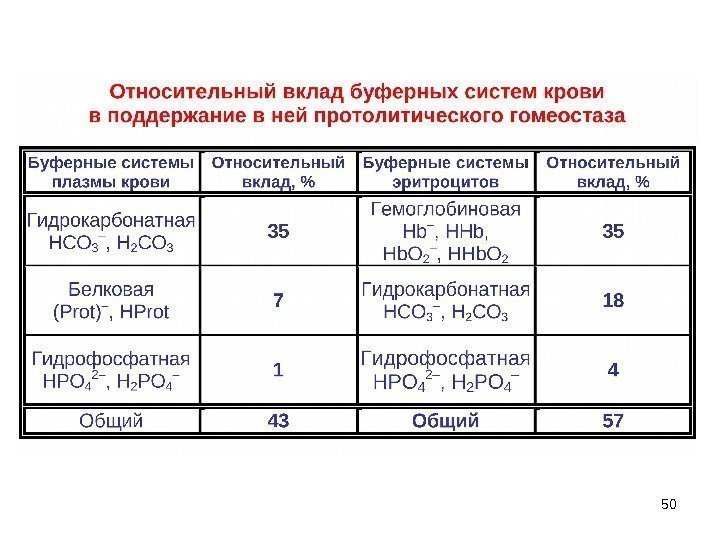
 46 IV. Гемоглобиновая буферная система: ~ 35 % общего буферного действия крови. Гемоглобиновая H-Hb K-Hb венозная кровь р. Н = 7. 32 – 7. 36 Оксигемоглобиновая HHb О 2 К -Hb О 2 артериальная кровь р. Н = 7. 42 – 7. 46 ~ 63 -75 % общего буферного действия в эритроцитах
46 IV. Гемоглобиновая буферная система: ~ 35 % общего буферного действия крови. Гемоглобиновая H-Hb K-Hb венозная кровь р. Н = 7. 32 – 7. 36 Оксигемоглобиновая HHb О 2 К -Hb О 2 артериальная кровь р. Н = 7. 42 – 7. 46 ~ 63 -75 % общего буферного действия в эритроцитах
 476, 95 p. K 8, 2 p. K 22 Hb. OHHHb. O Hb. HHHb. Оксигемоглобин более сильная кислота, чем гемоглобин! В легких идет процесс оксигенации: 95. 6 2. 8 22 p. K Нb. ОH О p. K Hb. H среда должна стать более кислой, но бикарбонат — ион взаимодействует с оксигемоглобином и кислотность среды восстанавливается: HCO 3 — + H — Hb. O 2 → Hb. O 2 — + H 2 O + CO 2 ↑
476, 95 p. K 8, 2 p. K 22 Hb. OHHHb. O Hb. HHHb. Оксигемоглобин более сильная кислота, чем гемоглобин! В легких идет процесс оксигенации: 95. 6 2. 8 22 p. K Нb. ОH О p. K Hb. H среда должна стать более кислой, но бикарбонат — ион взаимодействует с оксигемоглобином и кислотность среды восстанавливается: HCO 3 — + H — Hb. O 2 → Hb. O 2 — + H 2 O + CO 2 ↑
 48 Среда должна стать более щелочной, но в реакцию вступает более сильная угольная кислота, образуя бикарбонат-ион, который является основным компонентом щелочного резерва крови. 3222 22 СОНОНСО O Hb Hb. O — 332 — HCO 8, 2 p. K Hb-H COH Hb В тканях отдаётся кислород и поглощается СО 2 2. 895. 6 22 p. K ОHb. H О p. K Hb. H
48 Среда должна стать более щелочной, но в реакцию вступает более сильная угольная кислота, образуя бикарбонат-ион, который является основным компонентом щелочного резерва крови. 3222 22 СОНОНСО O Hb Hb. O — 332 — HCO 8, 2 p. K Hb-H COH Hb В тканях отдаётся кислород и поглощается СО 2 2. 895. 6 22 p. K ОHb. H О p. K Hb. H
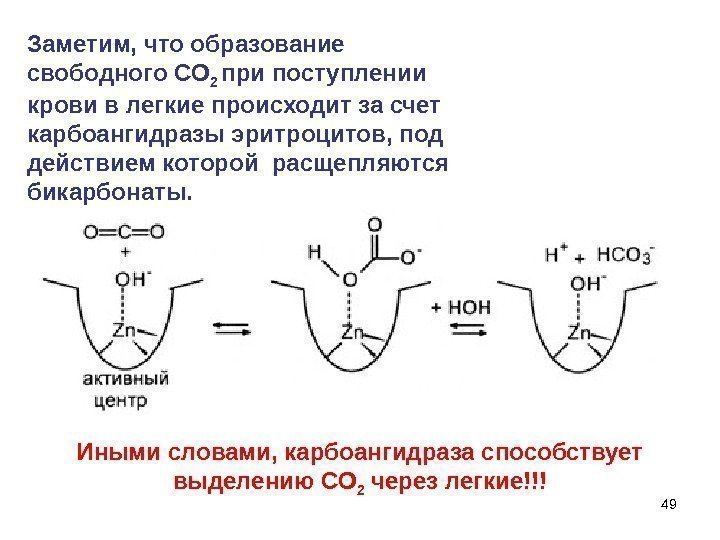
 49 Заметим, что образование свободного СО 2 при поступлении крови в легкие происходит за счет карбоангидразы эритроцитов, под действием которой расщепляются бикарбонаты. Иными словами, карбоангидраза способствует выделению СО 2 через легкие!!!
49 Заметим, что образование свободного СО 2 при поступлении крови в легкие происходит за счет карбоангидразы эритроцитов, под действием которой расщепляются бикарбонаты. Иными словами, карбоангидраза способствует выделению СО 2 через легкие!!!

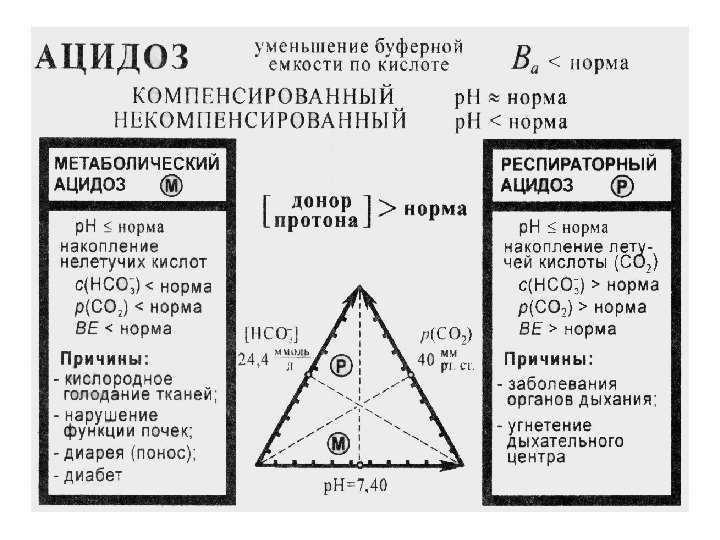
 51 Все буферные системы организма обладают большей буферной емкостью по кислоте, чем по основанию, ( поскольку характеризуются соотношением): 1 : 4 < [акцептор протона]/[донор протона] < 1 : 20 Это соотношение находится в соответствии с особенностями метаболизма человеческого организма, образующего больше кислотных продуктов, чем основных. Именно поэтому очень важным показателем для физиологических сред является буферная емкость В к по кислоте. При заболеваниях органов дыхания, кровообращения, печени, желудка, почек, при отравлениях, голодании, диабете, ожоговой болезни может наблюдаться уменьшение или увеличение В к по сравнению с нормой. Возникают патологические явления: ацидоз и алкалоз.
51 Все буферные системы организма обладают большей буферной емкостью по кислоте, чем по основанию, ( поскольку характеризуются соотношением): 1 : 4 < [акцептор протона]/[донор протона] < 1 : 20 Это соотношение находится в соответствии с особенностями метаболизма человеческого организма, образующего больше кислотных продуктов, чем основных. Именно поэтому очень важным показателем для физиологических сред является буферная емкость В к по кислоте. При заболеваниях органов дыхания, кровообращения, печени, желудка, почек, при отравлениях, голодании, диабете, ожоговой болезни может наблюдаться уменьшение или увеличение В к по сравнению с нормой. Возникают патологические явления: ацидоз и алкалоз.
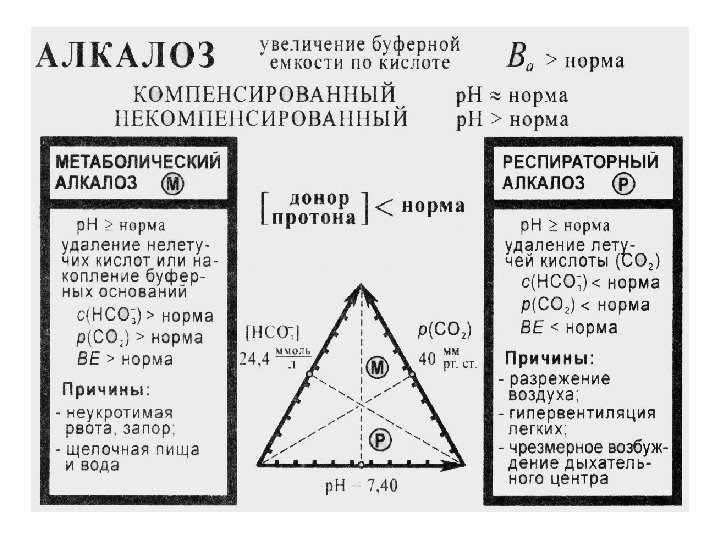
 52 Ацидоз – накопление в организме кислых продуктов уменьшение р. Н крови в сравнении с нормой (уменьшение кислотной буферной емкости в сравнении с нормой) Алкалоз – накопление в организме щелочных продуктов увеличение р. Н крови в сравнении с нормой (увеличение кислотной буферной емкости в сравнении с нормой)
52 Ацидоз – накопление в организме кислых продуктов уменьшение р. Н крови в сравнении с нормой (уменьшение кислотной буферной емкости в сравнении с нормой) Алкалоз – накопление в организме щелочных продуктов увеличение р. Н крови в сравнении с нормой (увеличение кислотной буферной емкости в сравнении с нормой)
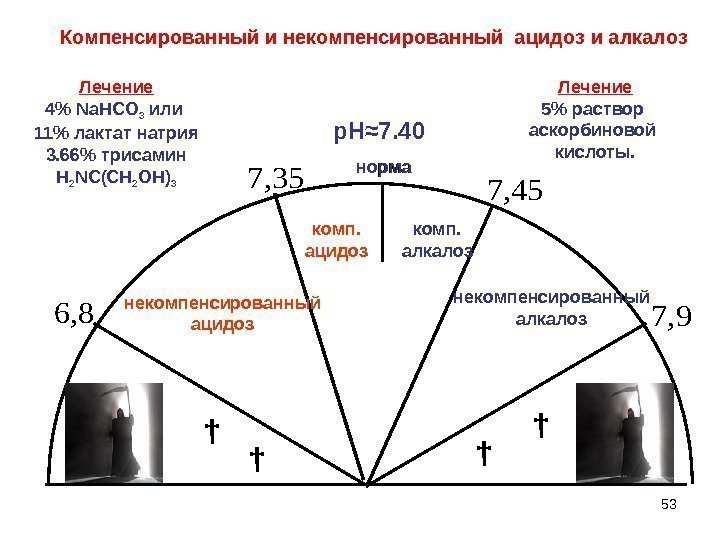
 536, 8 7, 35 7, 45 7, 9 норма † †† †р. Н≈ 7. 40 некомпенсированный ацидоз комп. алкалоз некомпенсированный алкалознорма. Компенсированный и некомпенсированный ацидоз и алкалоз Лечение 5% раствор аскорбиновой кислоты. Лечение 4% Na. HCO 3 или 11% лактат натрия 3. 66% трисамин Н 2 N С(СН 2 ОН)
536, 8 7, 35 7, 45 7, 9 норма † †† †р. Н≈ 7. 40 некомпенсированный ацидоз комп. алкалоз некомпенсированный алкалознорма. Компенсированный и некомпенсированный ацидоз и алкалоз Лечение 5% раствор аскорбиновой кислоты. Лечение 4% Na. HCO 3 или 11% лактат натрия 3. 66% трисамин Н 2 N С(СН 2 ОН)
 54 МЕТАБОЛИЧЕСКИЙ АЦИДОЗ Недостаток НСО 3 — или избыток нелетучих кислот в межклеточной жидкости Причины : введение или образование стойких кислот (молочная кислота при шоке, кетокислоты при голодании и диабете); неполное удаление кислот при почечной недостаточности; потеря НСО 3 — при заболеваниях ЖКТ; кислородное голодание тканей.
54 МЕТАБОЛИЧЕСКИЙ АЦИДОЗ Недостаток НСО 3 — или избыток нелетучих кислот в межклеточной жидкости Причины : введение или образование стойких кислот (молочная кислота при шоке, кетокислоты при голодании и диабете); неполное удаление кислот при почечной недостаточности; потеря НСО 3 — при заболеваниях ЖКТ; кислородное голодание тканей.
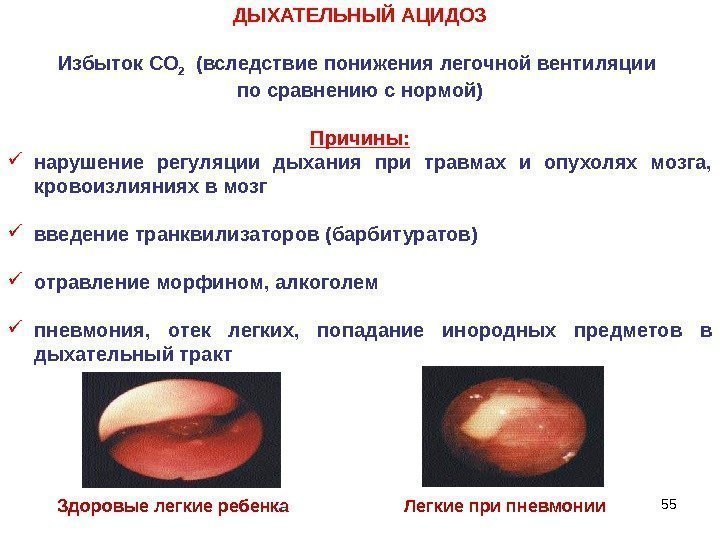
 55 ДЫХАТЕЛЬНЫЙ АЦИДОЗ Избыток СО 2 (вследствие понижения легочной вентиляции по сравнению с нормой) Причины : нарушение регуляции дыхания при травмах и опухолях мозга, кровоизлияниях в мозг введение транквилизаторов (барбитуратов) отравление морфином, алкоголем пневмония, отек легких, попадание инородных предметов в дыхательный тракт Здоровые легкие ребенка Легкие при пневмонии
55 ДЫХАТЕЛЬНЫЙ АЦИДОЗ Избыток СО 2 (вследствие понижения легочной вентиляции по сравнению с нормой) Причины : нарушение регуляции дыхания при травмах и опухолях мозга, кровоизлияниях в мозг введение транквилизаторов (барбитуратов) отравление морфином, алкоголем пневмония, отек легких, попадание инородных предметов в дыхательный тракт Здоровые легкие ребенка Легкие при пневмонии
 56 ДЫХАТЕЛЬНЫЙ АЛКАЛОЗ Недостаток СО 2 в связи с повышением легочной вентиляции, в сравнении с нормой. Причины : вдыхание разреженного воздуха; тепловая отдышка; лихорадочное состояние, истерия.
56 ДЫХАТЕЛЬНЫЙ АЛКАЛОЗ Недостаток СО 2 в связи с повышением легочной вентиляции, в сравнении с нормой. Причины : вдыхание разреженного воздуха; тепловая отдышка; лихорадочное состояние, истерия.
 57 МЕТАБОЛИЧЕСКИЙ АЛКАЛОЗ Удаление кислот из организма или накопление НСО 3 — Причины : потеря Н + при рвоте и кишечной непроходимости; увеличение НСО 3 — при введении солей органических кислот (лимонной, молочной, уксусной, яблочной); длительный приём щелочной пищи или минеральной воды.
57 МЕТАБОЛИЧЕСКИЙ АЛКАЛОЗ Удаление кислот из организма или накопление НСО 3 — Причины : потеря Н + при рвоте и кишечной непроходимости; увеличение НСО 3 — при введении солей органических кислот (лимонной, молочной, уксусной, яблочной); длительный приём щелочной пищи или минеральной воды.
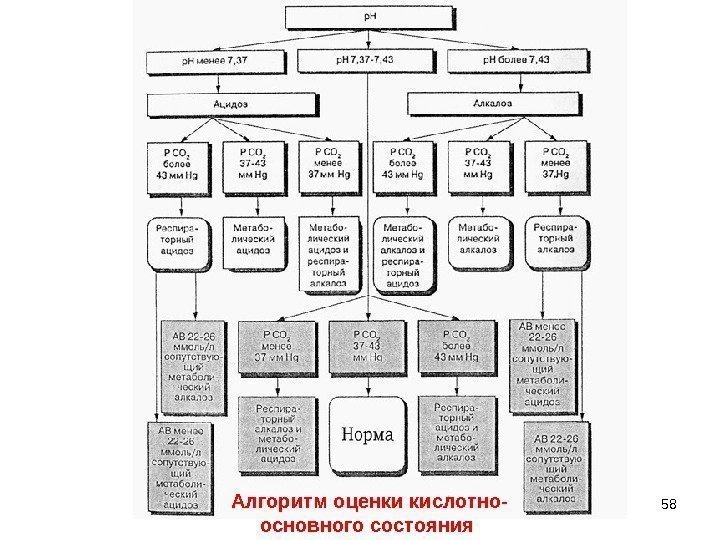
 58 Алгоритм оценки кислотно- основного состояния
58 Алгоритм оценки кислотно- основного состояния


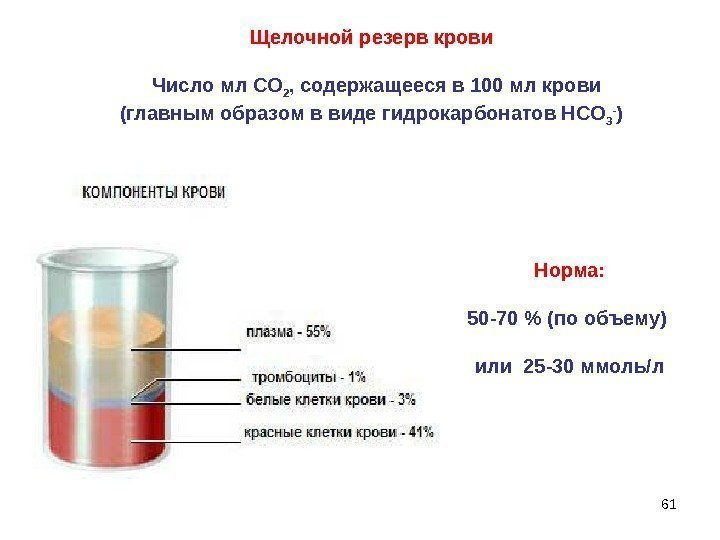
 61 Щелочной резерв крови Число мл СО 2 , содержащееся в 100 мл крови (главным образом в виде гидрокарбонатов НСО 3 — ) Норма: 50 -70 % (по объему) или 25 -30 ммоль/л
61 Щелочной резерв крови Число мл СО 2 , содержащееся в 100 мл крови (главным образом в виде гидрокарбонатов НСО 3 — ) Норма: 50 -70 % (по объему) или 25 -30 ммоль/л
 62 Клинический анализ желудочного содержимого. Кислотность желудочного сока – количество мл 0, 1 н раствора щелочи, необходимого для нейтрализации 100 мл профильтрованного желудочного содержимого. Норма – 40 -60 мл 0, 1 н Na. OH ; Пониженная кислотность – 30 мл 0, 1 н Na. OH ; Повышенная кислотность – 60 мл н Na. OH.
62 Клинический анализ желудочного содержимого. Кислотность желудочного сока – количество мл 0, 1 н раствора щелочи, необходимого для нейтрализации 100 мл профильтрованного желудочного содержимого. Норма – 40 -60 мл 0, 1 н Na. OH ; Пониженная кислотность – 30 мл 0, 1 н Na. OH ; Повышенная кислотность – 60 мл н Na. OH.
 63 Спасибо за внимание!
63 Спасибо за внимание!
