1 Лекция 6 Хинолин. Химия гетероциклических соединений


2016_bak_heterocycles_6.ppt
- Размер: 1.1 Мб
- Автор:
- Количество слайдов: 21
Описание презентации 1 Лекция 6 Хинолин. Химия гетероциклических соединений по слайдам
 1 Лекция 6 Хинолин. Химия гетероциклических соединений
1 Лекция 6 Хинолин. Химия гетероциклических соединений
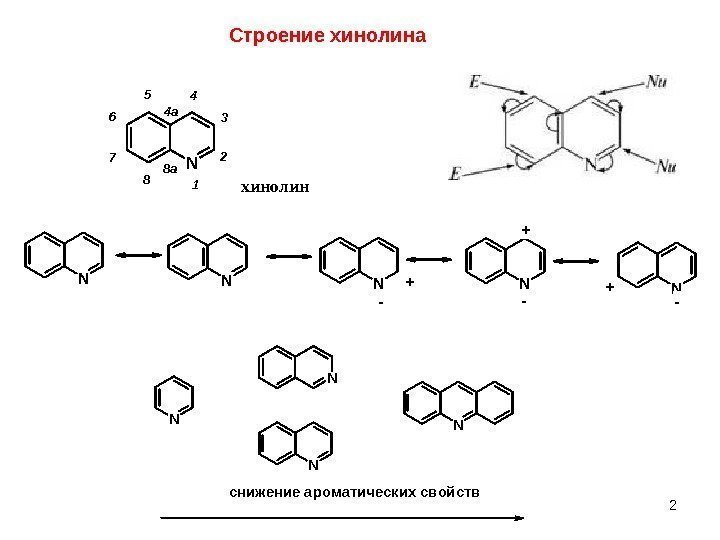
 2 Строение хинолина. N 1 2 3 45 6 7 8 4 a 8 a хинолин NNNNN — + — + N N снижение ароматических свойств
2 Строение хинолина. N 1 2 3 45 6 7 8 4 a 8 a хинолин NNNNN — + — + N N снижение ароматических свойств
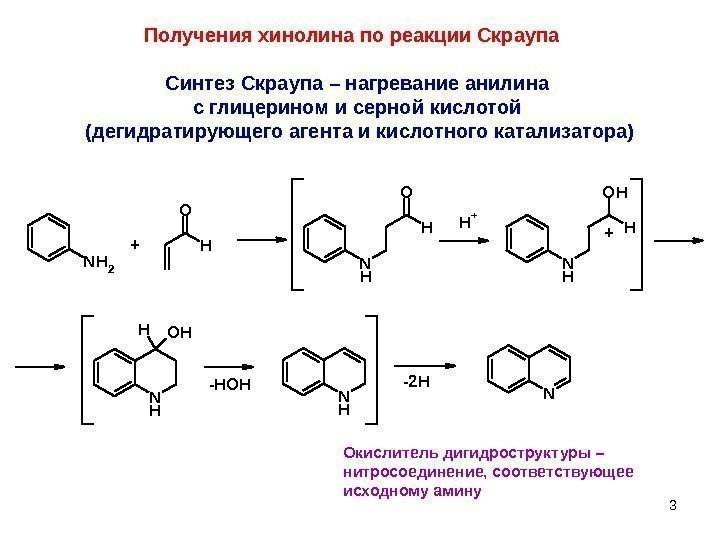
 3 Получения хинолина по реакции Скраупа. N NH 2 H O N H O HH+ N H OH H N H HOH N H + + -HOH-2 H Синтез Скраупа – нагревание анилина с глицерином и серной кислотой (дегидратирующего агента и кислотного катализатора) Окислитель дигидроструктуры – нитросоединение, соответствующее исходному амину
3 Получения хинолина по реакции Скраупа. N NH 2 H O N H O HH+ N H OH H N H HOH N H + + -HOH-2 H Синтез Скраупа – нагревание анилина с глицерином и серной кислотой (дегидратирующего агента и кислотного катализатора) Окислитель дигидроструктуры – нитросоединение, соответствующее исходному амину
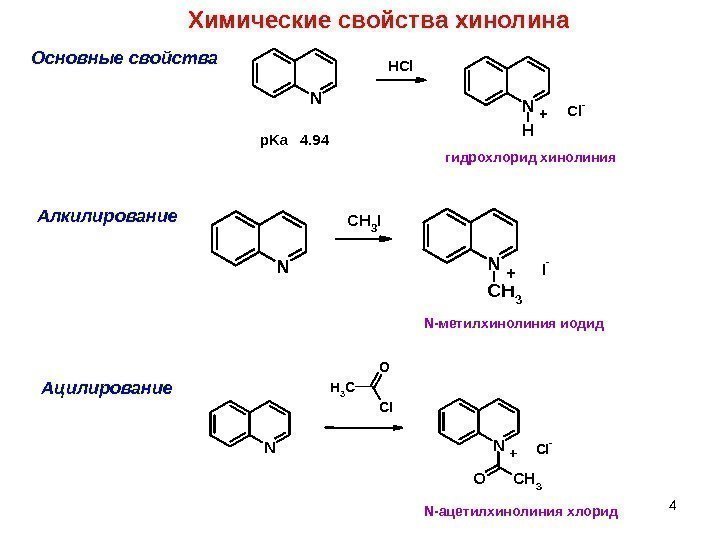
 4 Химические свойства хинолина Основные свойства Алкилирование. NN H C l -HCl + p. Ka 4. 94 NN CH 3 I — CH 3 I + гидрохлорид хинолиния N -метилхинолиния иодид NN OCH 3 Cl- CH 3 Cl O + N -ацетилхинолиния хлорид. Ацилирование
4 Химические свойства хинолина Основные свойства Алкилирование. NN H C l -HCl + p. Ka 4. 94 NN CH 3 I — CH 3 I + гидрохлорид хинолиния N -метилхинолиния иодид NN OCH 3 Cl- CH 3 Cl O + N -ацетилхинолиния хлорид. Ацилирование
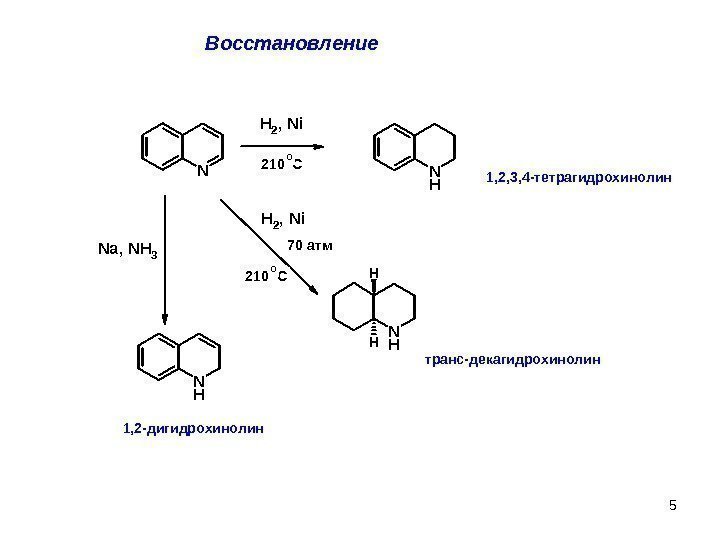
 5 Восстановление N H 2 , N i N HH HN a , N H 3 N H H 2 , N i 210 C 0 1, 2, 3, 4 -тетрагидрохинолин 1, 2 -дигидрохинолин 210 C 0 70 атм транс-декагидрохинолин
5 Восстановление N H 2 , N i N HH HN a , N H 3 N H H 2 , N i 210 C 0 1, 2, 3, 4 -тетрагидрохинолин 1, 2 -дигидрохинолин 210 C 0 70 атм транс-декагидрохинолин
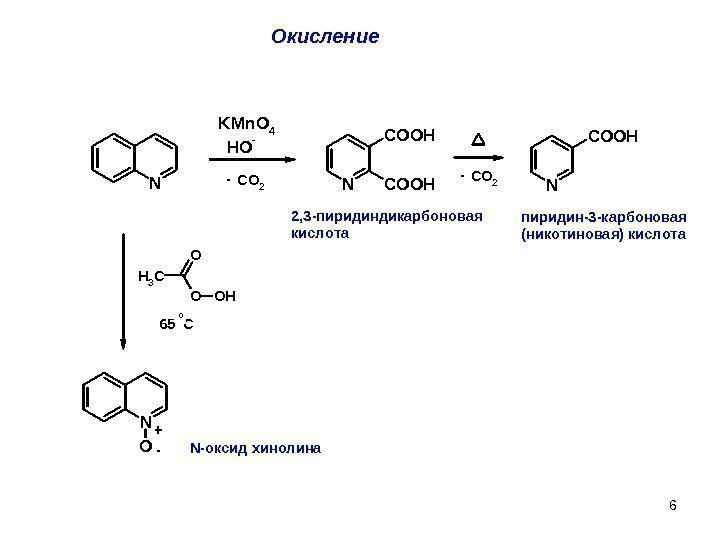
 6 Окисление N KMn. O 4 HO — N COOHN COOH CO 2 CH 3 O O OH N O — 2, 3 -пиридиндикарбоновая кислота — пиридин-3 -карбоновая (никотиновая ) кислота 65 C 0 + -N-оксид хинолина
6 Окисление N KMn. O 4 HO — N COOHN COOH CO 2 CH 3 O O OH N O — 2, 3 -пиридиндикарбоновая кислота — пиридин-3 -карбоновая (никотиновая ) кислота 65 C 0 + -N-оксид хинолина
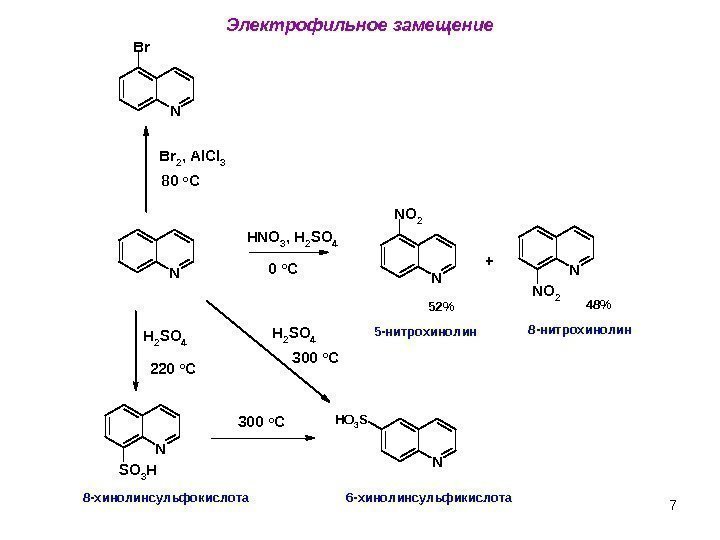
 7 Электрофильное замещение N H N O 3 , H 2 S O 4 NN O 2 N N O 2 B r 2 , A l C l 3 NBr H 2 S O 4 N S O 3 H H 2 S O 4 NH O 3 S 0 o C +80 o C 220 o C 52% 48% 5 -нитрохинолин 8 -нитрохинолин 300 o C 8 -хинолинсульфокислота 6 -хинолинсульфикислота
7 Электрофильное замещение N H N O 3 , H 2 S O 4 NN O 2 N N O 2 B r 2 , A l C l 3 NBr H 2 S O 4 N S O 3 H H 2 S O 4 NH O 3 S 0 o C +80 o C 220 o C 52% 48% 5 -нитрохинолин 8 -нитрохинолин 300 o C 8 -хинолинсульфокислота 6 -хинолинсульфикислота
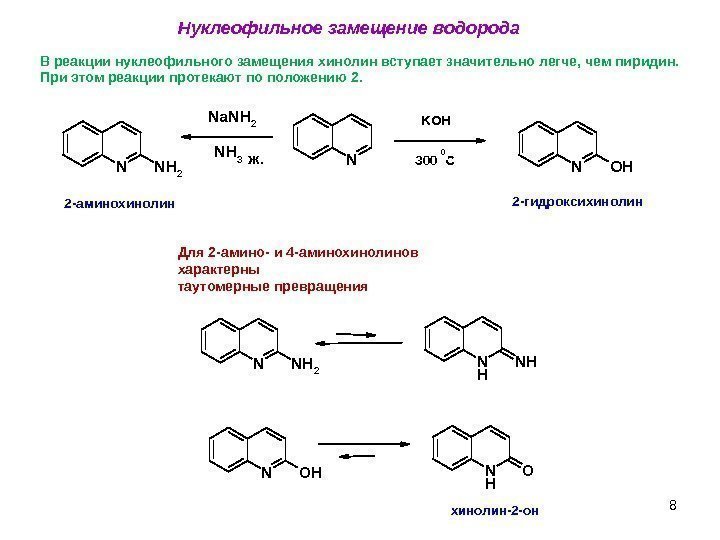
 8 Нуклеофильное замещение водорода Для 2 -амино- и 4 -аминохинолинов характерны таутомерные превращения NNNH 2 Na. NH 2 NH 3 NOHж. 2 -аминохинолин KOH 300 C 0 2 -гидроксихинолин. В реакции нуклеофильного замещения хинолин вступает значительно легче, чем пиридин. При этом реакции протекают по положению 2. N N H 2 N H N O H N H O хинолин-2 -он
8 Нуклеофильное замещение водорода Для 2 -амино- и 4 -аминохинолинов характерны таутомерные превращения NNNH 2 Na. NH 2 NH 3 NOHж. 2 -аминохинолин KOH 300 C 0 2 -гидроксихинолин. В реакции нуклеофильного замещения хинолин вступает значительно легче, чем пиридин. При этом реакции протекают по положению 2. N N H 2 N H N O H N H O хинолин-2 -он
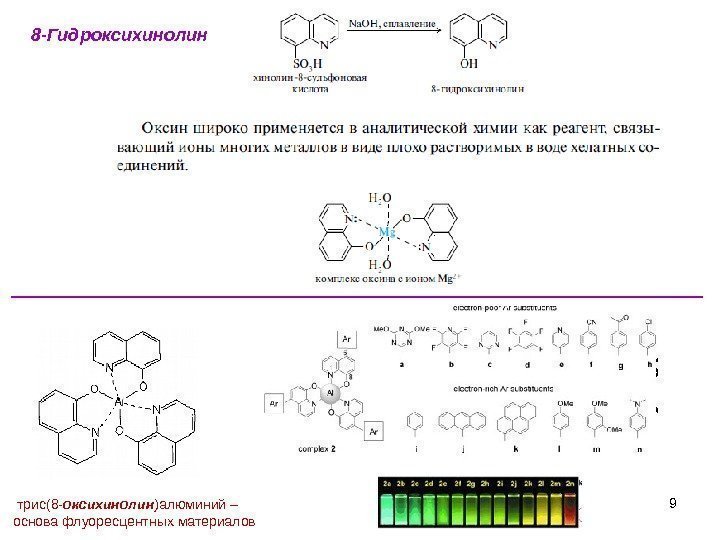
 98 -Гидроксихинолин трис(8 — оксихинолин )алюминий– основафлуоресцентныхматериалов
98 -Гидроксихинолин трис(8 — оксихинолин )алюминий– основафлуоресцентныхматериалов
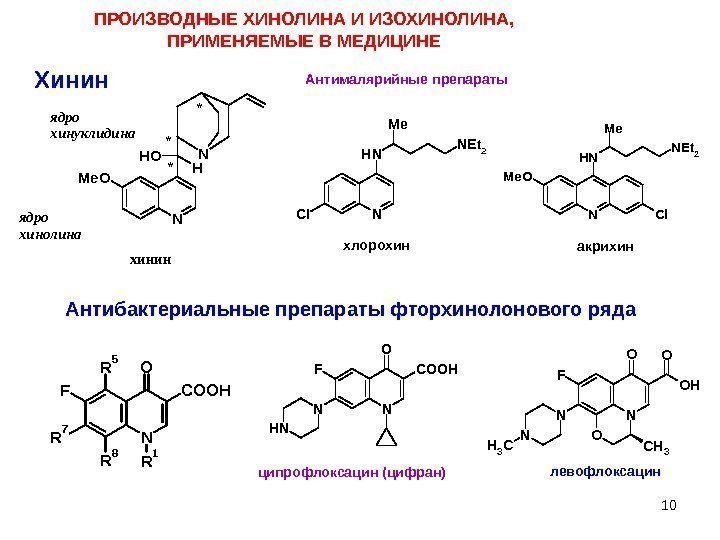
 10 Хинин. N N Me. O H OH я дро хинолина ** * я дро хинуклидина хинин. ПРОИЗВОДНЫЕ ХИНОЛИНА И ИЗОХИНОЛИНА, ПРИМЕНЯЕМЫЕ В МЕДИЦИНЕ Антималярийные препараты NNH M e N E t 2 Cl. M e O N Cl NH M e N E t 2 хлорохин акрихин Антибактериальные препараты фторхинолонового ряда N F R 7 R 1 O COOH R 8 R 5 N F N O COOH NH ципрофлоксацин (цифран) F N OO OH NCH 3 O N CH 3 левофлоксацин
10 Хинин. N N Me. O H OH я дро хинолина ** * я дро хинуклидина хинин. ПРОИЗВОДНЫЕ ХИНОЛИНА И ИЗОХИНОЛИНА, ПРИМЕНЯЕМЫЕ В МЕДИЦИНЕ Антималярийные препараты NNH M e N E t 2 Cl. M e O N Cl NH M e N E t 2 хлорохин акрихин Антибактериальные препараты фторхинолонового ряда N F R 7 R 1 O COOH R 8 R 5 N F N O COOH NH ципрофлоксацин (цифран) F N OO OH NCH 3 O N CH 3 левофлоксацин
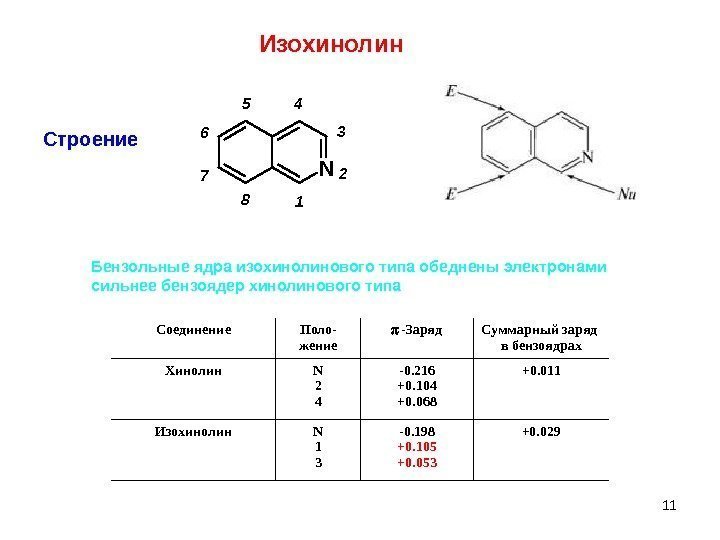
 11 Строение. N 1 2 3 45 6 7 8 Бензольные ядра изохинолинового типа обеднены электронами сильнее бензоядер хинолинового типа Соединение Поло- жение -Заряд Суммарный заряд в бензоядрах Хинолин N 2 4 -0. 216 +0. 104 +0. 068 +0. 011 Изохинолин N 1 3 -0. 198 +0. 105 +0. 053 +0. 029 Изохинолин
11 Строение. N 1 2 3 45 6 7 8 Бензольные ядра изохинолинового типа обеднены электронами сильнее бензоядер хинолинового типа Соединение Поло- жение -Заряд Суммарный заряд в бензоядрах Хинолин N 2 4 -0. 216 +0. 104 +0. 068 +0. 011 Изохинолин N 1 3 -0. 198 +0. 105 +0. 053 +0. 029 Изохинолин
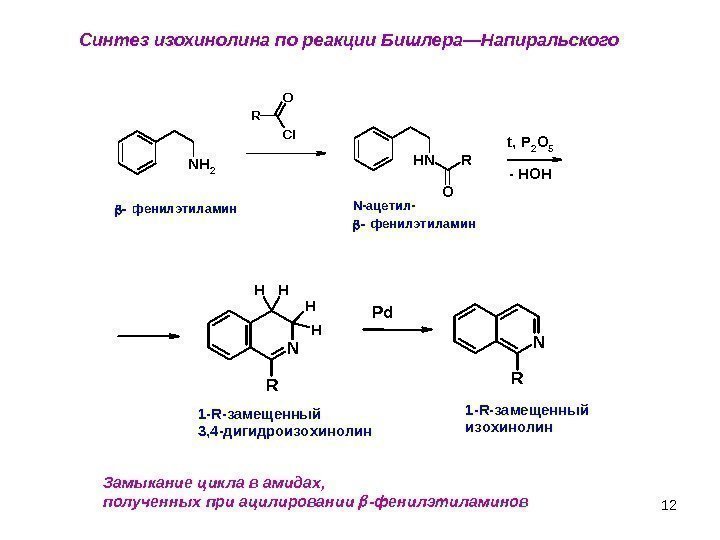
 12 Синтез изохинолина по реакции Бишлера—Напиральского Замыкание цикла в амидах, полученных при ацилировании -фенилэтиламинов NH O R t, P 2 O 5 NH 2 R Cl. O ф е н и л э т и л а м и н — HOH N-ацетил- N R HH H H Pd 1 -R-замещенный 3, 4 -дигидроизохинолин 1 -R-замещенный изохинолин
12 Синтез изохинолина по реакции Бишлера—Напиральского Замыкание цикла в амидах, полученных при ацилировании -фенилэтиламинов NH O R t, P 2 O 5 NH 2 R Cl. O ф е н и л э т и л а м и н — HOH N-ацетил- N R HH H H Pd 1 -R-замещенный 3, 4 -дигидроизохинолин 1 -R-замещенный изохинолин
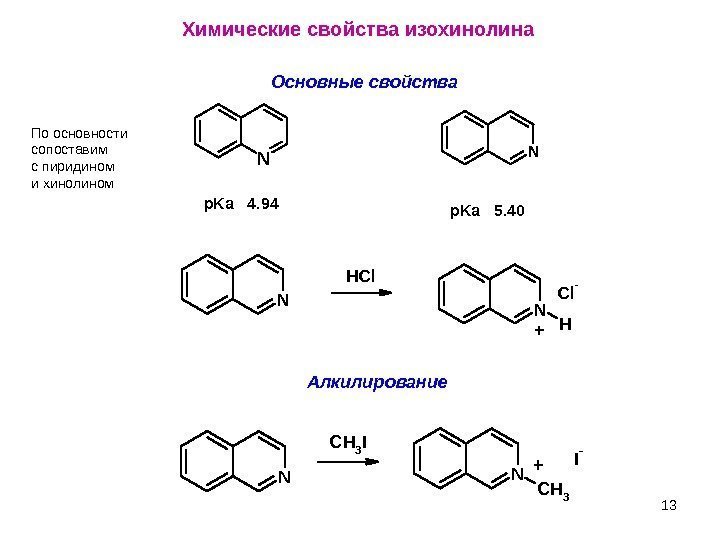
 13 Химические свойства изохинолина Основные свойства. N N p. Ka 4. 94 p. Ka 5. 40 NN H Cl -HCl + Алкилирование N N C H 3 I -C H 3 I +Поосновности сопоставим спиридином ихинолином
13 Химические свойства изохинолина Основные свойства. N N p. Ka 4. 94 p. Ka 5. 40 NN H Cl -HCl + Алкилирование N N C H 3 I -C H 3 I +Поосновности сопоставим спиридином ихинолином
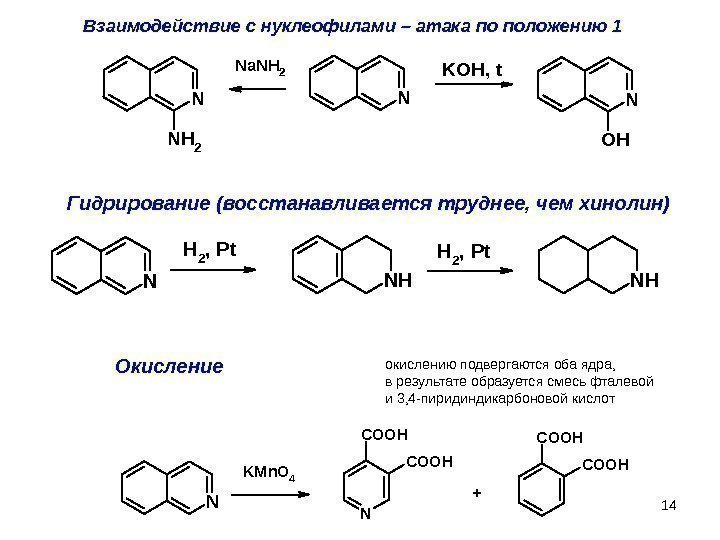
 14 N H 2, Pt NHГидрирование (восстанавливается труднее, чем хинолин) Окисление NN OH N NH 2 Na. NH 2 KOH, t. Взаимодействие с нуклеофилами – атака по положению 1 окислениюподвергаютсяобаядра, врезультатеобразуетсясмесьфталевой и 3, 4 -пиридиндикарбоновойкислот N N COOHKMn. O 4 COOH +
14 N H 2, Pt NHГидрирование (восстанавливается труднее, чем хинолин) Окисление NN OH N NH 2 Na. NH 2 KOH, t. Взаимодействие с нуклеофилами – атака по положению 1 окислениюподвергаютсяобаядра, врезультатеобразуетсясмесьфталевой и 3, 4 -пиридиндикарбоновойкислот N N COOHKMn. O 4 COOH +
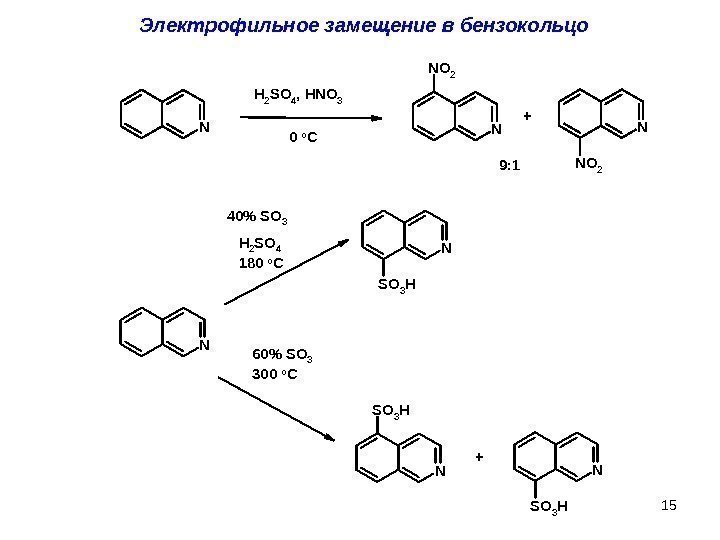
 15 N N S O 3 HNS O 3 H 40% SO 3 H 2 SO 4 180 o C +60% SO 3 300 o CЭлектрофильное замещение в бензокольцо. NN NO 2 H 2 SO 4, HNO 3 N NO 2 0 o. C + 9:
15 N N S O 3 HNS O 3 H 40% SO 3 H 2 SO 4 180 o C +60% SO 3 300 o CЭлектрофильное замещение в бензокольцо. NN NO 2 H 2 SO 4, HNO 3 N NO 2 0 o. C + 9:
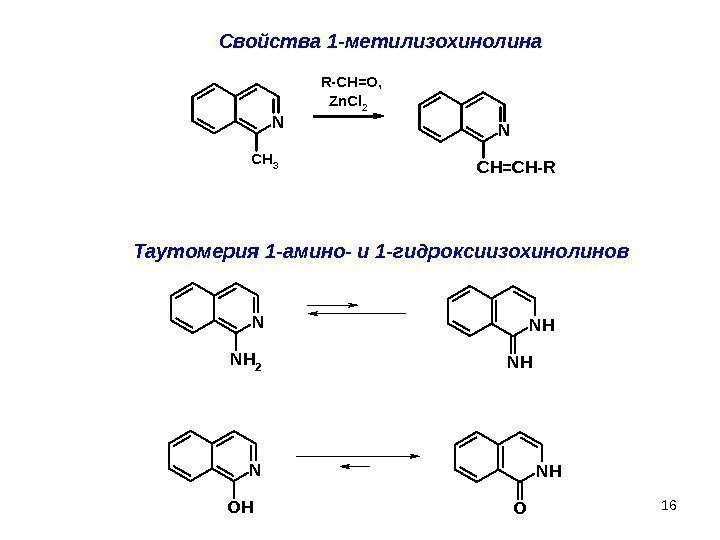
 16 Свойства 1 — метилизохинолина Таутомерия 1 — амино- и 1 -гидроксиизохинолинов. N OH N NH 2 NH NH NH ON CH 3 N C H = C H — R Zn. Cl 2 R-CH=O,
16 Свойства 1 — метилизохинолина Таутомерия 1 — амино- и 1 -гидроксиизохинолинов. N OH N NH 2 NH NH NH ON CH 3 N C H = C H — R Zn. Cl 2 R-CH=O,
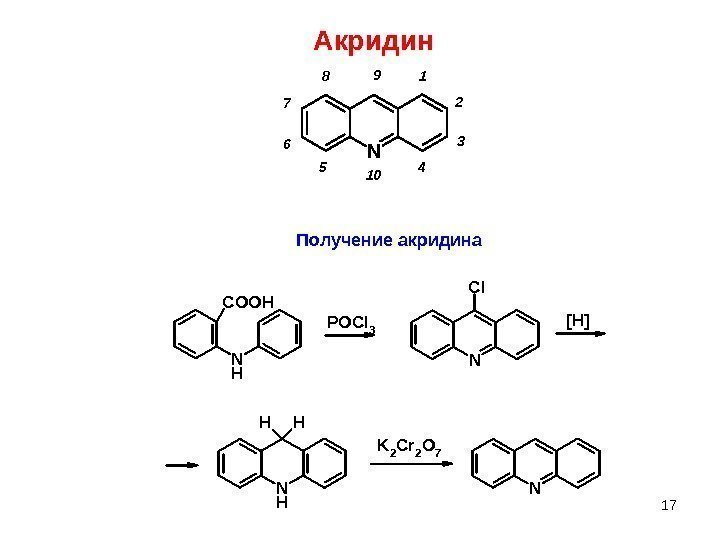
 Акридин N 1 2 3 456 7 8 9 10 NK 2 C r 2 O 7 N HH HN HC O O H P O C l 3 NCl [H]Получение акридина
Акридин N 1 2 3 456 7 8 9 10 NK 2 C r 2 O 7 N HH HN HC O O H P O C l 3 NCl [H]Получение акридина
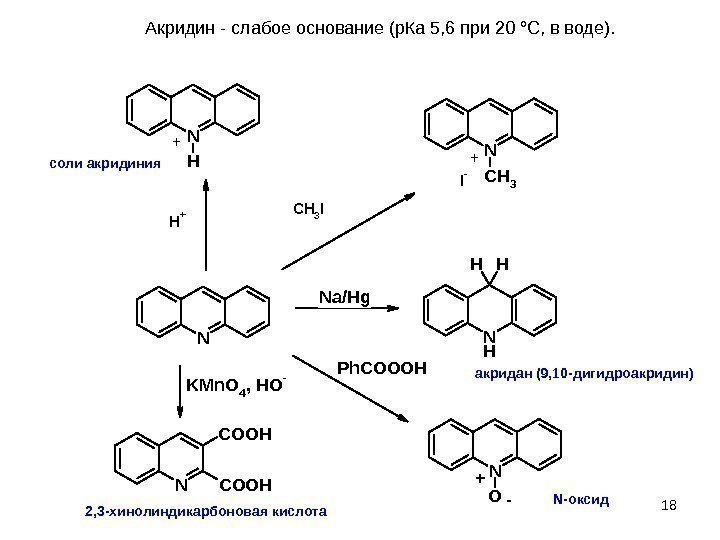
 18 NN H HH KMn. O 4, HO — N COOH Ph. COOOH N O N H N CH 3 H+CH 3 I I- Na/Hg + — + +Акридин-слабоеоснование(р. Ка 5, 6 при 20°С, вводе). акридан (9, 10 -дигидроакридин) 2, 3 -хинолиндикарбоновая кислота N-оксидсоли акридиния
18 NN H HH KMn. O 4, HO — N COOH Ph. COOOH N O N H N CH 3 H+CH 3 I I- Na/Hg + — + +Акридин-слабоеоснование(р. Ка 5, 6 при 20°С, вводе). акридан (9, 10 -дигидроакридин) 2, 3 -хинолиндикарбоновая кислота N-оксидсоли акридиния
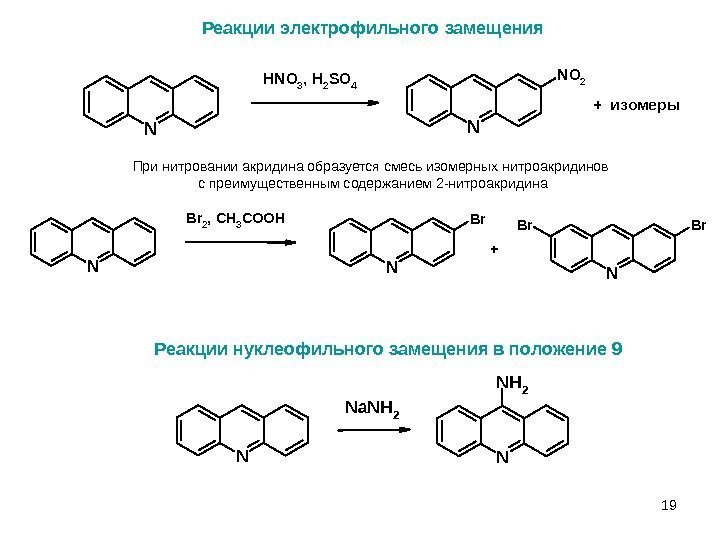
 19 Принитрованииакридинаобразуетсясмесьизомерныхнитроакридинов спреимущественнымсодержанием 2 -нитроакридина Реакции электрофильного замещения N N N O 2 H N O 3 , H 2 S O 4 + изомеры. N Br 2, CH 3 COOH N Br. Br + 1919 Реакции нуклеофильного замещения в положение 9 N Na. NH 2 N NH
19 Принитрованииакридинаобразуетсясмесьизомерныхнитроакридинов спреимущественнымсодержанием 2 -нитроакридина Реакции электрофильного замещения N N N O 2 H N O 3 , H 2 S O 4 + изомеры. N Br 2, CH 3 COOH N Br. Br + 1919 Реакции нуклеофильного замещения в положение 9 N Na. NH 2 N NH
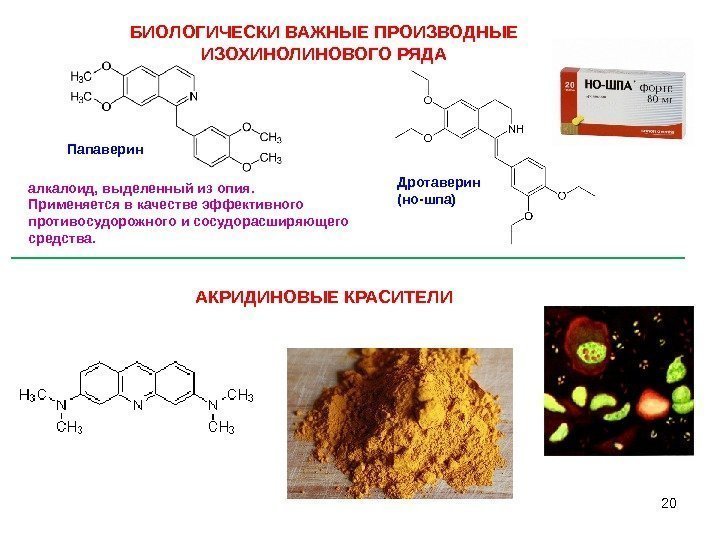
 20 алкалоид, выделенный из опия. Применяется в качестве эффективного противосудорожного и сосудорасширяющего средства. БИОЛОГИЧЕСКИ ВАЖНЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНОВОГО РЯДА Папаверин Дротаверин (но-шпа) АКРИДИНОВЫЕ КРАСИТЕЛИ
20 алкалоид, выделенный из опия. Применяется в качестве эффективного противосудорожного и сосудорасширяющего средства. БИОЛОГИЧЕСКИ ВАЖНЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНОВОГО РЯДА Папаверин Дротаверин (но-шпа) АКРИДИНОВЫЕ КРАСИТЕЛИ
 21 18 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической химии УГТУ-УПИ Учебно-методический комплекс подготовлен на кафедре органической и биомолекулярной химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
21 18 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической химии УГТУ-УПИ Учебно-методический комплекс подготовлен на кафедре органической и биомолекулярной химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
