1 Лекция 3 -II Карбоновые кислоты и их


























3.2._karbonovye_k-ty.ppt
- Размер: 6.8 Мб
- Автор:
- Количество слайдов: 106
Описание презентации 1 Лекция 3 -II Карбоновые кислоты и их по слайдам
 1 Лекция 3 -II Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Кафедра общей и медицинской химии
1 Лекция 3 -II Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Кафедра общей и медицинской химии
 2 Карбоновые кислоты – органические соединения, содержащие СООН- карбоксильную группу. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ. классификация карбоновых кислот: а) по строению углеводородного радикала: — предельные (уксусная, стеариновая) — непредельные (акриловая, олеиновая, линолевая) — ароматические (бензойная, фенилуксусная) — гетероциклические (никотиновая) — алициклические б) по числу карбоксильных групп: — монокарбоновые (муравьиная) — дикарбоновые (щавелевая) — поликарбоновые (аконитовая)
2 Карбоновые кислоты – органические соединения, содержащие СООН- карбоксильную группу. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ. классификация карбоновых кислот: а) по строению углеводородного радикала: — предельные (уксусная, стеариновая) — непредельные (акриловая, олеиновая, линолевая) — ароматические (бензойная, фенилуксусная) — гетероциклические (никотиновая) — алициклические б) по числу карбоксильных групп: — монокарбоновые (муравьиная) — дикарбоновые (щавелевая) — поликарбоновые (аконитовая)
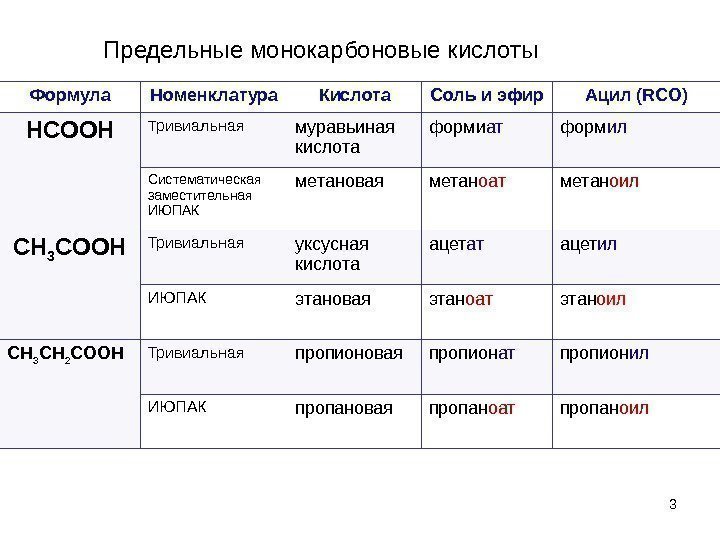
 3 Формула Номенклатура Кислота Соль и эфир Ацил ( RCO) HCOOH Т ривиальная муравьиная кислота форми ат форм ил Систематическая заместительная ИЮПАК метановая метан оат метан оил CH 3 COOH Тривиальная уксусная кислота ацет ат ацет ил ИЮПАК этановая этан оат этан о ил CH 3 CH 2 COOH Тривиальная пропионовая пропион ат пропион ил ИЮПАК пропановая пропан оат пропан оил. Предельные монокарбоновые кислоты
3 Формула Номенклатура Кислота Соль и эфир Ацил ( RCO) HCOOH Т ривиальная муравьиная кислота форми ат форм ил Систематическая заместительная ИЮПАК метановая метан оат метан оил CH 3 COOH Тривиальная уксусная кислота ацет ат ацет ил ИЮПАК этановая этан оат этан о ил CH 3 CH 2 COOH Тривиальная пропионовая пропион ат пропион ил ИЮПАК пропановая пропан оат пропан оил. Предельные монокарбоновые кислоты
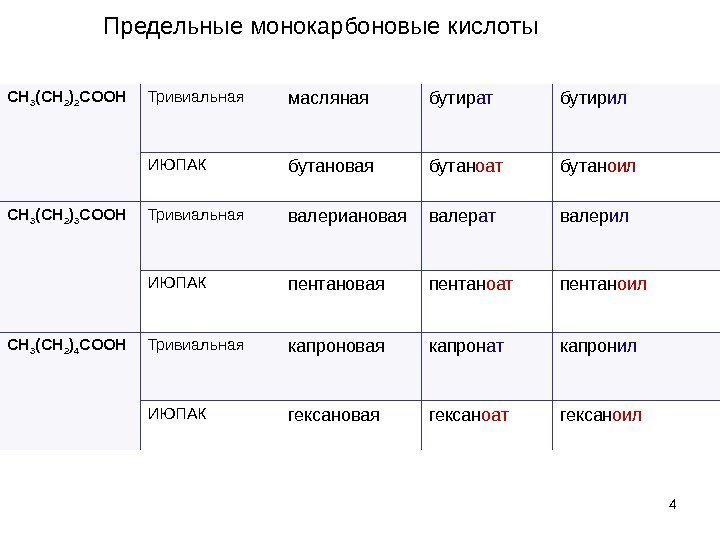
 4 CH 3 (CH 2 ) 2 COOH Тривиальная масляная бутир ат бутир ил ИЮПАК бутановая бутан оат бутан оил CH 3 (CH 2 ) 3 COOH Тривиальная валериановая валер ат валер ил ИЮПАК пентановая пентан оат пентан оил CH 3 (CH 2 ) 4 COOH Тривиальная капроновая капрон ат капрон ил ИЮПАК гексановая гексан оат гексан оил. Предельные монокарбоновые кислоты
4 CH 3 (CH 2 ) 2 COOH Тривиальная масляная бутир ат бутир ил ИЮПАК бутановая бутан оат бутан оил CH 3 (CH 2 ) 3 COOH Тривиальная валериановая валер ат валер ил ИЮПАК пентановая пентан оат пентан оил CH 3 (CH 2 ) 4 COOH Тривиальная капроновая капрон ат капрон ил ИЮПАК гексановая гексан оат гексан оил. Предельные монокарбоновые кислоты
 Высшие предельные карбоновые кислоты C 15 H 31 COOH CH 3 (CH 2 )14 COOH 1. Тривиальная номенклатура — пальмитиновая , соли- пальмитаты , ацил- пальмитоил 2. Систематическая заместительная номенклатура- ИЮПАК — гексадекановая
Высшие предельные карбоновые кислоты C 15 H 31 COOH CH 3 (CH 2 )14 COOH 1. Тривиальная номенклатура — пальмитиновая , соли- пальмитаты , ацил- пальмитоил 2. Систематическая заместительная номенклатура- ИЮПАК — гексадекановая
 C 17 H 35 COOH CH 3 (CH 2 )16 COOH 1. Тривиальная номенклатура — стеариновая , соли- стеараты , ацил -стеароил 2. Систематическая заместительная н-ра ИЮПАК- октадекановая 6 Высшие предельные карбоновые кислоты
C 17 H 35 COOH CH 3 (CH 2 )16 COOH 1. Тривиальная номенклатура — стеариновая , соли- стеараты , ацил -стеароил 2. Систематическая заместительная н-ра ИЮПАК- октадекановая 6 Высшие предельные карбоновые кислоты
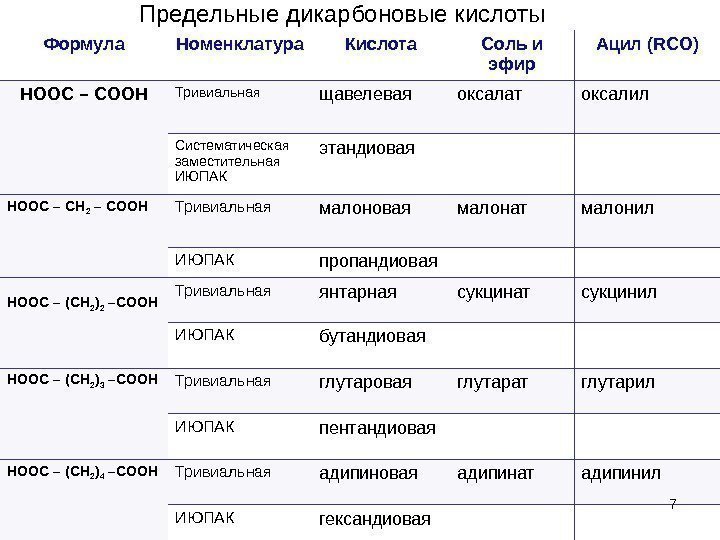
 7 Формула Номенклатура Кислота Соль и эфир Ацил ( RCO) HOOC – COOH Тривиальная щавелевая оксалат оксалил Систематическая заместительная ИЮПАК этандиовая HOOC – CH 2 – COOH Тривиальная малоновая малонат малонил ИЮПАК пропандиовая HOOC – (CH 2 ) 2 –COOH Тривиальная янтарная сукцинат сукцинил ИЮПАК бутандиовая HOOC – (CH 2 ) 3 –COOH Тривиальная глутаровая глутарат глутарил ИЮПАК пентандиовая HOOC – (CH 2 ) 4 –COOH Тривиальная адипиновая адипинат адипинил ИЮПАК гександиовая 7 Предельные дикарбоновые кислоты
7 Формула Номенклатура Кислота Соль и эфир Ацил ( RCO) HOOC – COOH Тривиальная щавелевая оксалат оксалил Систематическая заместительная ИЮПАК этандиовая HOOC – CH 2 – COOH Тривиальная малоновая малонат малонил ИЮПАК пропандиовая HOOC – (CH 2 ) 2 –COOH Тривиальная янтарная сукцинат сукцинил ИЮПАК бутандиовая HOOC – (CH 2 ) 3 –COOH Тривиальная глутаровая глутарат глутарил ИЮПАК пентандиовая HOOC – (CH 2 ) 4 –COOH Тривиальная адипиновая адипинат адипинил ИЮПАК гександиовая 7 Предельные дикарбоновые кислоты
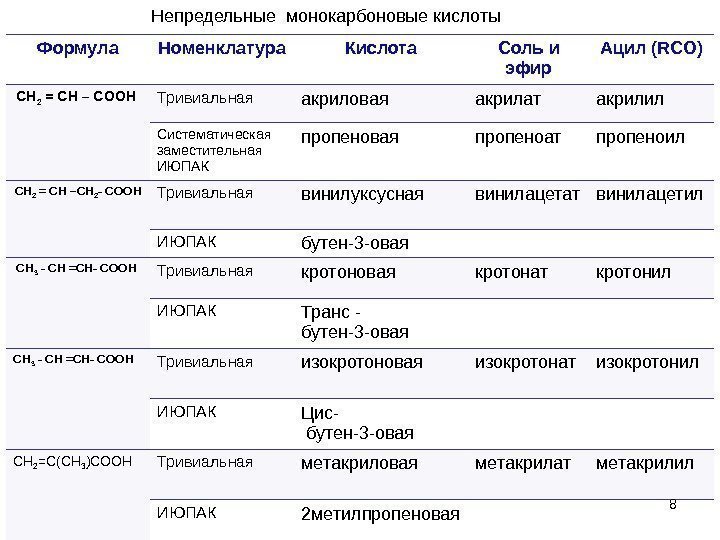
 8 Формула Номенклатура Кислота Соль и эфир Ацил ( RCO) CH 2 = CH – COOH Тривиальная акриловая акрилат акрилил Систематическая заместительная ИЮПАК пропеновая пропеноат пропеноил CH 2 = CH –CH 2 — COOH Тривиальная винилуксусная винилацетат винилацетил ИЮПАК бутен-3 -овая CH 3 — CH = CH- COOH Тривиальная кротоновая кротонат кротонил ИЮПАК Транс — бутен-3 -овая CH 3 — CH = CH- COOH Тривиальная изокротоновая изокротонат изокротонил ИЮПАК Цис- бутен-3 -овая СН 2 =С(СН 3 )СООН Тривиальная метакриловая метакрилат метакрилил ИЮПАК 2 метилпропеновая 8 Непредельные монокарбоновые кислоты
8 Формула Номенклатура Кислота Соль и эфир Ацил ( RCO) CH 2 = CH – COOH Тривиальная акриловая акрилат акрилил Систематическая заместительная ИЮПАК пропеновая пропеноат пропеноил CH 2 = CH –CH 2 — COOH Тривиальная винилуксусная винилацетат винилацетил ИЮПАК бутен-3 -овая CH 3 — CH = CH- COOH Тривиальная кротоновая кротонат кротонил ИЮПАК Транс — бутен-3 -овая CH 3 — CH = CH- COOH Тривиальная изокротоновая изокротонат изокротонил ИЮПАК Цис- бутен-3 -овая СН 2 =С(СН 3 )СООН Тривиальная метакриловая метакрилат метакрилил ИЮПАК 2 метилпропеновая 8 Непредельные монокарбоновые кислоты
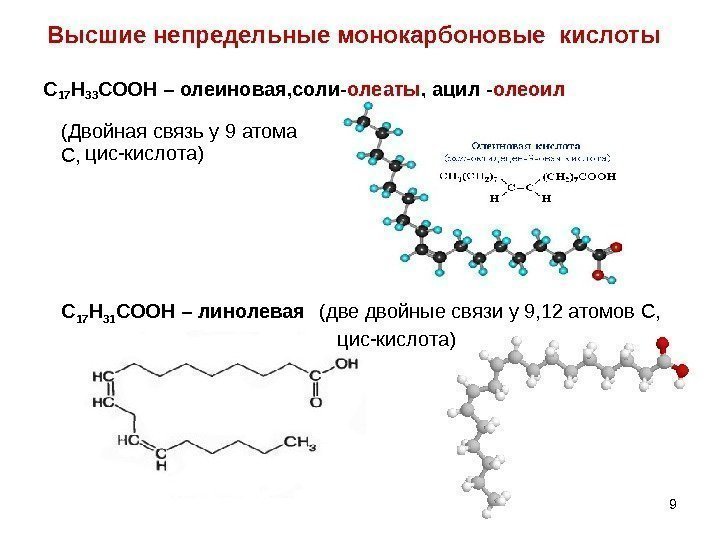
 Высшие непредельные монокарбоновые кислоты С 17 Н 33 СООН – олеиновая, соли- олеаты , ацил — олеоил 99 С 17 Н 31 СООН – линолевая (две двойные связи у 9, 12 атомов С, (Двойная связь у 9 атома С, цис-кислота)
Высшие непредельные монокарбоновые кислоты С 17 Н 33 СООН – олеиновая, соли- олеаты , ацил — олеоил 99 С 17 Н 31 СООН – линолевая (две двойные связи у 9, 12 атомов С, (Двойная связь у 9 атома С, цис-кислота)
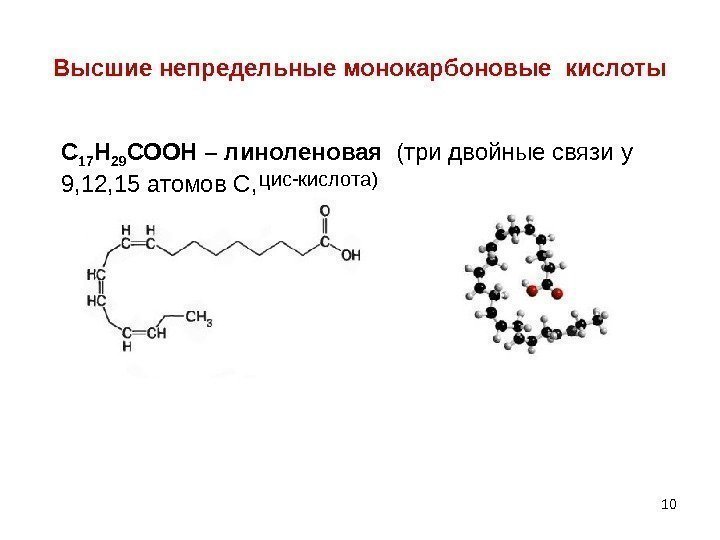
 10 Высшие непредельные монокарбоновые кислоты С 17 Н 29 СООН – линоленовая (три двойные связи у 9, 12, 15 атомов С, цис-кислота)
10 Высшие непредельные монокарбоновые кислоты С 17 Н 29 СООН – линоленовая (три двойные связи у 9, 12, 15 атомов С, цис-кислота)
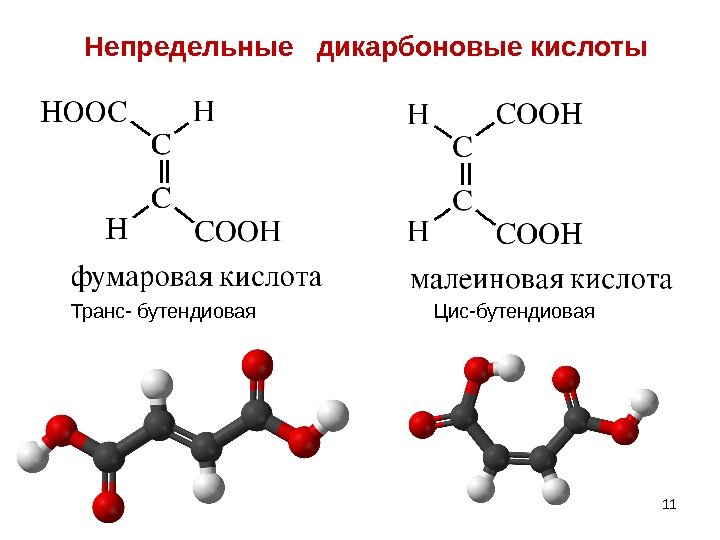
 11 Непредельные дикарбоновые кислоты 11 Транс- бутендиовая Цис-бутендиовая
11 Непредельные дикарбоновые кислоты 11 Транс- бутендиовая Цис-бутендиовая
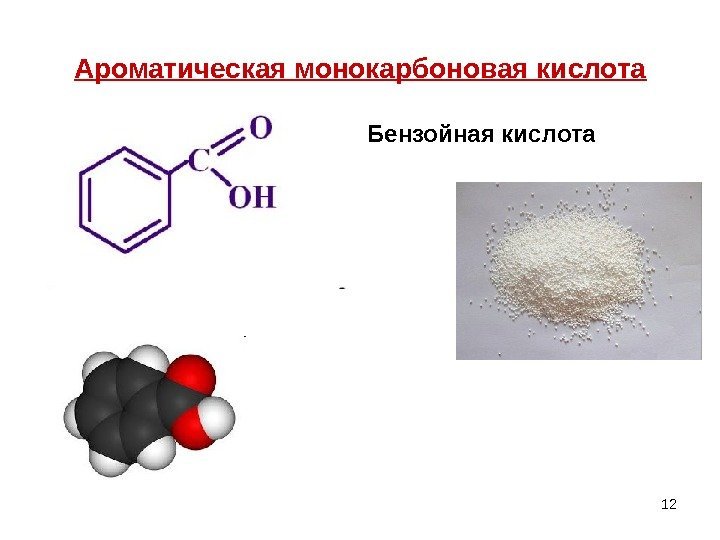
 12 Ароматическая монокарбоновая кислота Бензойная кислота
12 Ароматическая монокарбоновая кислота Бензойная кислота
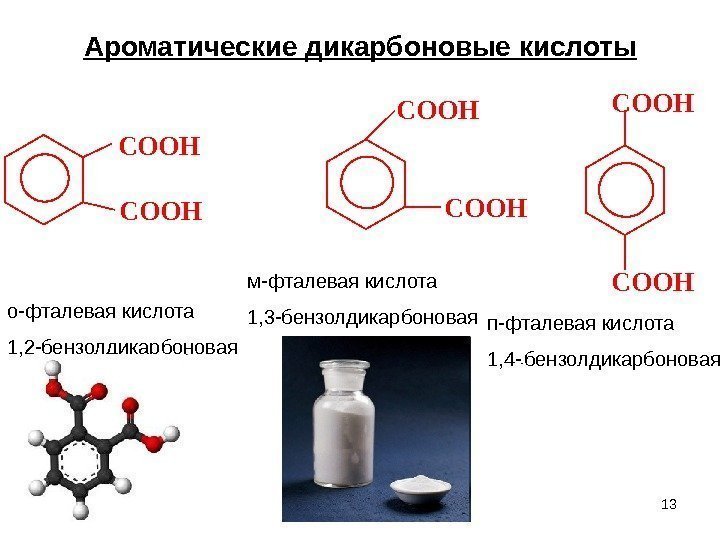
 13 Ароматические дикарбоновые кислоты. COOH COOH о-фталевая кислота 1, 2 -бензолдикарбоновая м-фталевая кислота 1, 3 -бензолдикарбоновая п-фталевая кислота 1, 4 — — бензолдикарбоновая
13 Ароматические дикарбоновые кислоты. COOH COOH о-фталевая кислота 1, 2 -бензолдикарбоновая м-фталевая кислота 1, 3 -бензолдикарбоновая п-фталевая кислота 1, 4 — — бензолдикарбоновая
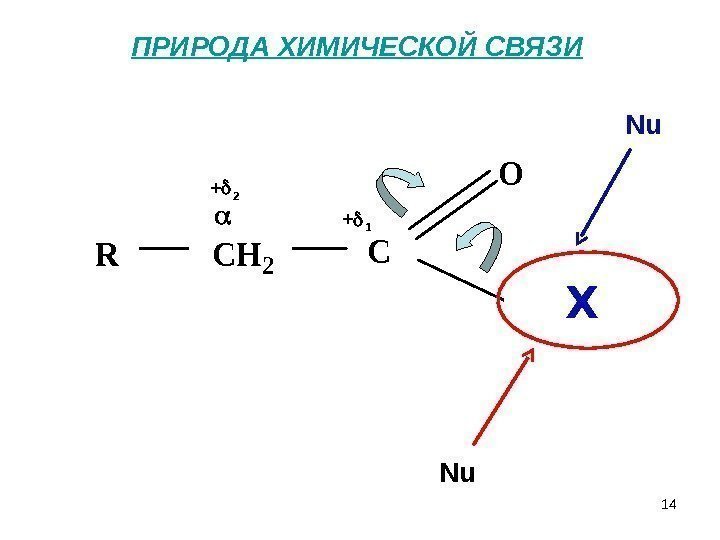
 14 ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ + 1+ 2 RCH 2 C O OH H Nu Nu X
14 ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ + 1+ 2 RCH 2 C O OH H Nu Nu X
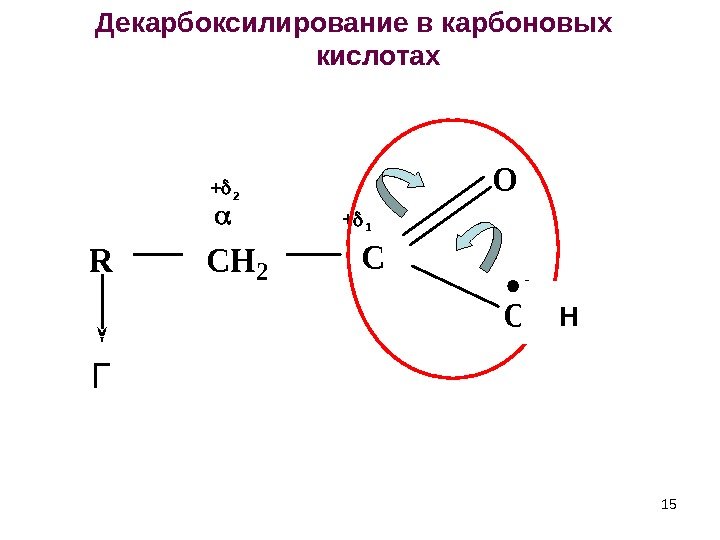
 ГRCH 2 C O OH 15 Декарбоксилирование в карбоновых кислотах + 1+ 2 15 Н
ГRCH 2 C O OH 15 Декарбоксилирование в карбоновых кислотах + 1+ 2 15 Н
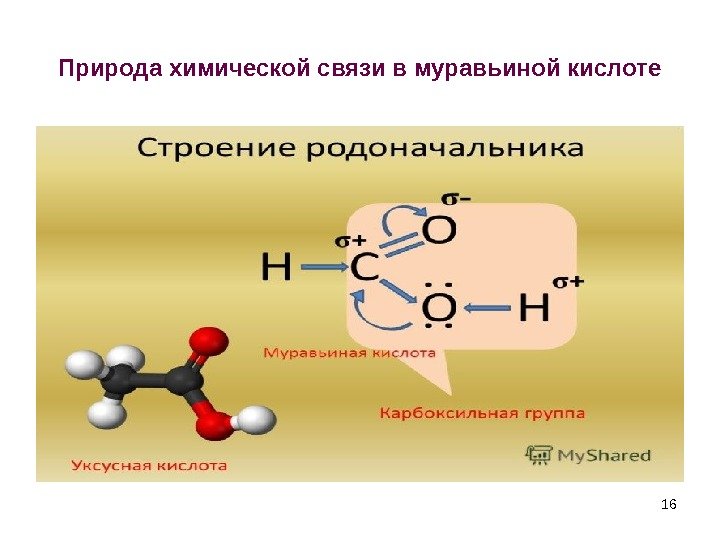
 Природа химической связи в муравьиной кислоте
Природа химической связи в муравьиной кислоте
 17 Большинство химических реакций карбоновых кислот можно разделить на 4 типа: I. Реакции, связанные с разрывом связи О-Н — кислотные свойства, образование солей. II. Реакции S N – образование сложных эфиров, амидов, ангидридов и т. д. — функциональных производных карбоновых кислот III. Реакции декарбоксилирования (потеря СО 2 ) IV. Реакции с участием R ( особенно по α -С атому )
17 Большинство химических реакций карбоновых кислот можно разделить на 4 типа: I. Реакции, связанные с разрывом связи О-Н — кислотные свойства, образование солей. II. Реакции S N – образование сложных эфиров, амидов, ангидридов и т. д. — функциональных производных карбоновых кислот III. Реакции декарбоксилирования (потеря СО 2 ) IV. Реакции с участием R ( особенно по α -С атому )
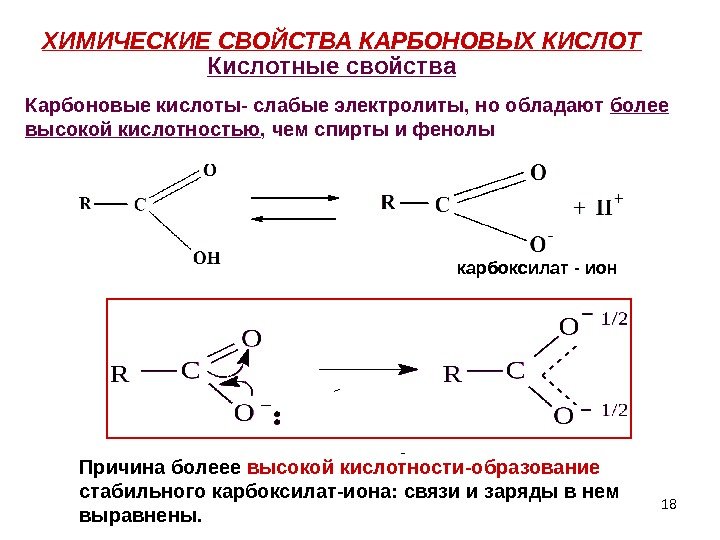
 18 ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ карбоксилат — ион — Кислотные свойства Карбоновые кислоты- слабые электролиты, но обладают более высокой кислотностью , чем спирты и фенолы Причина болеее высокой кислотности-образование стабильного карбоксилат-иона: связи и заряды в нем выравнены.
18 ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ карбоксилат — ион — Кислотные свойства Карбоновые кислоты- слабые электролиты, но обладают более высокой кислотностью , чем спирты и фенолы Причина болеее высокой кислотности-образование стабильного карбоксилат-иона: связи и заряды в нем выравнены.
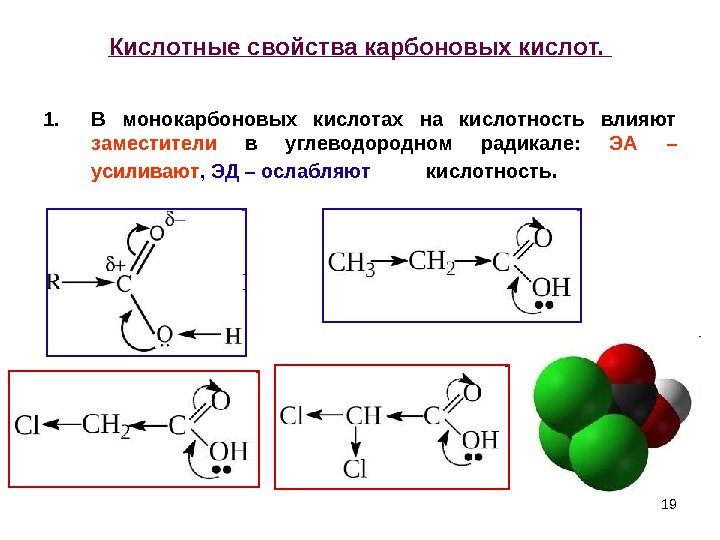
 19 Кислотные свойства карбоновых кислот. 1. В монокарбоновых кислотах на кислотность влияют заместители в углеводородном радикале: ЭА – усиливают , ЭД – ослабляют кислотность.
19 Кислотные свойства карбоновых кислот. 1. В монокарбоновых кислотах на кислотность влияют заместители в углеводородном радикале: ЭА – усиливают , ЭД – ослабляют кислотность.
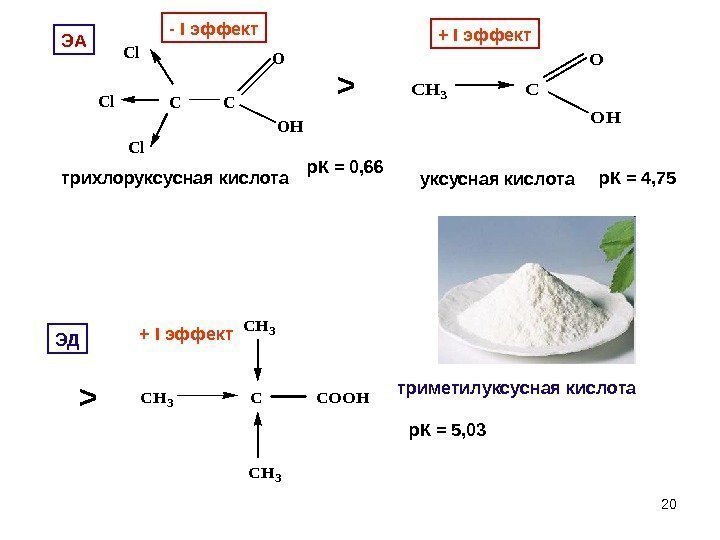
 20 C C Cl Cl Cl O OH- I эффект трихлоруксусная кислота р. К = 0, 66 > CH 3 C O OH + I эффект уксусная кислота р. К = 4, 75 > CH 3 CCOOH CH 3 + I эффект триметилуксусная кислота р. К = 5, 03 ЭА ЭД
20 C C Cl Cl Cl O OH- I эффект трихлоруксусная кислота р. К = 0, 66 > CH 3 C O OH + I эффект уксусная кислота р. К = 4, 75 > CH 3 CCOOH CH 3 + I эффект триметилуксусная кислота р. К = 5, 03 ЭА ЭД
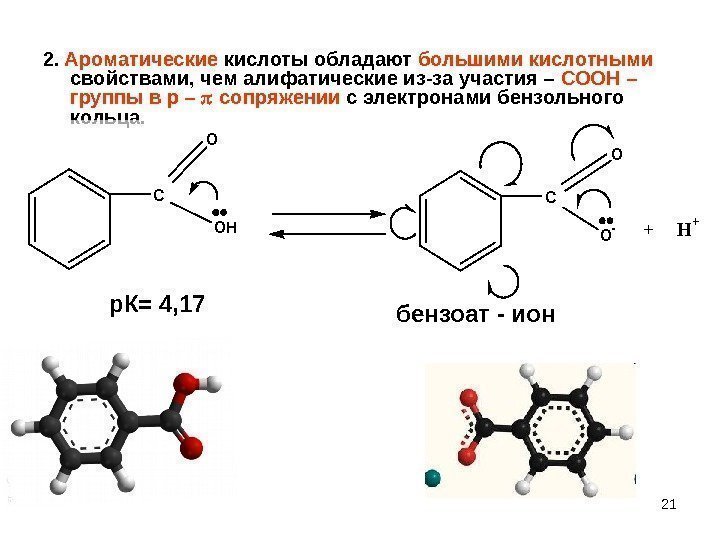
 212. Ароматические кислоты обладают большими кислотными свойствами, чем алифатические из-за участия – СООН – группы в р – сопряжении с электронами бензольного кольца. C O OH C O O-+ H+ бензоат — ионр. К= 4,
212. Ароматические кислоты обладают большими кислотными свойствами, чем алифатические из-за участия – СООН – группы в р – сопряжении с электронами бензольного кольца. C O OH C O O-+ H+ бензоат — ионр. К= 4,
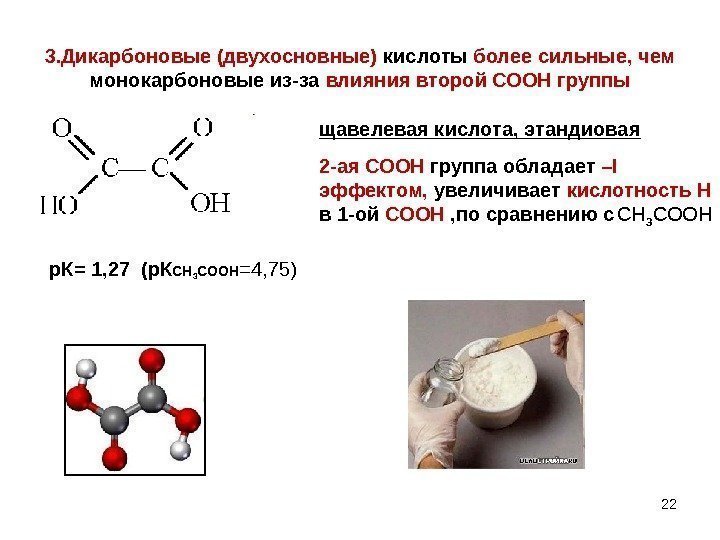
 3. Дикарбоновые (двухосновные) кислоты более сильные, чем монокарбоновые из-за влияния второй СООН группы щавелевая кислота, этандиовая 2 -ая СООН группа обладает – I эффектом, увеличивает кислотность Н в 1 -ой СООН , по сравнению с CH 3 COOH р. К= 1, 27 (р. К CH 3 COOH =4, 75)
3. Дикарбоновые (двухосновные) кислоты более сильные, чем монокарбоновые из-за влияния второй СООН группы щавелевая кислота, этандиовая 2 -ая СООН группа обладает – I эффектом, увеличивает кислотность Н в 1 -ой СООН , по сравнению с CH 3 COOH р. К= 1, 27 (р. К CH 3 COOH =4, 75)
 Щавелевая кислота накапливается, когда листья стареют, в молодых листьях ее не- много Оксалатные камни в почках Щавелевая кислота и ее соли токсичны
Щавелевая кислота накапливается, когда листья стареют, в молодых листьях ее не- много Оксалатные камни в почках Щавелевая кислота и ее соли токсичны
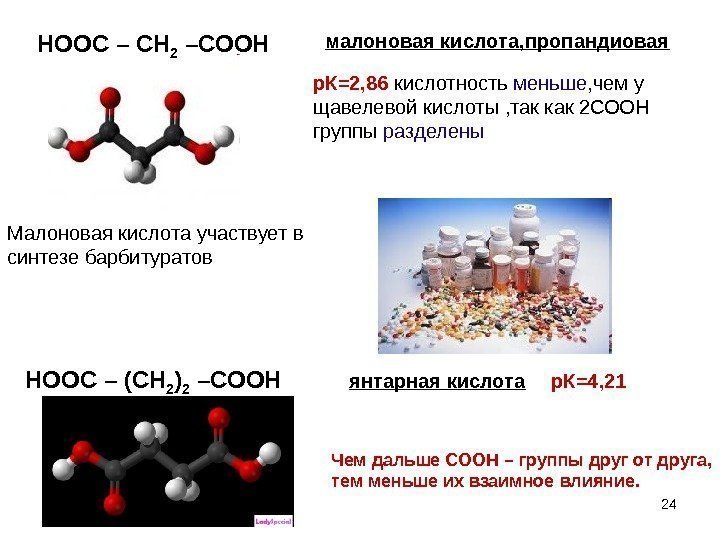
 малоновая кислота, пропандиовая р. К=2, 86 кислотность меньше , чем у щавелевой кислоты , так как 2 СООН группы разделены Малоновая кислота участвует в синтезе барбитуратов HOOC – (CH 2 ) 2 –COOH янтарная кислота р. К=4, 21 24 Чем дальше СООН – группы друг от друга, тем меньше их взаимное влияние. HOOC – CH 2 –COOH
малоновая кислота, пропандиовая р. К=2, 86 кислотность меньше , чем у щавелевой кислоты , так как 2 СООН группы разделены Малоновая кислота участвует в синтезе барбитуратов HOOC – (CH 2 ) 2 –COOH янтарная кислота р. К=4, 21 24 Чем дальше СООН – группы друг от друга, тем меньше их взаимное влияние. HOOC – CH 2 –COOH
 Янтарная кислота оказывает мощное оздоровительное действие на организм Используется против старения кожи Получается в результате переработки натурального янтаря Содержится в небольших количествах- в сыре, кисломолочных продуктах и морепродуктах
Янтарная кислота оказывает мощное оздоровительное действие на организм Используется против старения кожи Получается в результате переработки натурального янтаря Содержится в небольших количествах- в сыре, кисломолочных продуктах и морепродуктах
 26 C H 3 C O O HNa ( C H 3 C O O ) 2 C a + H 2 O + CO 2 Ca. O CH 3 COONa -H 2 O Cu(OH)2 ( C H 3 C O O ) 2 C u Na. HCO 3 -H 2 O CH 3 COONa. Образование солей КАРБОНОВЫХ КИСЛОТ
26 C H 3 C O O HNa ( C H 3 C O O ) 2 C a + H 2 O + CO 2 Ca. O CH 3 COONa -H 2 O Cu(OH)2 ( C H 3 C O O ) 2 C u Na. HCO 3 -H 2 O CH 3 COONa. Образование солей КАРБОНОВЫХ КИСЛОТ
 Ледяная уксусная кислота (концентрация близка к 100%) Действие уксусной кислоты на биологические ткани зависит от ее концентрации . Опасная концентрация — свыше 30% Безводная СН 3 СООН при 15 С переходит в кристаллическое состояние, похожее на лед
Ледяная уксусная кислота (концентрация близка к 100%) Действие уксусной кислоты на биологические ткани зависит от ее концентрации . Опасная концентрация — свыше 30% Безводная СН 3 СООН при 15 С переходит в кристаллическое состояние, похожее на лед
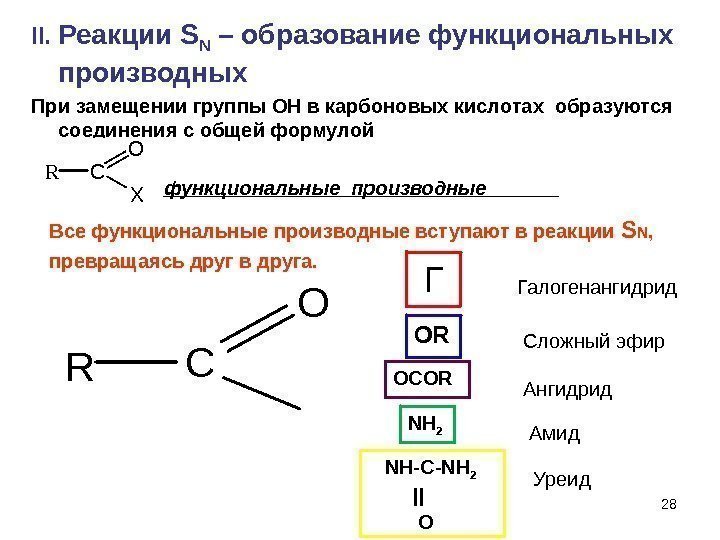
 28 II. Реакции S N – образование функциональных производных При замещении группы ОН в карбоновых кислотах образуются соединения с общей формулой функциональные производные RC O X Все функциональные производные вступают в реакции S N , превращаясь друг в друга. RC O Г Галогенангидрид OR Сложный эфир OCOR Ангидрид NH 2 Амид NH-C-NH 2 || O Уреид
28 II. Реакции S N – образование функциональных производных При замещении группы ОН в карбоновых кислотах образуются соединения с общей формулой функциональные производные RC O X Все функциональные производные вступают в реакции S N , превращаясь друг в друга. RC O Г Галогенангидрид OR Сложный эфир OCOR Ангидрид NH 2 Амид NH-C-NH 2 || O Уреид
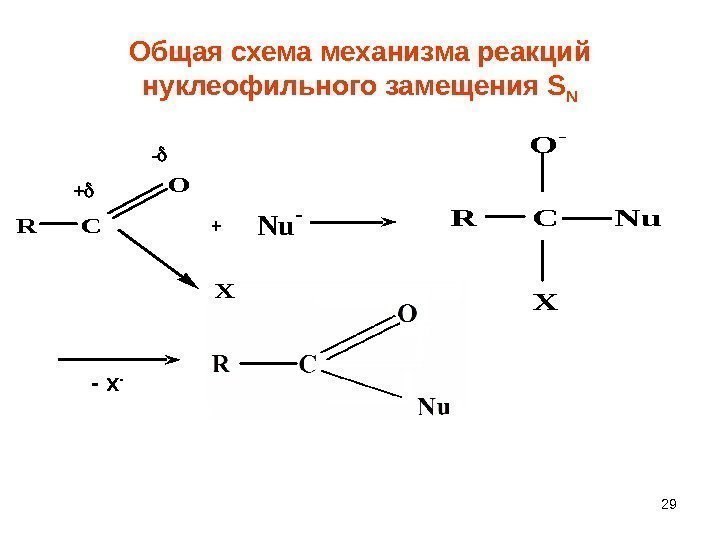
 29 Общая схема механизма реакций нуклеофильного замещения S NR C O X + — + Nu -R C Nu O — X — х —
29 Общая схема механизма реакций нуклеофильного замещения S NR C O X + — + Nu -R C Nu O — X — х —
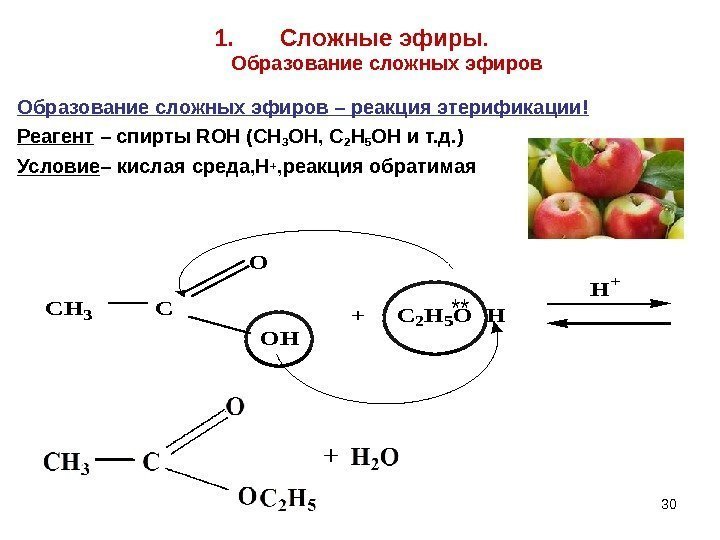
 301. Сложные эфиры. Образование сложных эфиров – реакция этерификации! Реагент – спирты ROH (CH 3 OH, C 2 H 5 OH и т. д. ) Условие – кислая среда, Н + , реакция обратимая. CH 3 C O OH + C 2 H 5 O H H+ **
301. Сложные эфиры. Образование сложных эфиров – реакция этерификации! Реагент – спирты ROH (CH 3 OH, C 2 H 5 OH и т. д. ) Условие – кислая среда, Н + , реакция обратимая. CH 3 C O OH + C 2 H 5 O H H+ **
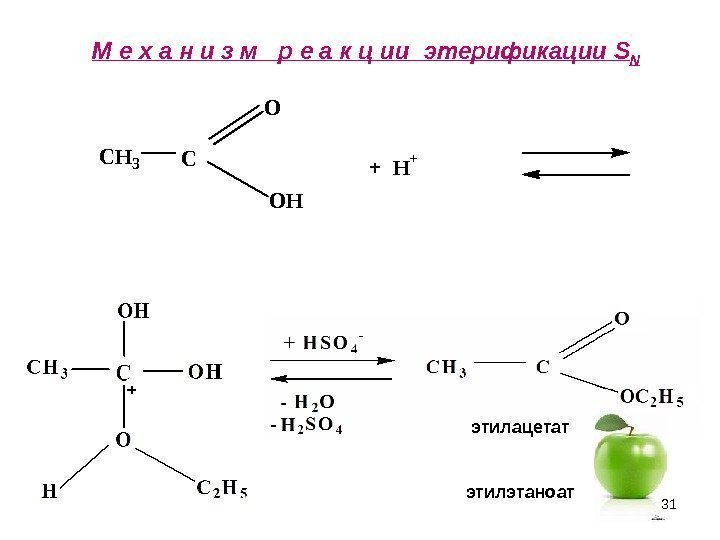
 31 М е х а н и з м р е а к ц ии этерификации S NCH 3 C O + H + OH этилацетат этилэтаноат
31 М е х а н и з м р е а к ц ии этерификации S NCH 3 C O + H + OH этилацетат этилэтаноат
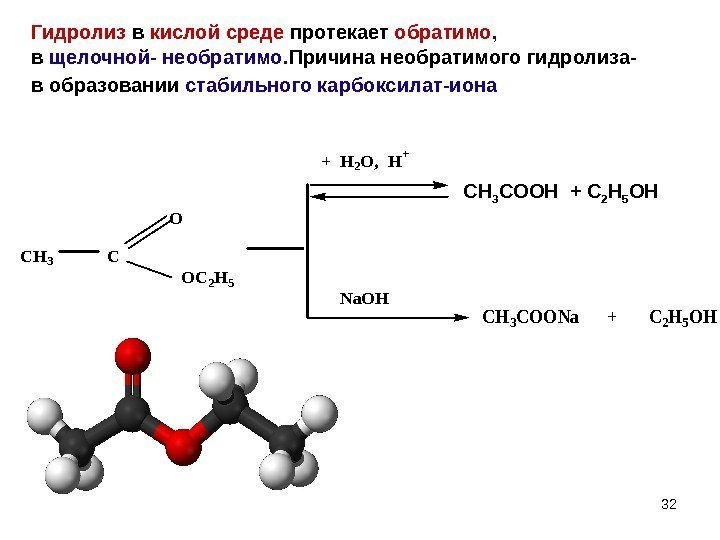
 32 Гидролиз в кислой среде протекает обратимо , в щелочной- необратимо. Причина необратимого гидролиза- в образовании стабильного карбоксилат-иона CH 3 C O OC 2 H 5 + H 2 O, H+ Na. OH CH 3 COONa + C 2 H 5 OH CH 3 COOH + C 2 H 5 OH
32 Гидролиз в кислой среде протекает обратимо , в щелочной- необратимо. Причина необратимого гидролиза- в образовании стабильного карбоксилат-иона CH 3 C O OC 2 H 5 + H 2 O, H+ Na. OH CH 3 COONa + C 2 H 5 OH CH 3 COOH + C 2 H 5 OH
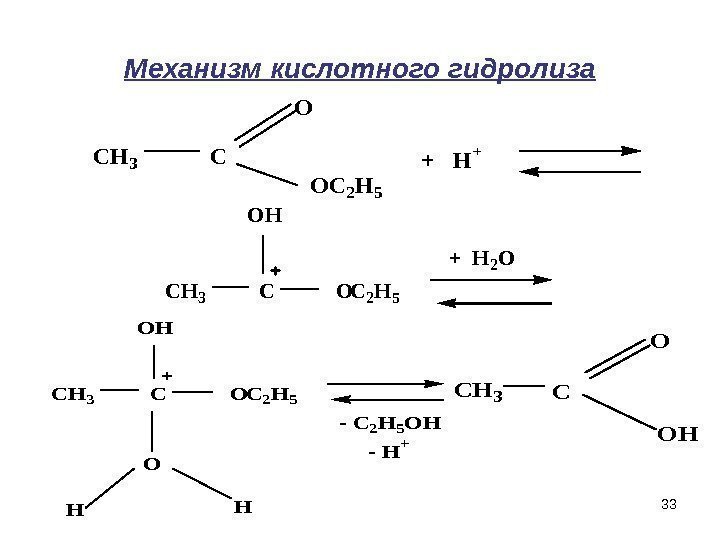
 33 Механизм кислотного гидролиза. CH 3 C O OC 2 H 5 + H + CH 3 C O OH C 2 H 5 + H 2 O CH 3 C O OH O C 2 H 5 HH — C 2 H 5 OH — H+ CH 3 C O OH
33 Механизм кислотного гидролиза. CH 3 C O OC 2 H 5 + H + CH 3 C O OH C 2 H 5 + H 2 O CH 3 C O OH O C 2 H 5 HH — C 2 H 5 OH — H+ CH 3 C O OH
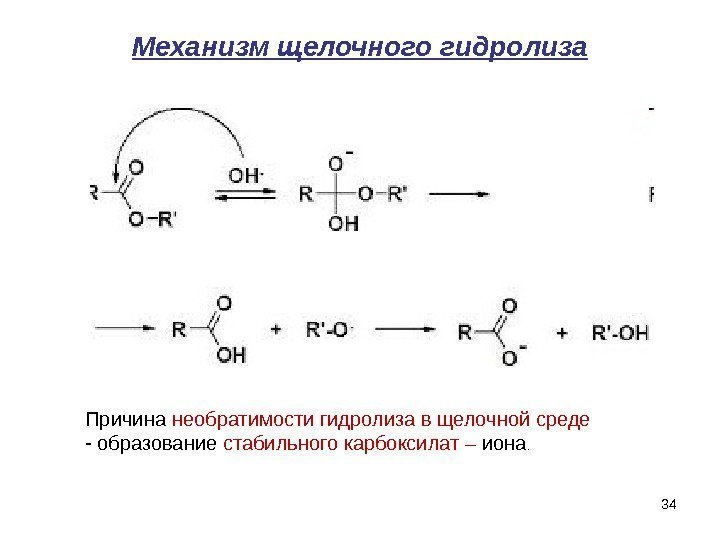
 Механизм щелочного гидролиза Причина необратимости гидролиза в щелочной среде — образование стабильного карбоксилат – иона.
Механизм щелочного гидролиза Причина необратимости гидролиза в щелочной среде — образование стабильного карбоксилат – иона.
 35 СЛОНЫЕ ЭФИРЫ в природе и нашей жизни Распространены в живой природе – входят в состав цветов, ягод, фруктов, определяя аромат. пентилацетат – банановый этилбутират – абрикосовый бензилацетат – жасминовый этилбутаноат- ананасовый
35 СЛОНЫЕ ЭФИРЫ в природе и нашей жизни Распространены в живой природе – входят в состав цветов, ягод, фруктов, определяя аромат. пентилацетат – банановый этилбутират – абрикосовый бензилацетат – жасминовый этилбутаноат- ананасовый
 36 Когда число атомов С в исходных карбоновой кислоте и спирте не превышает 6– 8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Бутилацетат- грушевый аромат Метилбутират-ябло чный Этилизовалерат-м алиновый
36 Когда число атомов С в исходных карбоновой кислоте и спирте не превышает 6– 8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Бутилацетат- грушевый аромат Метилбутират-ябло чный Этилизовалерат-м алиновый
 37 Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, цветочным запахом. Бензилацетат-жасминовый Некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
37 Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, цветочным запахом. Бензилацетат-жасминовый Некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
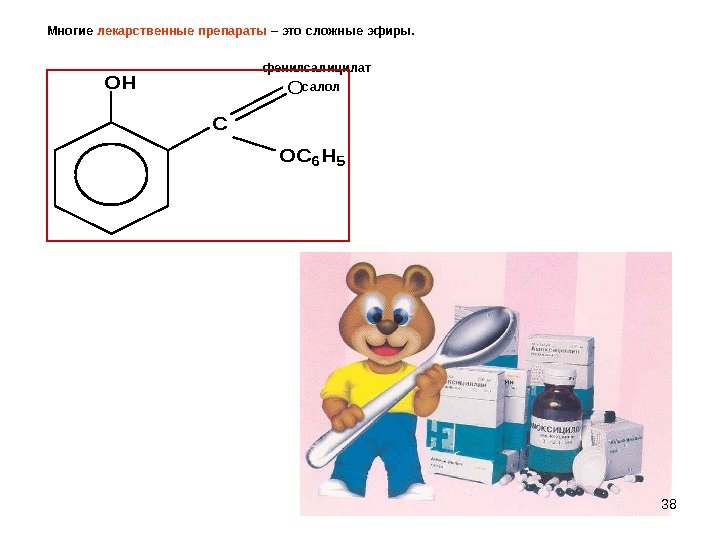
 38 Многие лекарственные препараты – это сложные эфиры. фенилсалицилат салол OH C O OC 6 H
38 Многие лекарственные препараты – это сложные эфиры. фенилсалицилат салол OH C O OC 6 H
 Диметилфталаты — сложные эфиры о-фталевой кислоты. спасают от клеща спасают от комаров (репелленты)
Диметилфталаты — сложные эфиры о-фталевой кислоты. спасают от клеща спасают от комаров (репелленты)
 Но фталаты – вредные составляющие косметических средств
Но фталаты – вредные составляющие косметических средств
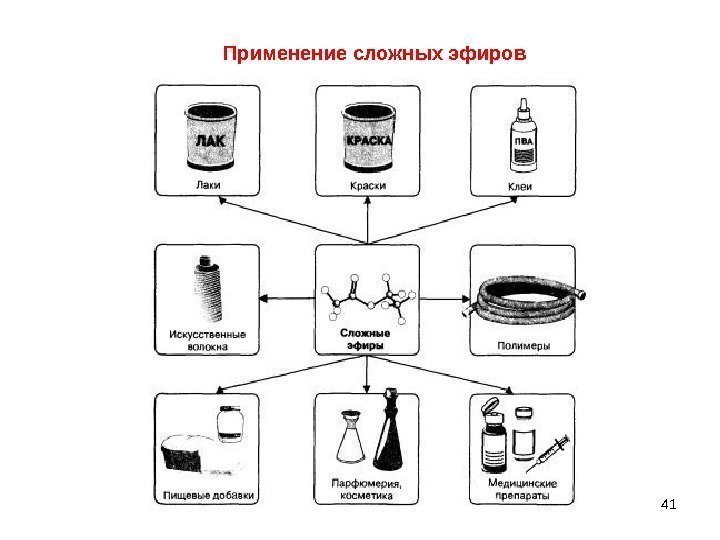
 41 Применение сложных эфиров
41 Применение сложных эфиров
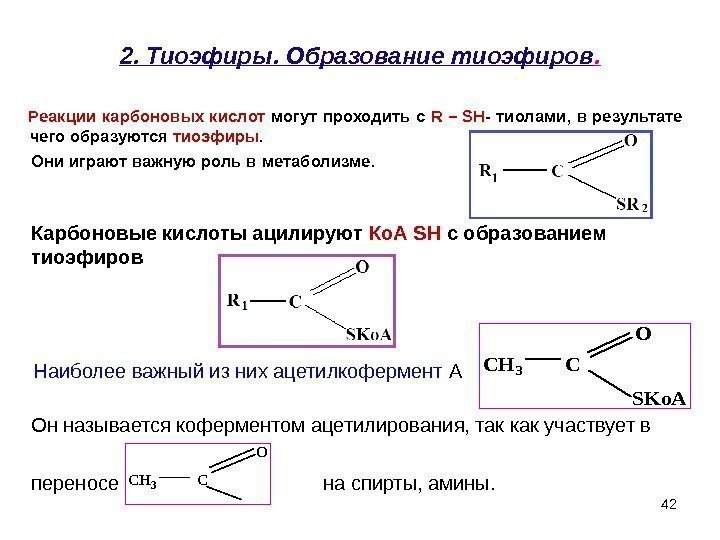
 422. Тиоэфиры. Образование тиоэфиров. Реакции карбоновых кислот могут проходить с R – SH — тиолами, в результате чего образуются тиоэфиры. Они играют важную роль в метаболизме. CH 3 C O SKo. A CH 3 C O Он называется коферментом ацетилирования, так как участвует в переносе на спирты, амины. Наиболее важный из них ацетилкофермент АКарбоновые кислоты ацилируют Ко. А SH с образованием тиоэфиров
422. Тиоэфиры. Образование тиоэфиров. Реакции карбоновых кислот могут проходить с R – SH — тиолами, в результате чего образуются тиоэфиры. Они играют важную роль в метаболизме. CH 3 C O SKo. A CH 3 C O Он называется коферментом ацетилирования, так как участвует в переносе на спирты, амины. Наиболее важный из них ацетилкофермент АКарбоновые кислоты ацилируют Ко. А SH с образованием тиоэфиров
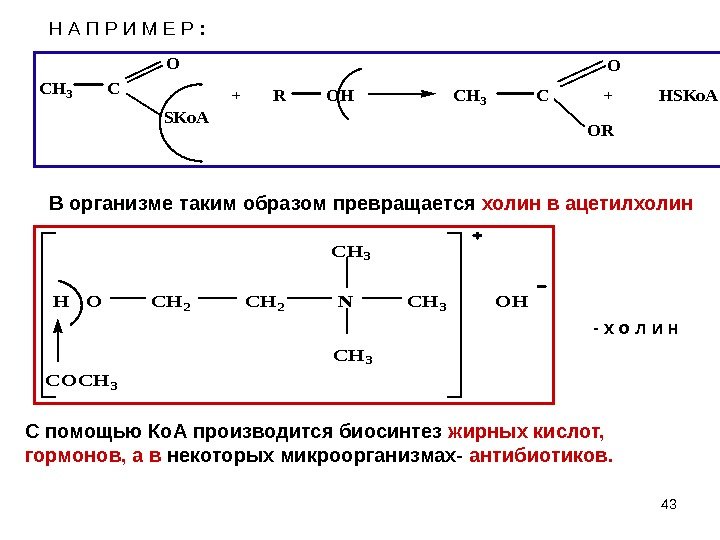
 43 Н А П Р И М Е Р : CH 3 C O SKo. A + R OH CH 3 C + HSKo. A OR O H O CH 2 N CH 3 OH COCH 3 — х о л и н С помощью Ко. А производится биосинтез жирных кислот, гормонов, а в некоторых микроорганизмах- антибиотиков. В организме таким образом превращается холин в ацетилхолин
43 Н А П Р И М Е Р : CH 3 C O SKo. A + R OH CH 3 C + HSKo. A OR O H O CH 2 N CH 3 OH COCH 3 — х о л и н С помощью Ко. А производится биосинтез жирных кислот, гормонов, а в некоторых микроорганизмах- антибиотиков. В организме таким образом превращается холин в ацетилхолин
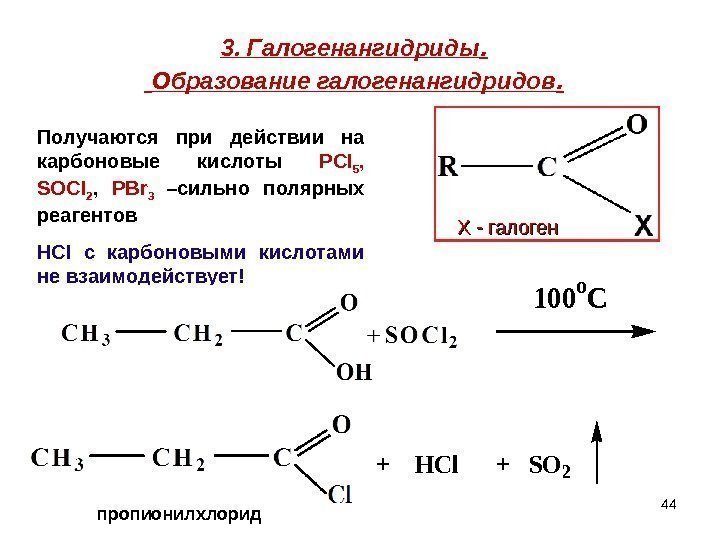
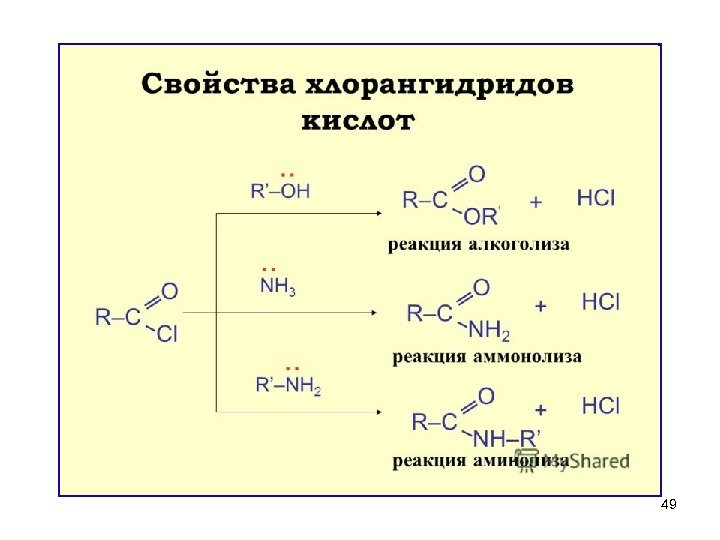
 443. Галогенангидриды. Образование галогенангидридов. 100 o C + HCl + SO 2 пропионилхлорид Х — галоген. Получаются при действии на карбоновые кислоты Р Cl 5 , SOCl 2 , PBr 3 –сильно полярных реагентов HCI c карбоновыми кислотами не взаимодействует!
443. Галогенангидриды. Образование галогенангидридов. 100 o C + HCl + SO 2 пропионилхлорид Х — галоген. Получаются при действии на карбоновые кислоты Р Cl 5 , SOCl 2 , PBr 3 –сильно полярных реагентов HCI c карбоновыми кислотами не взаимодействует!
 45 Хлорангидриды или ацилхлориды простых карбоновых кислот – жидкости, часто лакриматоры (вызывают слёзы ). Хлорангидрид уксусной кислоты
45 Хлорангидриды или ацилхлориды простых карбоновых кислот – жидкости, часто лакриматоры (вызывают слёзы ). Хлорангидрид уксусной кислоты
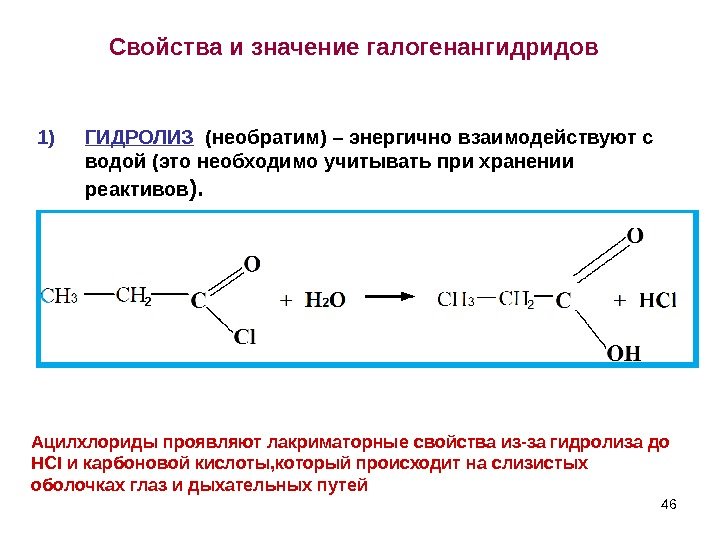
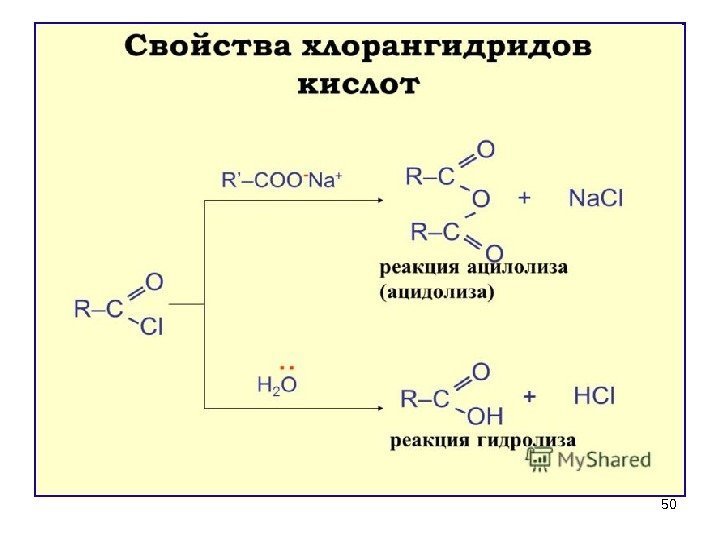
 46 Свойства и значение галогенангидридов 1) ГИДРОЛИЗ (необратим) – энергично взаимодействуют с водой (это необходимо учитывать при хранении реактивов ). Ацилхлориды проявляют лакриматорные свойства из-за гидролиза до HCI и карбоновой кислоты, который происходит на слизистых оболочках глаз и дыхательных путей
46 Свойства и значение галогенангидридов 1) ГИДРОЛИЗ (необратим) – энергично взаимодействуют с водой (это необходимо учитывать при хранении реактивов ). Ацилхлориды проявляют лакриматорные свойства из-за гидролиза до HCI и карбоновой кислоты, который происходит на слизистых оболочках глаз и дыхательных путей
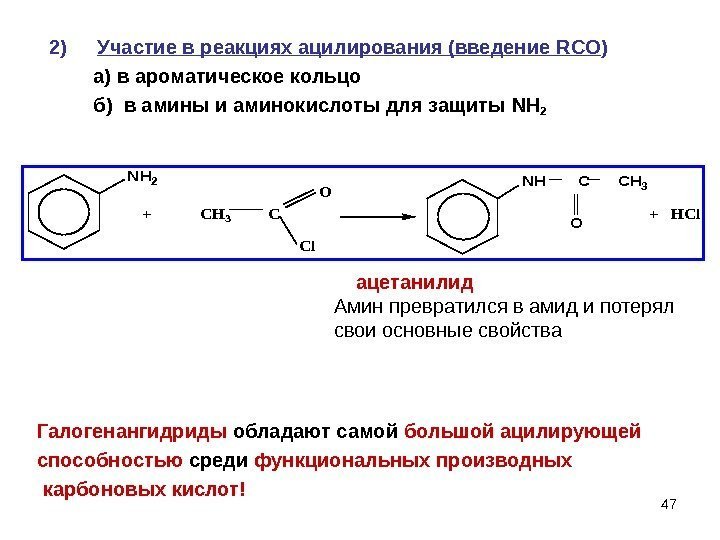
 472) Участие в реакциях ацилирования (введение RCO ) а) в ароматическое кольцо б) в амины и аминокислоты для защиты NH 2 CH 3 C + HCl O Cl NH 2 + NH C CH 3 O ацетанилид Амин превратился в амид и потерял свои основные свойства Галогенангидриды обладают самой большой ацилирующей способностью среди функциональных производных карбоновых кислот!
472) Участие в реакциях ацилирования (введение RCO ) а) в ароматическое кольцо б) в амины и аминокислоты для защиты NH 2 CH 3 C + HCl O Cl NH 2 + NH C CH 3 O ацетанилид Амин превратился в амид и потерял свои основные свойства Галогенангидриды обладают самой большой ацилирующей способностью среди функциональных производных карбоновых кислот!
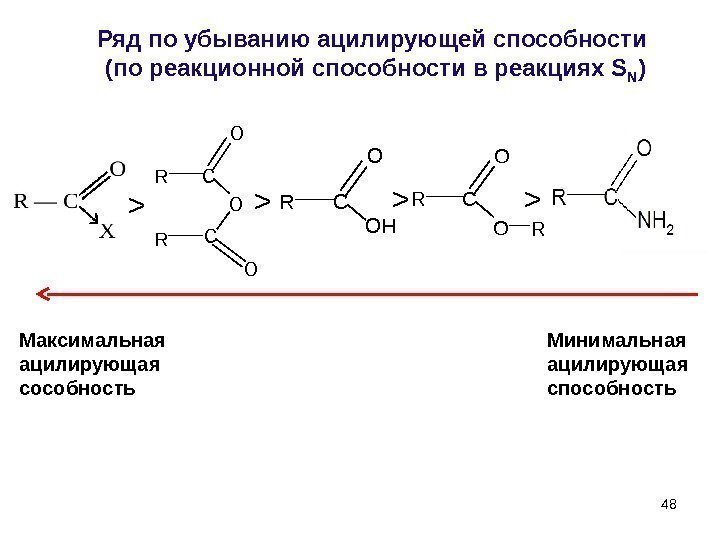
 48 Ряд по убыванию ацилирующей способности (по реакционной способности в реакциях S N ) > > >R R O C C O O R O C O R RC O OH > Максимальная ацилирующая сособность Минимальная ацилирующая способность
48 Ряд по убыванию ацилирующей способности (по реакционной способности в реакциях S N ) > > >R R O C C O O R O C O R RC O OH > Максимальная ацилирующая сособность Минимальная ацилирующая способность


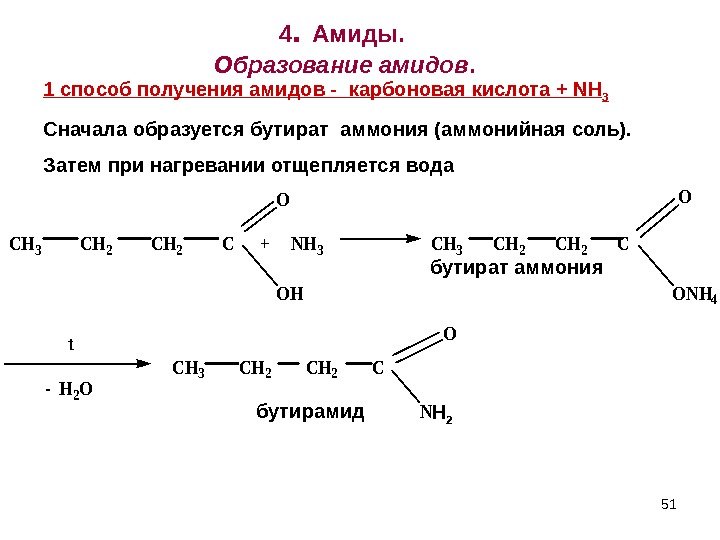
 514. Амиды. Образование амидов. CH 3 CH 2 C + NH 3 CH 3 CH 2 C O OH O ONH 4 t — H 2 O CH 3 CH 2 C NH 2 O бутират аммония бутирамид 1 спо c об получения амидов — карбоновая кислота + NH 3 Сначала образуется бутират аммония (аммонийная соль). Затем при нагревании отщепляется вода 51 Н
514. Амиды. Образование амидов. CH 3 CH 2 C + NH 3 CH 3 CH 2 C O OH O ONH 4 t — H 2 O CH 3 CH 2 C NH 2 O бутират аммония бутирамид 1 спо c об получения амидов — карбоновая кислота + NH 3 Сначала образуется бутират аммония (аммонийная соль). Затем при нагревании отщепляется вода 51 Н
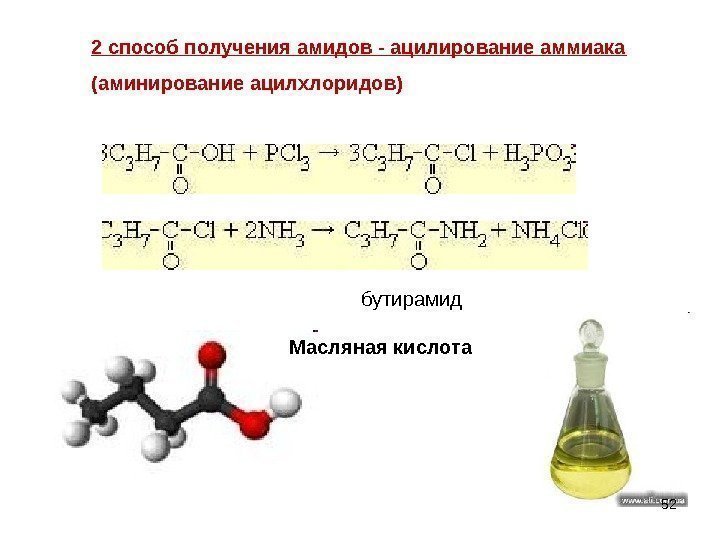
 2 способ получения амидов — ацилирование аммиака (аминирование ацилхлоридов) Масляная кислота бутирамид
2 способ получения амидов — ацилирование аммиака (аминирование ацилхлоридов) Масляная кислота бутирамид
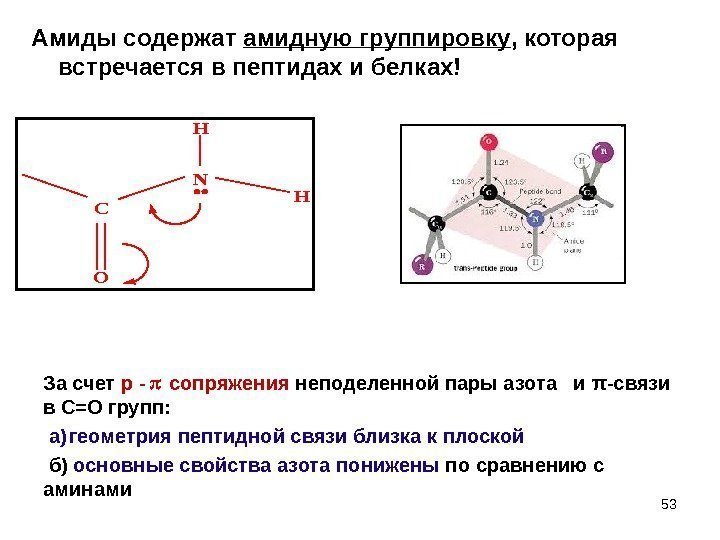
 53 Амиды содержат амидную группировку , которая встречается в пептидах и белках!C O N H H За счет р — сопряжения неподеленной пары азота и π -связи в С=О групп: а) геометрия пептидной связи близка к плоской б) основные свойства азота понижены по сравнению с аминами
53 Амиды содержат амидную группировку , которая встречается в пептидах и белках!C O N H H За счет р — сопряжения неподеленной пары азота и π -связи в С=О групп: а) геометрия пептидной связи близка к плоской б) основные свойства азота понижены по сравнению с аминами
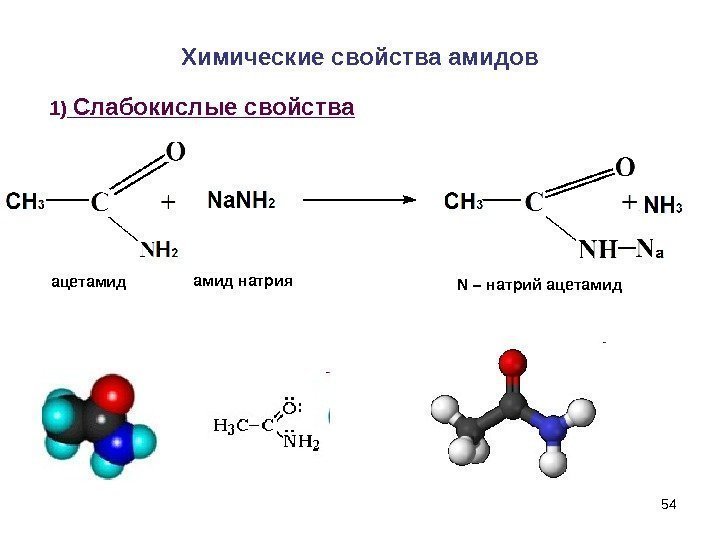
 54 Химические свойства амидов 1) Слабокислые свойства амид натрия ацетамид N – натрий ацетамид
54 Химические свойства амидов 1) Слабокислые свойства амид натрия ацетамид N – натрий ацетамид
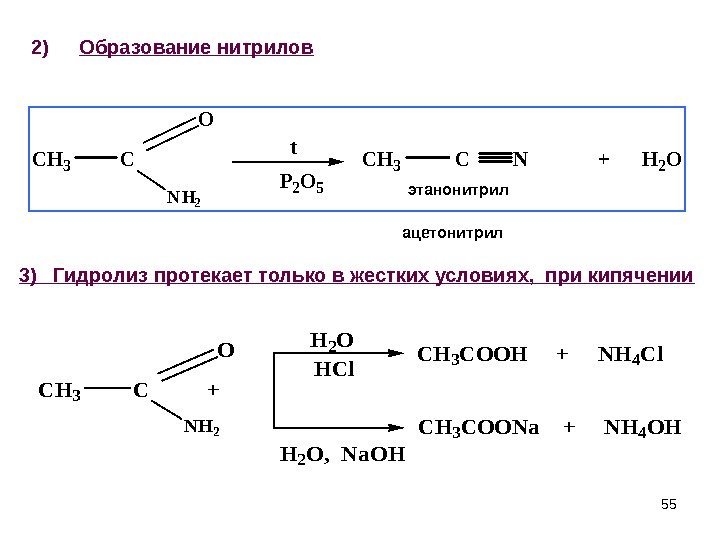
 552) Образование нитрилов. CH 3 C NH 2 O t P 2 O 5 CH 3 C N + H 2 O этанонитрил CH 3 C + NH 2 OH 2 O HCl H 2 O, Na. OH CH 3 COOH + NH 4 Cl CH 3 COONa + NH 4 OH ацетонитрил 3) Гидролиз протекает только в жестких условиях, при кипячении
552) Образование нитрилов. CH 3 C NH 2 O t P 2 O 5 CH 3 C N + H 2 O этанонитрил CH 3 C + NH 2 OH 2 O HCl H 2 O, Na. OH CH 3 COOH + NH 4 Cl CH 3 COONa + NH 4 OH ацетонитрил 3) Гидролиз протекает только в жестких условиях, при кипячении
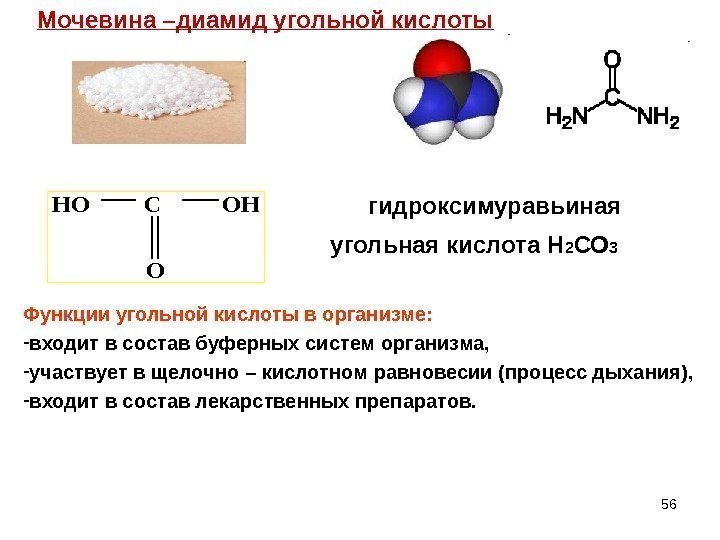
 56 Мочевина –диамид угольной кислоты. HO C OH O Функции угольной кислоты в организме: — входит в состав буферных систем организма, — участвует в щелочно – кислотном равновесии (процесс дыхания), — входит в состав лекарственных препаратов. гидроксимуравьиная угольная кислота Н 2 СО
56 Мочевина –диамид угольной кислоты. HO C OH O Функции угольной кислоты в организме: — входит в состав буферных систем организма, — участвует в щелочно – кислотном равновесии (процесс дыхания), — входит в состав лекарственных препаратов. гидроксимуравьиная угольная кислота Н 2 СО
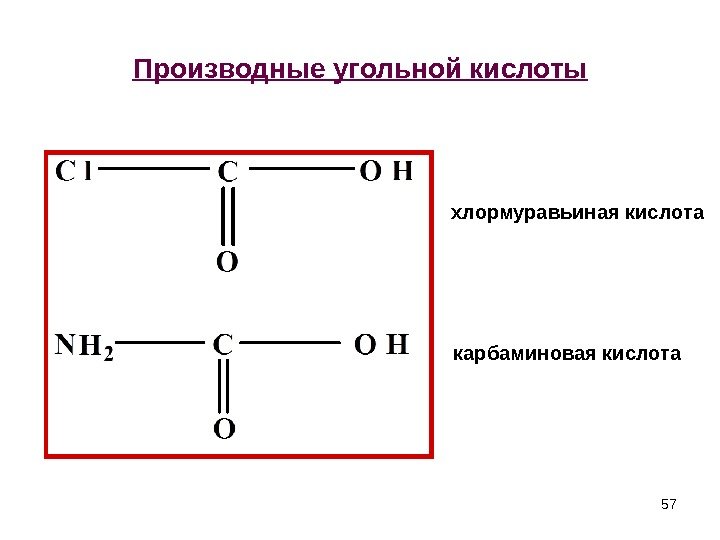
 57 Производные угольной кислоты хлормуравьиная кислота карбаминовая кислота
57 Производные угольной кислоты хлормуравьиная кислота карбаминовая кислота
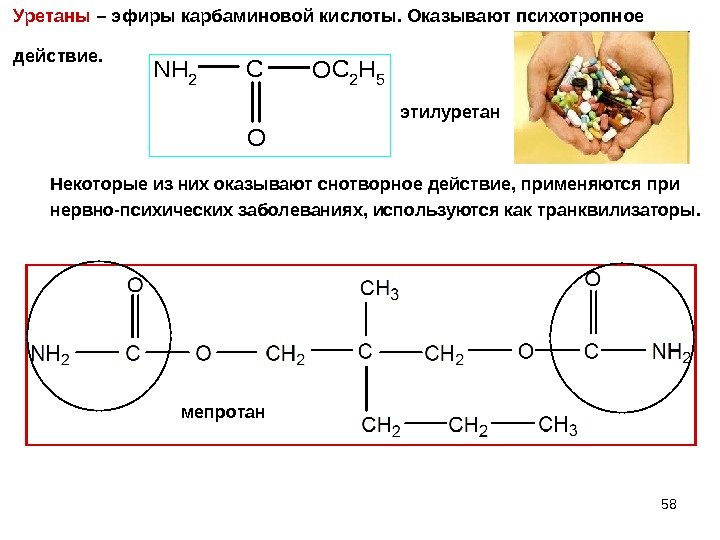
 58 Уретаны – эфиры карбаминовой кислоты. Оказывают психотропное действие. NH 2 COC 2 H 5 O этилуретан мепротан. Некоторые из них оказывают снотворное действие, применяются при нервно-психических заболеваниях, используются как транквилизаторы.
58 Уретаны – эфиры карбаминовой кислоты. Оказывают психотропное действие. NH 2 COC 2 H 5 O этилуретан мепротан. Некоторые из них оказывают снотворное действие, применяются при нервно-психических заболеваниях, используются как транквилизаторы.
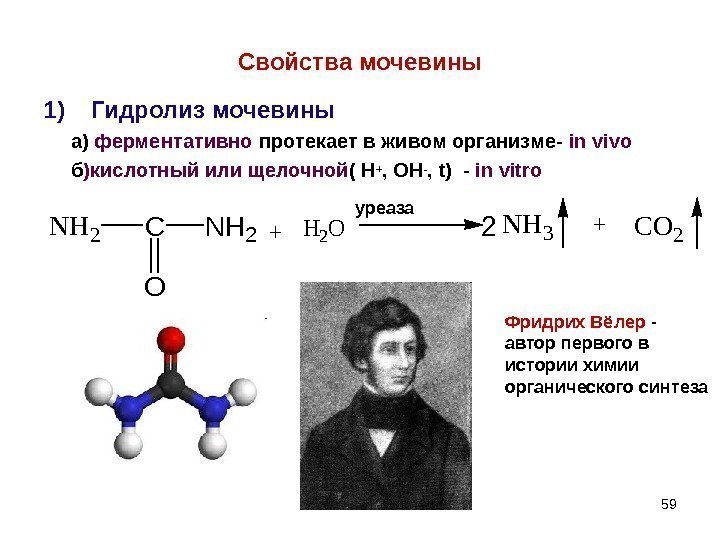
 59 Свойства мочевины 1) Гидролиз мочевины а) ферментативно протекает в живом организме- in vivo б )кислотный или щелочной ( Н + , ОН — , t ) — in vitro. NH 2 C O NH 2+H 2 ONH 3+CO 2 уреаза Фридрих Вёлер — автор первого в истории химии органического синтеза
59 Свойства мочевины 1) Гидролиз мочевины а) ферментативно протекает в живом организме- in vivo б )кислотный или щелочной ( Н + , ОН — , t ) — in vitro. NH 2 C O NH 2+H 2 ONH 3+CO 2 уреаза Фридрих Вёлер — автор первого в истории химии органического синтеза
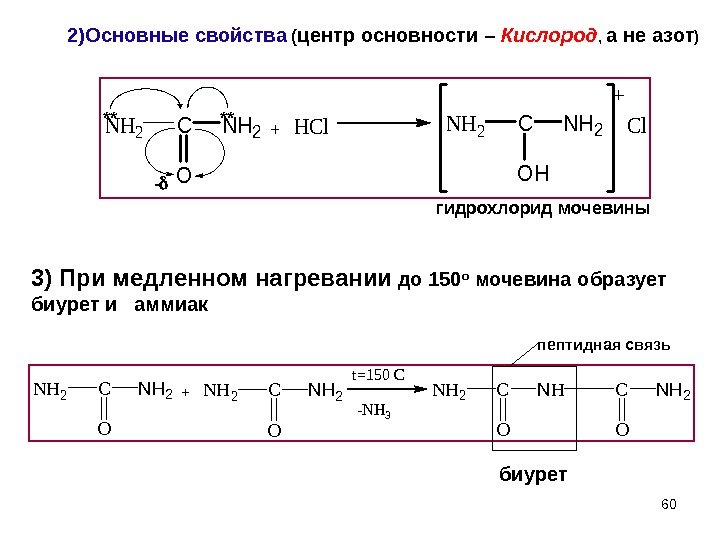
 602)Основные свойства ( центр основности – Кислород , а не азот ) гидрохлорид мочевины пептидная связь биурет. NH 2 C O NH 2+HCl. NH 2 C OH NH 2 Cl** ** — NH 2 C O NH 2+NH 2 C O NH 2 t=150 C -NH 3 NH 2 C O NH 23) При медленном нагревании до 150 о мочевина образует биурет и аммиак +
602)Основные свойства ( центр основности – Кислород , а не азот ) гидрохлорид мочевины пептидная связь биурет. NH 2 C O NH 2+HCl. NH 2 C OH NH 2 Cl** ** — NH 2 C O NH 2+NH 2 C O NH 2 t=150 C -NH 3 NH 2 C O NH 23) При медленном нагревании до 150 о мочевина образует биурет и аммиак +
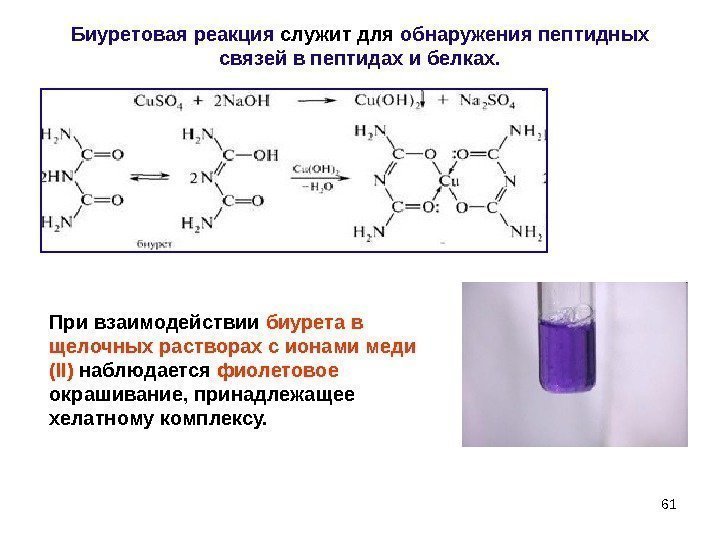
 Биуретовая реакция служит для обнаружения пептидных связей в пептидах и белках. При взаимодействии биурета в щелочных растворах с ионами меди ( II ) наблюдается фиолетовое окрашивание, принадлежащее хелатному комплексу.
Биуретовая реакция служит для обнаружения пептидных связей в пептидах и белках. При взаимодействии биурета в щелочных растворах с ионами меди ( II ) наблюдается фиолетовое окрашивание, принадлежащее хелатному комплексу.
 625. Уреиды. Образование уреидов. уреид — бромизовалерьяновой кислоты. Важными производными карбоновых кислот, содержащими остаток мочевины в качестве заместителя Х, являются уреиды. Некоторые уреиды кислот, замещенных в α-положении на галоген, применяются как снотворные средства: уреид α-бромизовалериановой кислоты, или бромурал (т. пл. 154).
625. Уреиды. Образование уреидов. уреид — бромизовалерьяновой кислоты. Важными производными карбоновых кислот, содержащими остаток мочевины в качестве заместителя Х, являются уреиды. Некоторые уреиды кислот, замещенных в α-положении на галоген, применяются как снотворные средства: уреид α-бромизовалериановой кислоты, или бромурал (т. пл. 154).
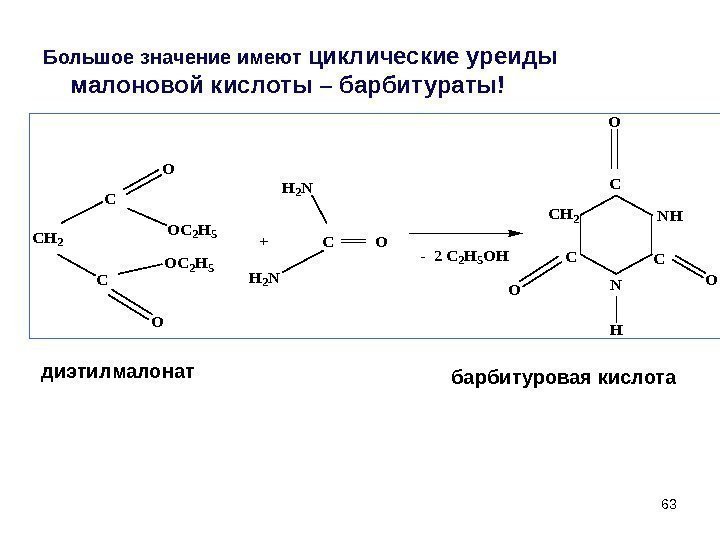
 63 Большое значение имеют циклические уреиды малоновой кислоты – барбитураты! CH 2 C C O O OC 2 H 5 + C O H 2 N — 2 C 2 H 5 OH C N C CH 2 O OO H диэтилмалонат барбитуровая кислота
63 Большое значение имеют циклические уреиды малоновой кислоты – барбитураты! CH 2 C C O O OC 2 H 5 + C O H 2 N — 2 C 2 H 5 OH C N C CH 2 O OO H диэтилмалонат барбитуровая кислота
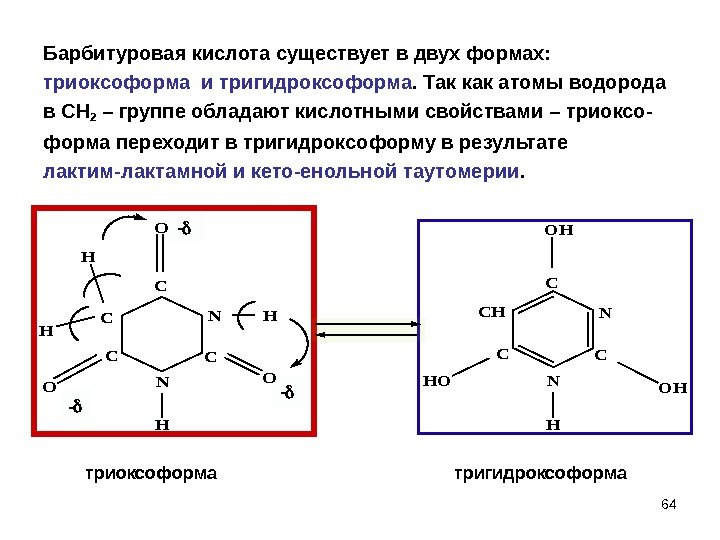
 — — 64 Барбитуровая кислота существует в двух формах: триоксоформа и тригидроксоформа. Так как атомы водорода в СН 2 – группе обладают кислотными свойствами – триоксо- форма переходит в тригидроксоформу в результате лактим-лактамной и кето-енольной таутомерии. C N H C N C C O OO H H H C N C CH H OH HOOH — триоксоформа тригидроксоформа
— — 64 Барбитуровая кислота существует в двух формах: триоксоформа и тригидроксоформа. Так как атомы водорода в СН 2 – группе обладают кислотными свойствами – триоксо- форма переходит в тригидроксоформу в результате лактим-лактамной и кето-енольной таутомерии. C N H C N C C O OO H H H C N C CH H OH HOOH — триоксоформа тригидроксоформа
 65 Лекарственные препараты (барбитураты )
65 Лекарственные препараты (барбитураты )
 66 Действие на организм • Барбитуровая кислота не оказывает ни снотворного ни наркотического действия; этой способностью обладают её производные. • Барбитураты оказывают тормозящие влияние на ЦНС и используются в медицине в качестве успокаивающих средств, снотворных, противосудорожных средств( бензонал, бензобамил) и средств для наркоза( гексенал, тиопенталнатрий)
66 Действие на организм • Барбитуровая кислота не оказывает ни снотворного ни наркотического действия; этой способностью обладают её производные. • Барбитураты оказывают тормозящие влияние на ЦНС и используются в медицине в качестве успокаивающих средств, снотворных, противосудорожных средств( бензонал, бензобамил) и средств для наркоза( гексенал, тиопенталнатрий)
 67 • Сон вызываемый барбитуратами отличаетс я от естественного сна. Они облегчают засыпание , но укорачивают фазу интенсивного сна. • В механизме действия барбитуратов играет роль их влияние на метаболические процессы мозга и на синоптическую передачу нервных импульсов, оказывают стимулирующие влияние на систему тормозного медиатора – ГАМК (гамма-аминомаслянной кислоты).
67 • Сон вызываемый барбитуратами отличаетс я от естественного сна. Они облегчают засыпание , но укорачивают фазу интенсивного сна. • В механизме действия барбитуратов играет роль их влияние на метаболические процессы мозга и на синоптическую передачу нервных импульсов, оказывают стимулирующие влияние на систему тормозного медиатора – ГАМК (гамма-аминомаслянной кислоты).
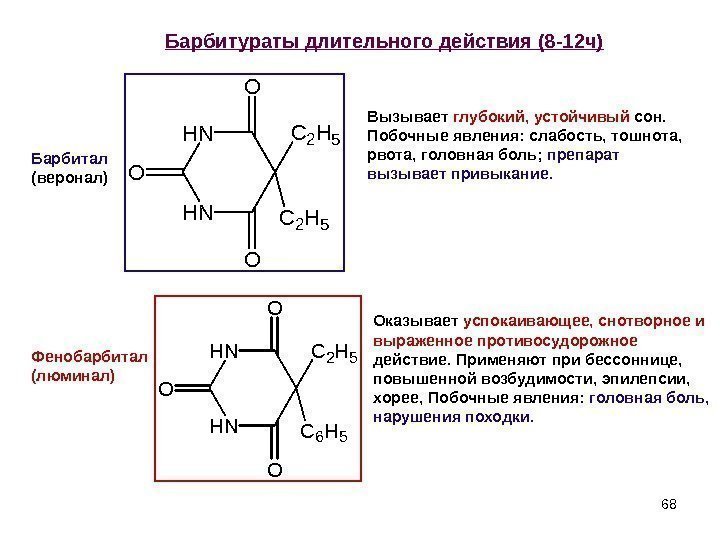
 68 Барбитураты длительного действия (8 -12 ч) Барбитал ( веронал ) Фенобарбитал (люминал) Вызывает глубокий, устойчивый сон. Побочные явления: слабость, тошнота, рвота, головная боль; препарат вызывает привыкание. Оказывает успокаивающее, снотворное и выраженное противосудорожное действие. Применяют при бессоннице, повышенной возбудимости, эпилепсии, хорее, Побочные явления: головная боль, нарушения походки. H NH N O O O C 2 H 5 C 6 H
68 Барбитураты длительного действия (8 -12 ч) Барбитал ( веронал ) Фенобарбитал (люминал) Вызывает глубокий, устойчивый сон. Побочные явления: слабость, тошнота, рвота, головная боль; препарат вызывает привыкание. Оказывает успокаивающее, снотворное и выраженное противосудорожное действие. Применяют при бессоннице, повышенной возбудимости, эпилепсии, хорее, Побочные явления: головная боль, нарушения походки. H NH N O O O C 2 H 5 C 6 H
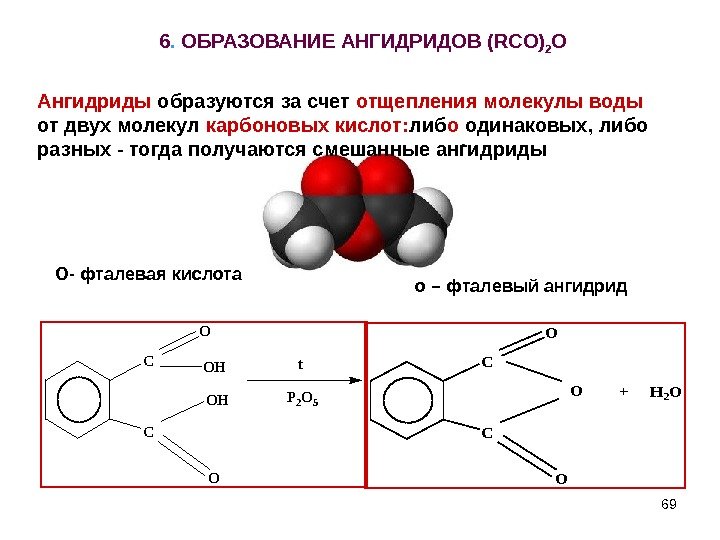
 696. ОБРАЗОВАНИЕ АНГИДРИДОВ ( RCO ) 2 OC C O O OH OH t P 2 O 5 C C O O O+ H 2 O О- фталевая кислота о – фталевый ангидрид. Ангидриды образуются за счет отщепления молекулы воды от двух молекул карбоновых кислот: либ о одинаковых, либо разных — тогда получаются смешанные ангидриды
696. ОБРАЗОВАНИЕ АНГИДРИДОВ ( RCO ) 2 OC C O O OH OH t P 2 O 5 C C O O O+ H 2 O О- фталевая кислота о – фталевый ангидрид. Ангидриды образуются за счет отщепления молекулы воды от двух молекул карбоновых кислот: либ о одинаковых, либо разных — тогда получаются смешанные ангидриды
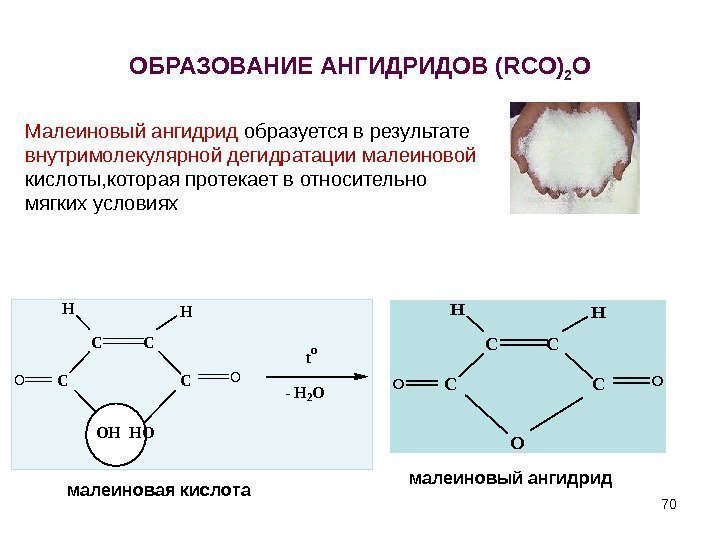
 ОБРАЗОВАНИЕ АНГИДРИДОВ ( RCO ) 2 OC C HH CCOO OHHO to — H 2 O C C HH CCOO O малеиновая кислота малеиновый ангидрид. Малеиновый ангидрид образуется в результате внутримолекулярной дегидратации малеиновой кислоты, которая протекает в относительно мягких условиях
ОБРАЗОВАНИЕ АНГИДРИДОВ ( RCO ) 2 OC C HH CCOO OHHO to — H 2 O C C HH CCOO O малеиновая кислота малеиновый ангидрид. Малеиновый ангидрид образуется в результате внутримолекулярной дегидратации малеиновой кислоты, которая протекает в относительно мягких условиях
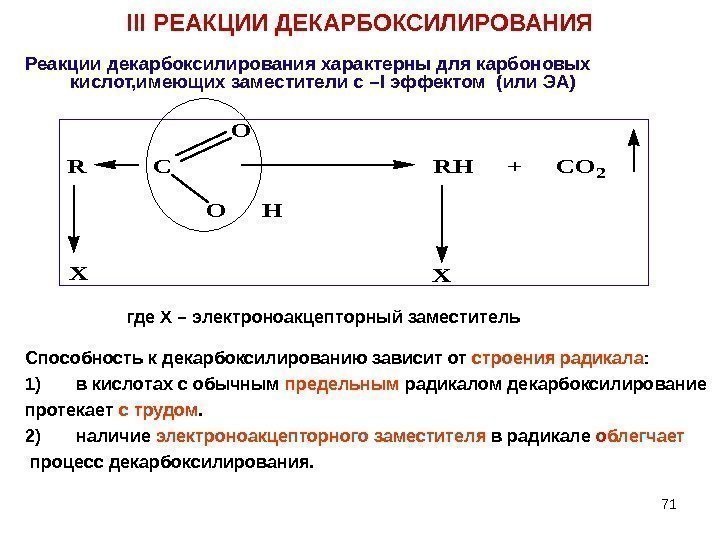
 71 III РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ Реакции декарбоксилирования характерны для карбоновых кислот, имеющих заместители с – I эффектом (или ЭА) R C RH + CO 2 O H O XX где Х – электроноакцепторный заместитель Способность к декарбоксилированию зависит от строения радикала : 1) в кислотах с обычным предельным радикалом декарбоксилирование протекает с трудом. 2) наличие электроноакцепторного заместителя в радикале о блегчает процесс декарбоксилирования.
71 III РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ Реакции декарбоксилирования характерны для карбоновых кислот, имеющих заместители с – I эффектом (или ЭА) R C RH + CO 2 O H O XX где Х – электроноакцепторный заместитель Способность к декарбоксилированию зависит от строения радикала : 1) в кислотах с обычным предельным радикалом декарбоксилирование протекает с трудом. 2) наличие электроноакцепторного заместителя в радикале о блегчает процесс декарбоксилирования.
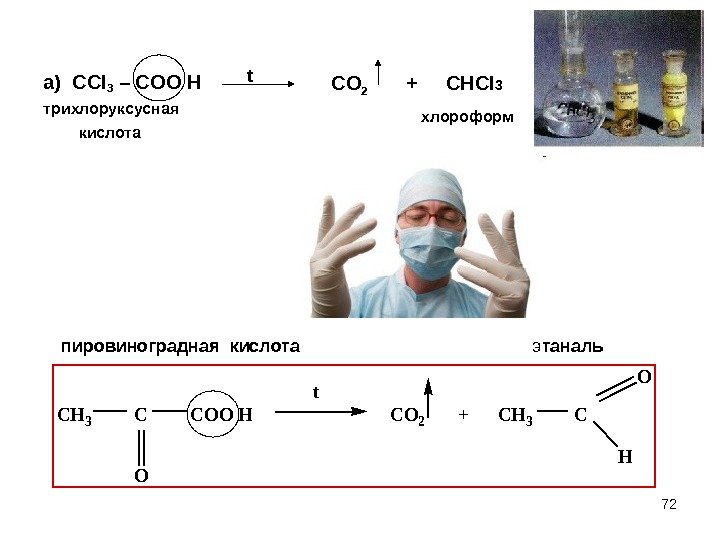
 72 а) СС l 3 – COO H трихлоруксусная кислота. CH 3 COO H CO 2 + CH 3 C O H O t пировиноградная кислота э таналь CO 2 + CHCl 3 t хлороформ
72 а) СС l 3 – COO H трихлоруксусная кислота. CH 3 COO H CO 2 + CH 3 C O H O t пировиноградная кислота э таналь CO 2 + CHCl 3 t хлороформ
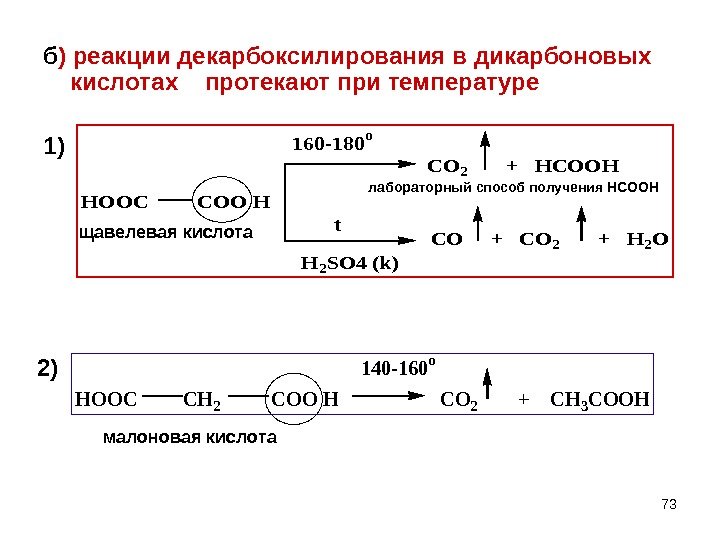
 73 б ) реакции декарбоксилирования в дикарбоновых кислотах протекают при температуре 1)HOOC COO H 160 -180 o t H 2 SO 4 (k) CO 2 + HCOOH CO + CO 2 + H 2 O HOOC CH 2 COO H CO 2 + CH 3 COOH 140 -160 o щавелевая кислота малоновая кислота лабораторный способ получения НСООН 2)
73 б ) реакции декарбоксилирования в дикарбоновых кислотах протекают при температуре 1)HOOC COO H 160 -180 o t H 2 SO 4 (k) CO 2 + HCOOH CO + CO 2 + H 2 O HOOC CH 2 COO H CO 2 + CH 3 COOH 140 -160 o щавелевая кислота малоновая кислота лабораторный способ получения НСООН 2)
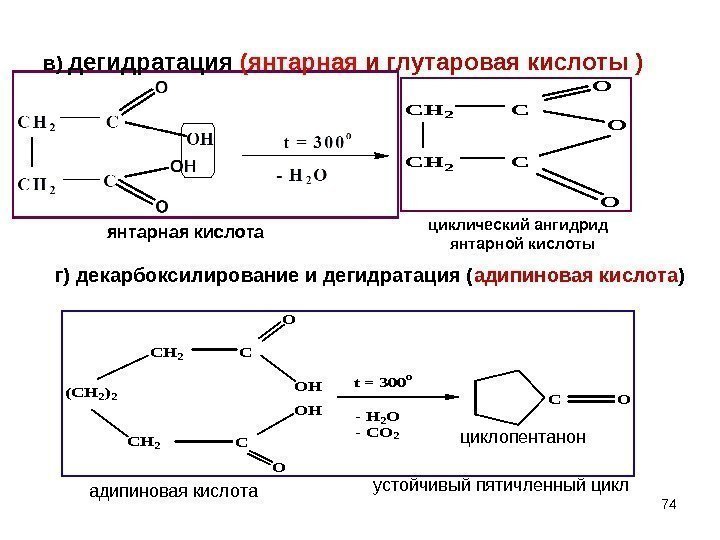
 74 в) дегидратация (янтарная и глутаровая кислоты )CH 2 C O O O (CH 2)2 CH 2 C C OH OH O O t = 300 o — H 2 O — CO 2 CO янтарная кислота циклический ангидрид янтарной кислоты адипиновая кислота циклопентанон устойчивый пятичленный циклг) декарбоксилирование и дегидратация ( адипиновая кислота )
74 в) дегидратация (янтарная и глутаровая кислоты )CH 2 C O O O (CH 2)2 CH 2 C C OH OH O O t = 300 o — H 2 O — CO 2 CO янтарная кислота циклический ангидрид янтарной кислоты адипиновая кислота циклопентанон устойчивый пятичленный циклг) декарбоксилирование и дегидратация ( адипиновая кислота )
 75 IV. Реакции в радикале 1. Для предельных карбоновых кислот характерны реакции радикального замещения S R (в α -положении ). Условия – Cl 2 , h или Br 2 , P красный. CH 3 CH 2 COOH + Cl 2 CH 3 CH COOH + HCl Cl Br ÑH 3 CH 2 COOH + Br 2 CH 3 CH 2 CH COOHHBr+ h P красныйпропионовая кислота бутановая кислота — хлорпропионовая кислота — бромбутановая кислота
75 IV. Реакции в радикале 1. Для предельных карбоновых кислот характерны реакции радикального замещения S R (в α -положении ). Условия – Cl 2 , h или Br 2 , P красный. CH 3 CH 2 COOH + Cl 2 CH 3 CH COOH + HCl Cl Br ÑH 3 CH 2 COOH + Br 2 CH 3 CH 2 CH COOHHBr+ h P красныйпропионовая кислота бутановая кислота — хлорпропионовая кислота — бромбутановая кислота
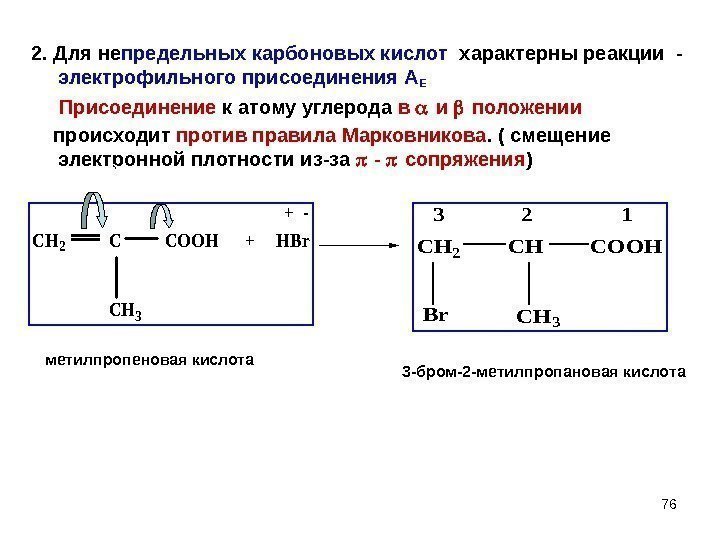
 762. Для не предельных карбоновых кислот характерны реакции — электрофильного присоединения А Е Присоединение к атому углерода в и положении происходит против правила Марковникова. ( смещение электронной плотности из-за — сопряжения ) CH 2 COOH + HBr CH 3 + — CH 2 CH COOH Br. CH 3 3 2 1 + — 3 -бром-2 -метилпропановая кислотаметилпропеновая кислота
762. Для не предельных карбоновых кислот характерны реакции — электрофильного присоединения А Е Присоединение к атому углерода в и положении происходит против правила Марковникова. ( смещение электронной плотности из-за — сопряжения ) CH 2 COOH + HBr CH 3 + — CH 2 CH COOH Br. CH 3 3 2 1 + — 3 -бром-2 -метилпропановая кислотаметилпропеновая кислота
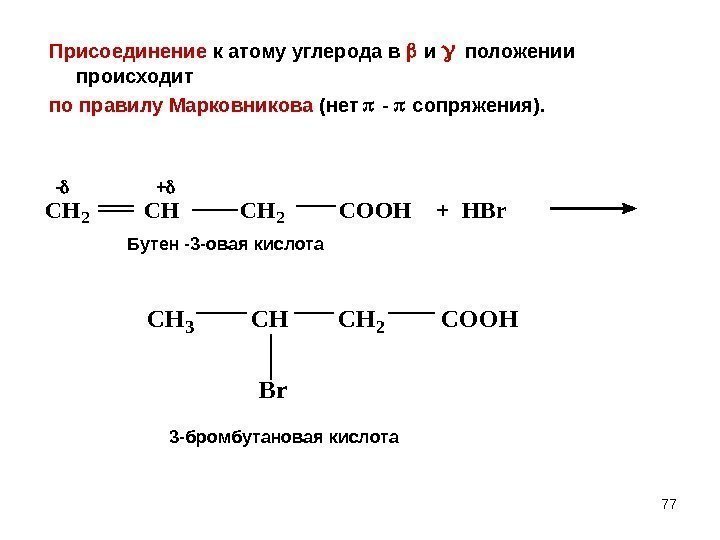
 77 Присоединение к атому углерода в и положении происходит по правилу Марковникова (нет — сопряжения). CH 2 COOH + HBr CH 3 CH 2 COOH Br — + Бутен -3 -овая кислота 3 -бромбутановая кислота
77 Присоединение к атому углерода в и положении происходит по правилу Марковникова (нет — сопряжения). CH 2 COOH + HBr CH 3 CH 2 COOH Br — + Бутен -3 -овая кислота 3 -бромбутановая кислота
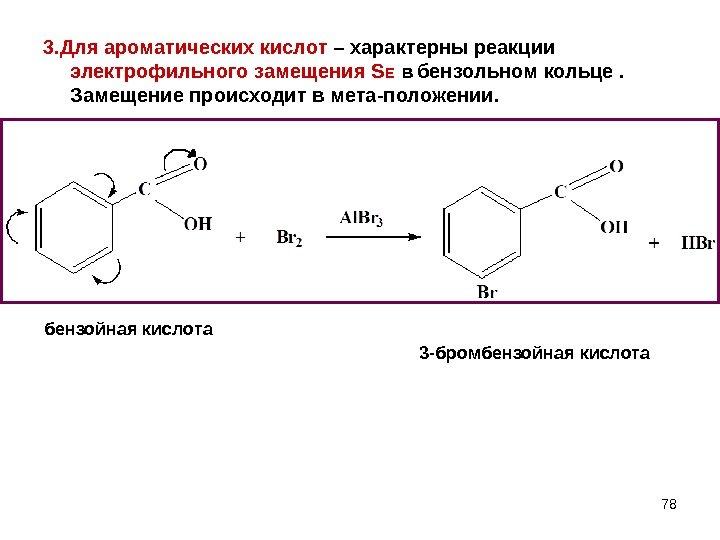
 783. Для ароматических кислот – характерны реакции электрофильного замещения S E в бензольном кольце. Замещение происходит в мета-положении. бензойная кислота 3 -бромбензойная кислота
783. Для ароматических кислот – характерны реакции электрофильного замещения S E в бензольном кольце. Замещение происходит в мета-положении. бензойная кислота 3 -бромбензойная кислота
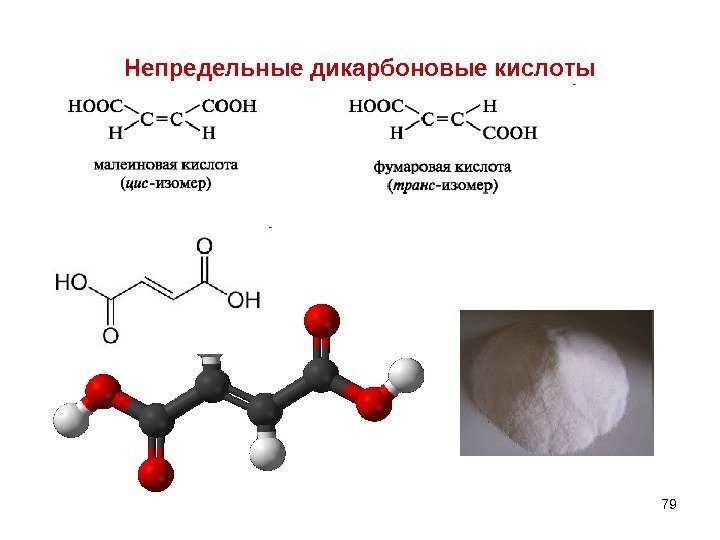
 Непредельные дикарбоновые кислоты
Непредельные дикарбоновые кислоты
 80 НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ 1) Фумаровая – trans – бутендиовая , распространена в природе. Участвует в цикле трикарбоновы х кислот, являясь промежуточным звеном. Получается в организме из янтарной и затем при гидратации образует яблочную. HOOCCH 2 COOH H HOOCCHCHCOOH E 2 HOOCCHCHCOOHHOOCCHCH 2 OH COOH E + Н 2 Оянтарная кислота фумаровая кислота яблочная кислота 2) Малеиновая кислота – cis- бутендиовая – менее устойчивая, легко превращается в малеиновый ангидрид.
80 НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ 1) Фумаровая – trans – бутендиовая , распространена в природе. Участвует в цикле трикарбоновы х кислот, являясь промежуточным звеном. Получается в организме из янтарной и затем при гидратации образует яблочную. HOOCCH 2 COOH H HOOCCHCHCOOH E 2 HOOCCHCHCOOHHOOCCHCH 2 OH COOH E + Н 2 Оянтарная кислота фумаровая кислота яблочная кислота 2) Малеиновая кислота – cis- бутендиовая – менее устойчивая, легко превращается в малеиновый ангидрид.
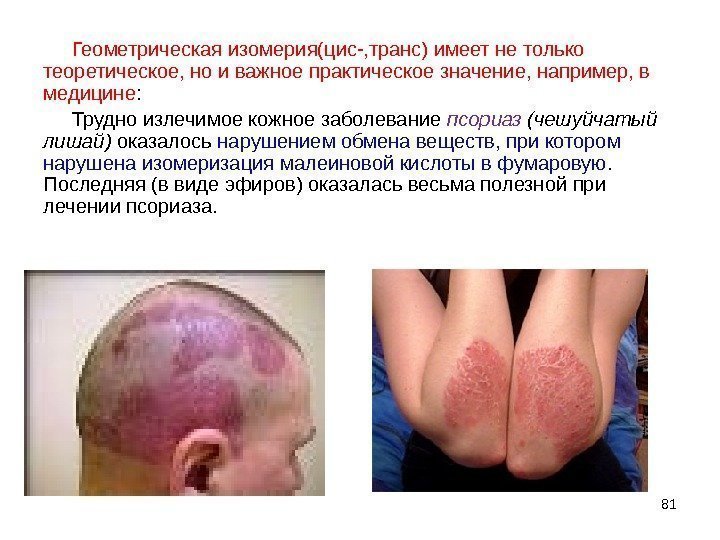
 81 Геометрическая изомерия(цис-, транс) имеет не только теоретическое, но и важное практическое значение, например, в медицине : Трудно излечимое кожное заболевание псориаз (чешуйчатый лишай) оказалось нарушением обмена веществ, при котором нарушена изомеризация малеиновой кислоты в фумаровую. Последняя (в виде эфиров) оказалась весьма полезной при лечении псориаза.
81 Геометрическая изомерия(цис-, транс) имеет не только теоретическое, но и важное практическое значение, например, в медицине : Трудно излечимое кожное заболевание псориаз (чешуйчатый лишай) оказалось нарушением обмена веществ, при котором нарушена изомеризация малеиновой кислоты в фумаровую. Последняя (в виде эфиров) оказалась весьма полезной при лечении псориаза.
 Для анализа и идентификации карбоновых кислот и их функциональных производных используются методы: • Электронной спектроскопии. • ИК-спектроскопии • Спектроскопия ЯМР • Хроматография Хроматографические методы исследования • Хроматограф газовый входит в состав лабораторного комплекса и осуществляет хроматографический анализ сложных веществ. 82 Хроматографические методы исследования
Для анализа и идентификации карбоновых кислот и их функциональных производных используются методы: • Электронной спектроскопии. • ИК-спектроскопии • Спектроскопия ЯМР • Хроматография Хроматографические методы исследования • Хроматограф газовый входит в состав лабораторного комплекса и осуществляет хроматографический анализ сложных веществ. 82 Хроматографические методы исследования
 83 Высокоэффективная жидкостная хроматография является незаменимым методом при проведении исследований в различных областях органической, физической и аналитической химии, биохимии и фармакологии. Жидкостную хроматографию можно использовать для разделения веществ, которые растворимы в каком-либо растворителе, таких как нуклеотиды, нуклеозиды, антибиотики, витамины, пищевые добавки, косметические средства, лекарственные препараты, гигиенические средства, продукты органического синтеза, пестициды, биологические жидкости и т. д.
83 Высокоэффективная жидкостная хроматография является незаменимым методом при проведении исследований в различных областях органической, физической и аналитической химии, биохимии и фармакологии. Жидкостную хроматографию можно использовать для разделения веществ, которые растворимы в каком-либо растворителе, таких как нуклеотиды, нуклеозиды, антибиотики, витамины, пищевые добавки, косметические средства, лекарственные препараты, гигиенические средства, продукты органического синтеза, пестициды, биологические жидкости и т. д.
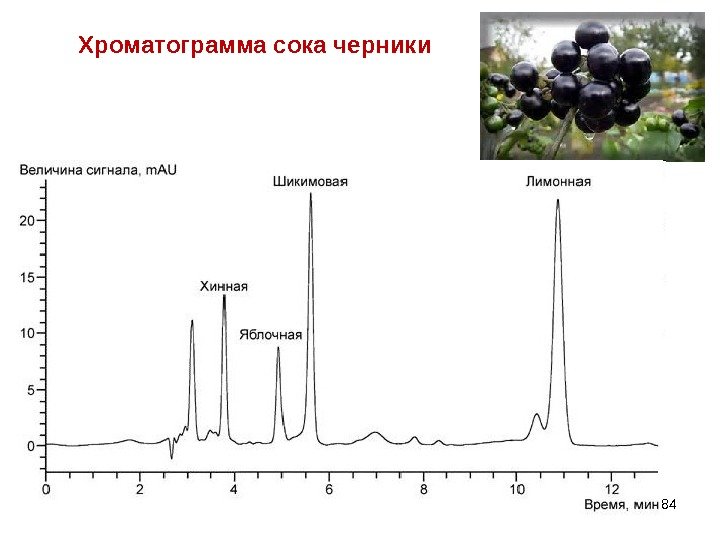
 Хроматограмма сока черники
Хроматограмма сока черники
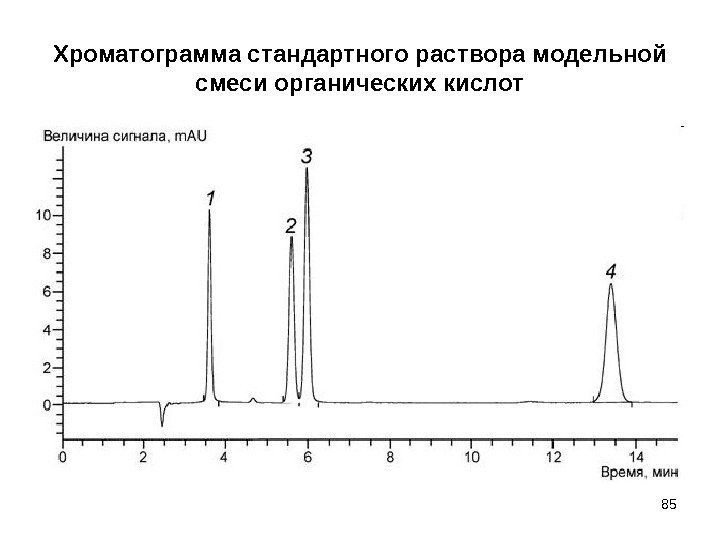
 Хроматограмма стандартного раствора модельной смеси органических кислот
Хроматограмма стандартного раствора модельной смеси органических кислот
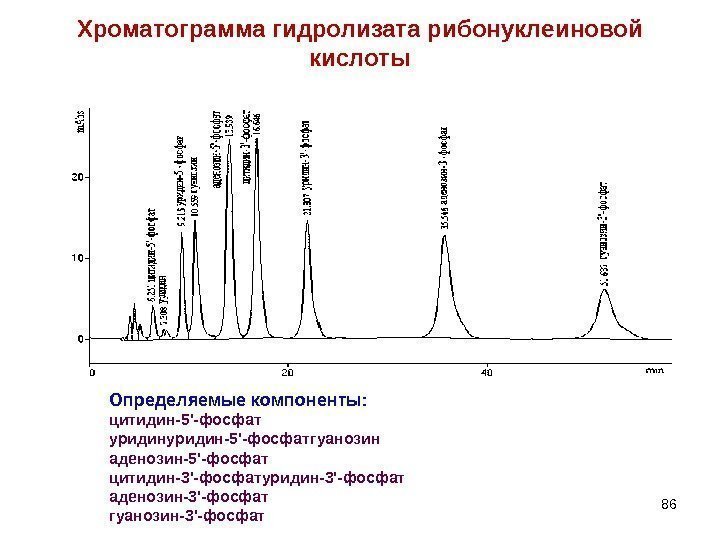
 Хроматограмма гидролизата рибонуклеиновой кислоты 86 Определяемые компоненты: цитидин-5′-фосфат уридин-5′-фосфатгуанозин аденозин-5′-фосфат цитидин-3′-фосфатуридин-3′-фосфат аденозин-3′-фосфат гуанозин-3′-фосфат
Хроматограмма гидролизата рибонуклеиновой кислоты 86 Определяемые компоненты: цитидин-5′-фосфат уридин-5′-фосфатгуанозин аденозин-5′-фосфат цитидин-3′-фосфатуридин-3′-фосфат аденозин-3′-фосфат гуанозин-3′-фосфат
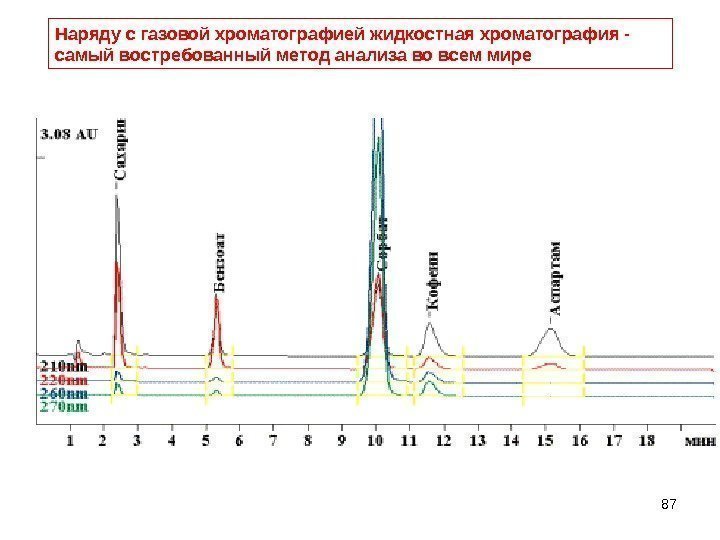
 87 Наряду с газовой хроматографией жидкостная хроматография — самый востребованный метод анализа во всем мире
87 Наряду с газовой хроматографией жидкостная хроматография — самый востребованный метод анализа во всем мире
 88 Жиры. Фосфолипиды Липиды – большая и довольно разнообразная группа веществ, выполняющая чрезвычайно важные функции в организме: — Липиды – структурные компоненты клеточных мембран — Выполняют защитную функцию — В форме липидов транспортируется и запасается энергетическое топливо
88 Жиры. Фосфолипиды Липиды – большая и довольно разнообразная группа веществ, выполняющая чрезвычайно важные функции в организме: — Липиды – структурные компоненты клеточных мембран — Выполняют защитную функцию — В форме липидов транспортируется и запасается энергетическое топливо
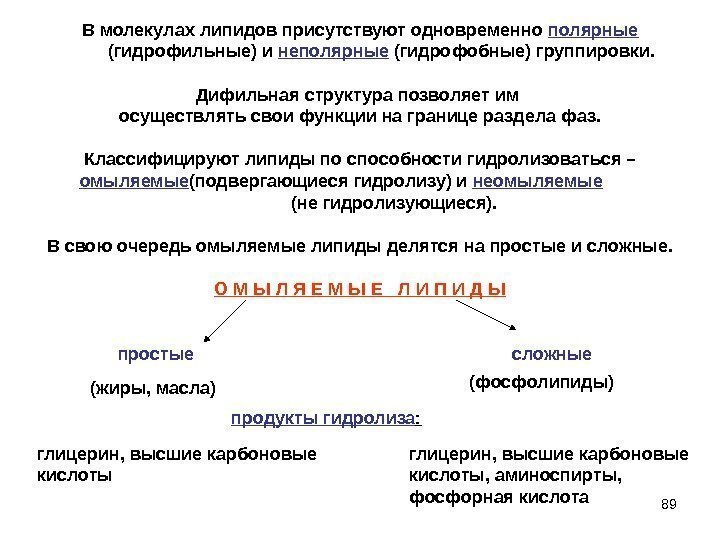
 89 В молекулах липидов присутствуют одновременно полярные (гидрофильные) и неполярные (гидрофобные) группировки. Дифильная структура позволяет им осуществлять свои функции на границе раздела фаз. Классифицируют липиды по способности гидролизоваться – омыляемые (подвергающиеся гидролизу) и неомыляемые (не гидролизующиеся). В свою очередь омыляемые липиды делятся на простые и сложные. О М Ы Л Я Е М Ы Е Л И П И Д Ы простые сложные (жиры, масла) (фосфолипиды) продукты гидролиза : глицерин, высшие карбоновые кислоты, аминоспирты, фосфорная кислота
89 В молекулах липидов присутствуют одновременно полярные (гидрофильные) и неполярные (гидрофобные) группировки. Дифильная структура позволяет им осуществлять свои функции на границе раздела фаз. Классифицируют липиды по способности гидролизоваться – омыляемые (подвергающиеся гидролизу) и неомыляемые (не гидролизующиеся). В свою очередь омыляемые липиды делятся на простые и сложные. О М Ы Л Я Е М Ы Е Л И П И Д Ы простые сложные (жиры, масла) (фосфолипиды) продукты гидролиза : глицерин, высшие карбоновые кислоты, аминоспирты, фосфорная кислота
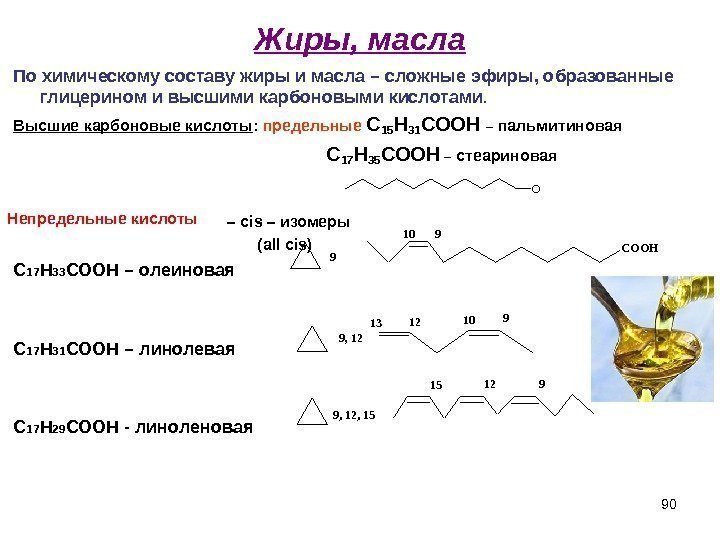
 90 Жиры, масла По химическому составу жиры и масла – сложные эфиры, образованные глицерином и высшими карбоновыми кислотами. Высшие карбоновые кислоты : предельные С 15 Н 31 СООН – пальмитиновая С 17 Н 35 СООН – стеариновая – cis – изомеры ( all cis ) С 17 Н 33 СООН – олеиновая С 17 Н 31 СООН – линолевая С 17 Н 29 СООН — линоленовая. O 9 COOH 910 9, 12 9101213 9, 12, 15 91215 Непредельные кислоты
90 Жиры, масла По химическому составу жиры и масла – сложные эфиры, образованные глицерином и высшими карбоновыми кислотами. Высшие карбоновые кислоты : предельные С 15 Н 31 СООН – пальмитиновая С 17 Н 35 СООН – стеариновая – cis – изомеры ( all cis ) С 17 Н 33 СООН – олеиновая С 17 Н 31 СООН – линолевая С 17 Н 29 СООН — линоленовая. O 9 COOH 910 9, 12 9101213 9, 12, 15 91215 Непредельные кислоты
 91 Значение жирных кислот липидов Особо следует подчеркнуть роль полиненасыщенных линолевой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей в количестве около 5 г в сутки). Эти кислоты содержатся в основном в растительных маслах. Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза, для профилактики и лечения которого применяется линетол – смесь этиловых эфиров высших жирных непредельных кислот льняного масла.
91 Значение жирных кислот липидов Особо следует подчеркнуть роль полиненасыщенных линолевой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей в количестве около 5 г в сутки). Эти кислоты содержатся в основном в растительных маслах. Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза, для профилактики и лечения которого применяется линетол – смесь этиловых эфиров высших жирных непредельных кислот льняного масла.

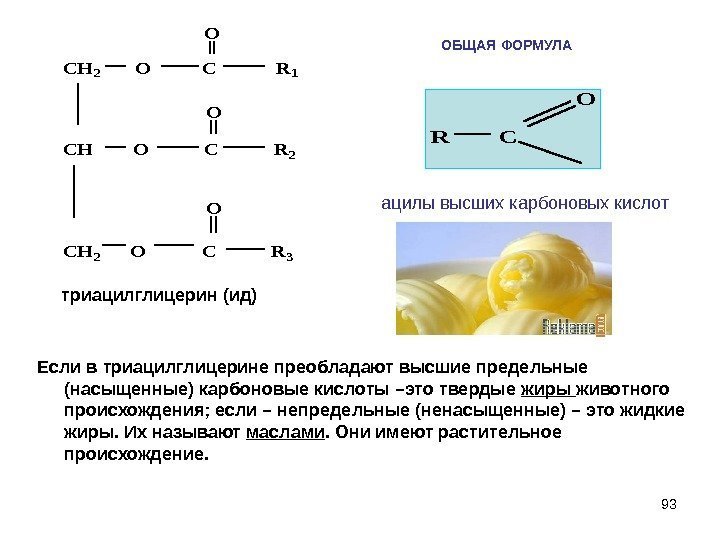
 93 ОБЩАЯ ФОРМУЛА Если в триацилглицерине преобладают высшие предельные (насыщенные) карбоновые кислоты –это твердые жиры животного происхождения; если – непредельные (ненасыщенные) – это жидкие жиры. Их называют маслами. Они имеют растительное происхождение. CH 2 O C R 1 CH O C R 2 CH 2 O C R 3 O O Oтриацилглицерин (ид) R C O ацилы высших карбоновых кислот
93 ОБЩАЯ ФОРМУЛА Если в триацилглицерине преобладают высшие предельные (насыщенные) карбоновые кислоты –это твердые жиры животного происхождения; если – непредельные (ненасыщенные) – это жидкие жиры. Их называют маслами. Они имеют растительное происхождение. CH 2 O C R 1 CH O C R 2 CH 2 O C R 3 O O Oтриацилглицерин (ид) R C O ацилы высших карбоновых кислот
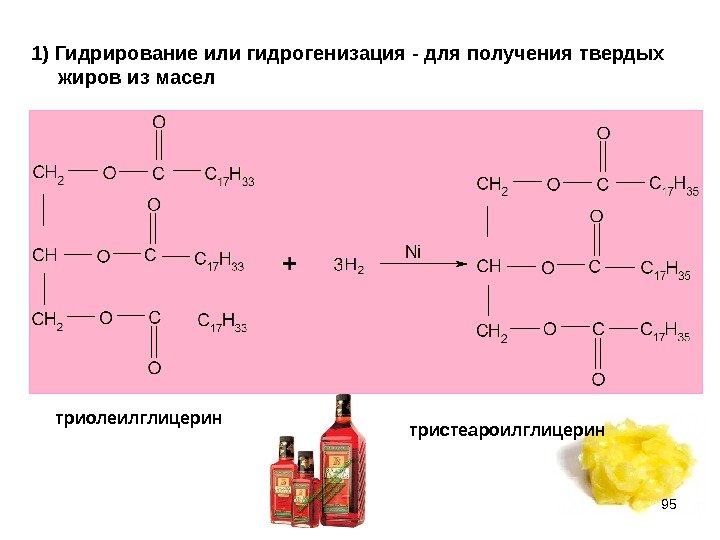
 94 ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ Из химических свойств особенно интересны гидрирование (присоединение) по двойной связи жидких жиров и гидролиз жиров. 1) Гидрирование или гидрогенизация для получения твердых жиров из масел 2) Гидролиз имеет большое значение в технологических и биохимических процессах При гидролизе фосфолипидов получается больше веществ, чем при гидролизе жиров: кроме высших карбоновых кислот и глицерина, образуются Н 3 РО 4 и аминоспирты, то есть 4 типа разных веществ.
94 ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ Из химических свойств особенно интересны гидрирование (присоединение) по двойной связи жидких жиров и гидролиз жиров. 1) Гидрирование или гидрогенизация для получения твердых жиров из масел 2) Гидролиз имеет большое значение в технологических и биохимических процессах При гидролизе фосфолипидов получается больше веществ, чем при гидролизе жиров: кроме высших карбоновых кислот и глицерина, образуются Н 3 РО 4 и аминоспирты, то есть 4 типа разных веществ.
 951) Гидрирование или гидрогенизация — для получения твердых жиров из масел триолеилглицерин тристеароилглицерин
951) Гидрирование или гидрогенизация — для получения твердых жиров из масел триолеилглицерин тристеароилглицерин
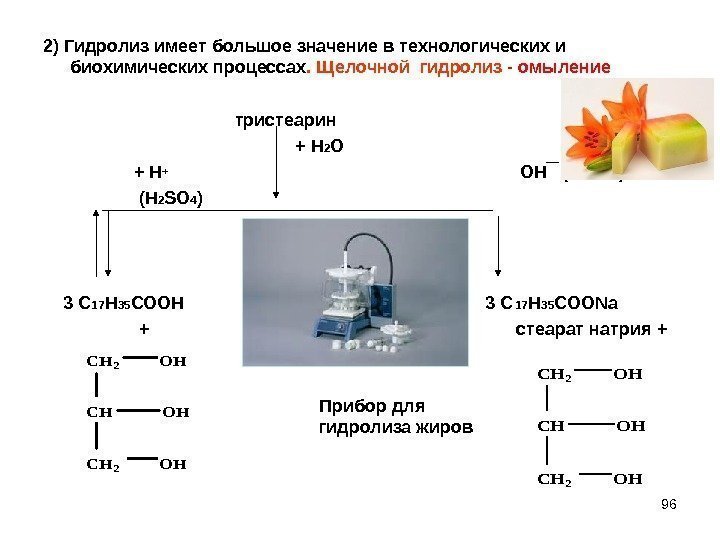
 962) Гидролиз имеет большое значение в технологических и биохимических процессах. Щелочной гидролиз — омыление тристеарин + Н 2 О + Н+ ОН ( Na. OH ) (H 2 SO 4 ) 3 С 17 Н 35 СООН 3 С 17 Н 35 СОО Na + стеарат натрия + CH 2 OH CH 2 OH Прибор для гидролиза жиров
962) Гидролиз имеет большое значение в технологических и биохимических процессах. Щелочной гидролиз — омыление тристеарин + Н 2 О + Н+ ОН ( Na. OH ) (H 2 SO 4 ) 3 С 17 Н 35 СООН 3 С 17 Н 35 СОО Na + стеарат натрия + CH 2 OH CH 2 OH Прибор для гидролиза жиров
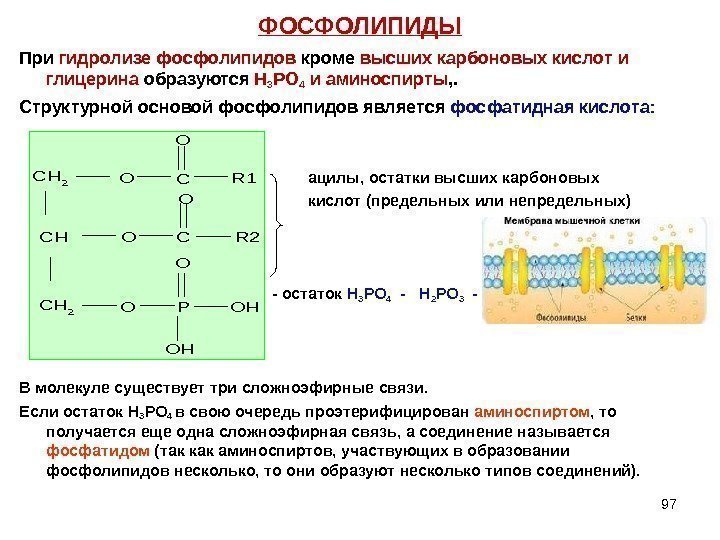
 97 ФОСФОЛИПИДЫ При гидролизе фосфолипидов кроме высших карбоновых кислот и глицерина образуются Н 3 РО 4 и аминоспирты , . Структурной основой фосфолипидов является фосфатидная кислота: ацилы, остатки высших карбоновых кислот (предельных или непредельных) — остаток Н 3 РО 4 — Н 2 РО 3 — В молекуле существует три сложноэфирные связи. Если остаток Н 3 РО 4 в свою очередь проэтерифицирован аминоспиртом , то получается еще одна сложноэфирная связь, а соединение называется фосфатидом (так как аминоспиртов, участвующих в образовании фосфолипидов несколько, то они образуют несколько типов соединений). CH 2 CH CH 2 O O O C C P O OH OH R 1 R
97 ФОСФОЛИПИДЫ При гидролизе фосфолипидов кроме высших карбоновых кислот и глицерина образуются Н 3 РО 4 и аминоспирты , . Структурной основой фосфолипидов является фосфатидная кислота: ацилы, остатки высших карбоновых кислот (предельных или непредельных) — остаток Н 3 РО 4 — Н 2 РО 3 — В молекуле существует три сложноэфирные связи. Если остаток Н 3 РО 4 в свою очередь проэтерифицирован аминоспиртом , то получается еще одна сложноэфирная связь, а соединение называется фосфатидом (так как аминоспиртов, участвующих в образовании фосфолипидов несколько, то они образуют несколько типов соединений). CH 2 CH CH 2 O O O C C P O OH OH R 1 R
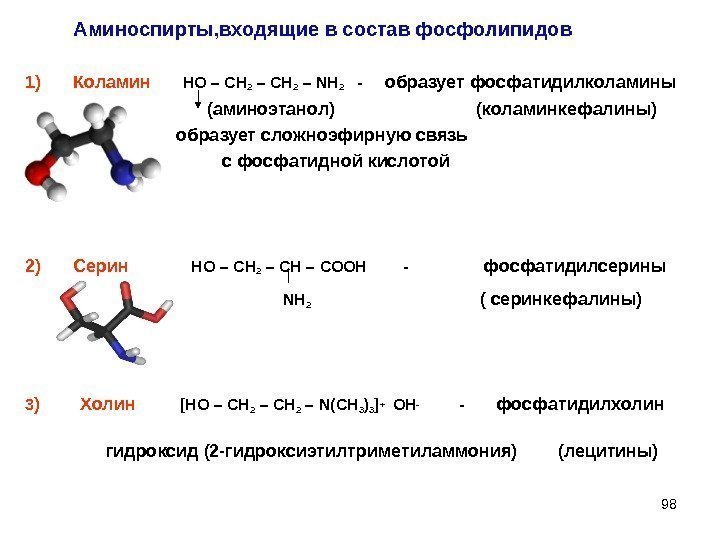
 981) Коламин НО – СН 2 – NH 2 — образует фосфатидилколамины (аминоэтанол) (коламинкефалины) образует сложноэфирную связь с фосфатидной кислотой 2) Серин НО – СН 2 – СН – СООН — фосфатидилсерины NH 2 ( серинкефалины) 3 ) Холин [ НО – СН 2 – N(CH 3 )3 ]+ ОН- — фосфатидилхолин гидроксид (2 -гидроксиэтилтриметиламмония) (лецитины)Аминоспирты, входящие в состав фосфолипидов
981) Коламин НО – СН 2 – NH 2 — образует фосфатидилколамины (аминоэтанол) (коламинкефалины) образует сложноэфирную связь с фосфатидной кислотой 2) Серин НО – СН 2 – СН – СООН — фосфатидилсерины NH 2 ( серинкефалины) 3 ) Холин [ НО – СН 2 – N(CH 3 )3 ]+ ОН- — фосфатидилхолин гидроксид (2 -гидроксиэтилтриметиламмония) (лецитины)Аминоспирты, входящие в состав фосфолипидов
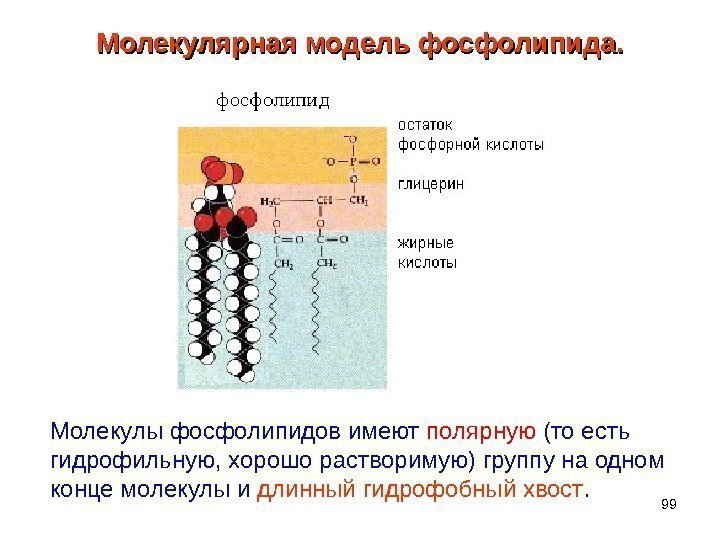
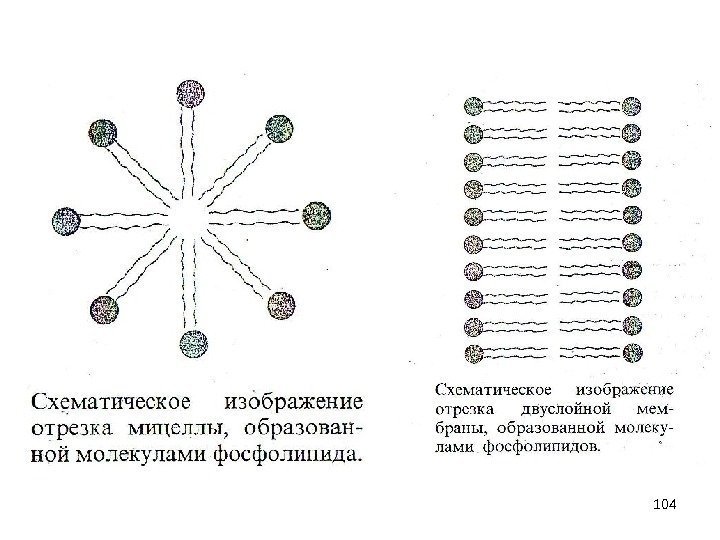
 99 Молекулярная модель фосфолипида. Молекулы фосфолипидов имеют полярную (то есть гидрофильную, хорошо растворимую) группу на одном конце молекулы и длинный гидрофобный хвост.
99 Молекулярная модель фосфолипида. Молекулы фосфолипидов имеют полярную (то есть гидрофильную, хорошо растворимую) группу на одном конце молекулы и длинный гидрофобный хвост.
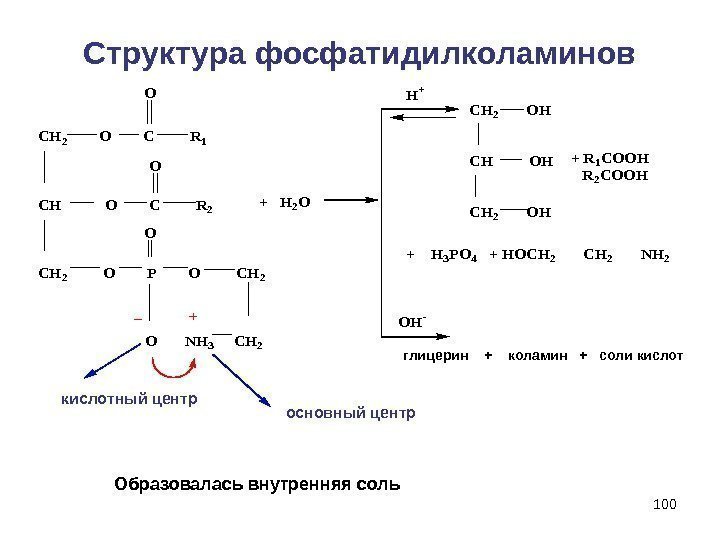
 100 Структура фосфатидилколаминов CH 2 O C R 1 CH O C R 2 CH 2 O P O CH 2 O NH 3 CH 2 O O O + H 2 O OH- H+ CH 2 OH + R 1 COOH R 2 COOH + H 3 PO 4 + HOCH 2 NH 2 глицерин + коламин + соли кислот Образовалась внутренняя соль основный центркислотный центр
100 Структура фосфатидилколаминов CH 2 O C R 1 CH O C R 2 CH 2 O P O CH 2 O NH 3 CH 2 O O O + H 2 O OH- H+ CH 2 OH + R 1 COOH R 2 COOH + H 3 PO 4 + HOCH 2 NH 2 глицерин + коламин + соли кислот Образовалась внутренняя соль основный центркислотный центр
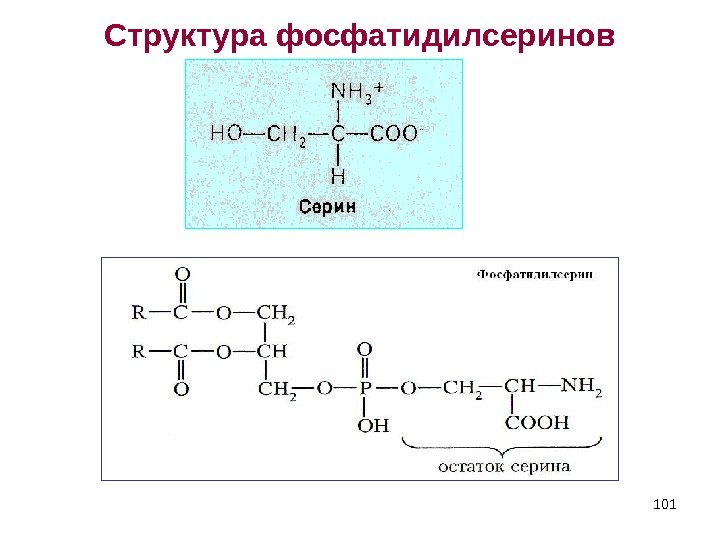
 101 Структура фосфатидилсеринов
101 Структура фосфатидилсеринов
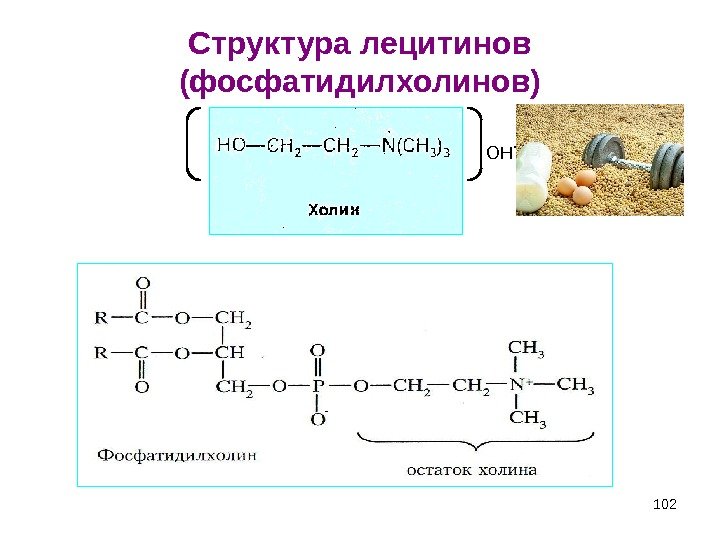
 102 Структура лецитинов (фосфатидилхолинов) — OH —
102 Структура лецитинов (фосфатидилхолинов) — OH —
 103 Фосфатидилхолины Наиболее распространенные глицерофосфолипиды – это фосфатидилхолины (лецитины). Лецитины — сложные эфиры глицерина с фосфорилхолином и двумя остатками жирных кислот, из которых одна — ненасыщенная; содержатся во всех клетках, преимущественно в биологических мембранах, участвуя в процессах переноса через них различных веществ.
103 Фосфатидилхолины Наиболее распространенные глицерофосфолипиды – это фосфатидилхолины (лецитины). Лецитины — сложные эфиры глицерина с фосфорилхолином и двумя остатками жирных кислот, из которых одна — ненасыщенная; содержатся во всех клетках, преимущественно в биологических мембранах, участвуя в процессах переноса через них различных веществ.

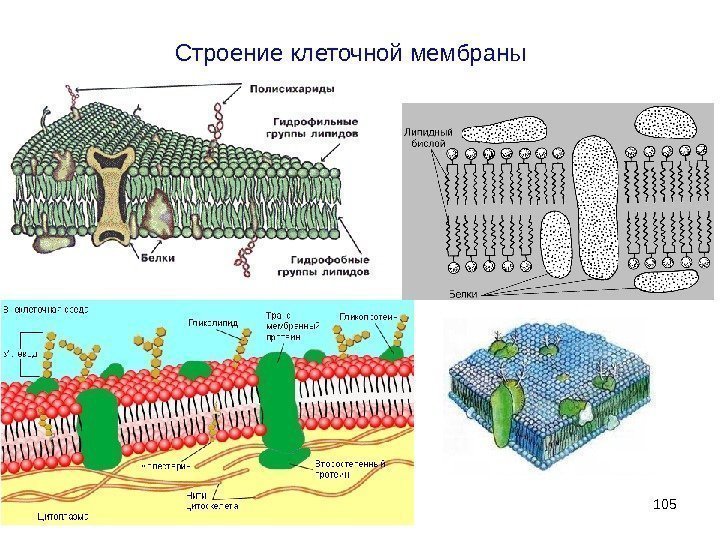
 Строение клеточной мембраны
Строение клеточной мембраны
 106 СПАСИБО ЗА ВНИМАНИЕ!
106 СПАСИБО ЗА ВНИМАНИЕ!
