1 Кафедра общей и медицинской химии




























6.2._biopolimery.ppt
- Размер: 23.4 Мб
- Автор:
- Количество слайдов: 79
Описание презентации 1 Кафедра общей и медицинской химии по слайдам
 1 Кафедра общей и медицинской химии Биополимеры Лекция 6 — II
1 Кафедра общей и медицинской химии Биополимеры Лекция 6 — II
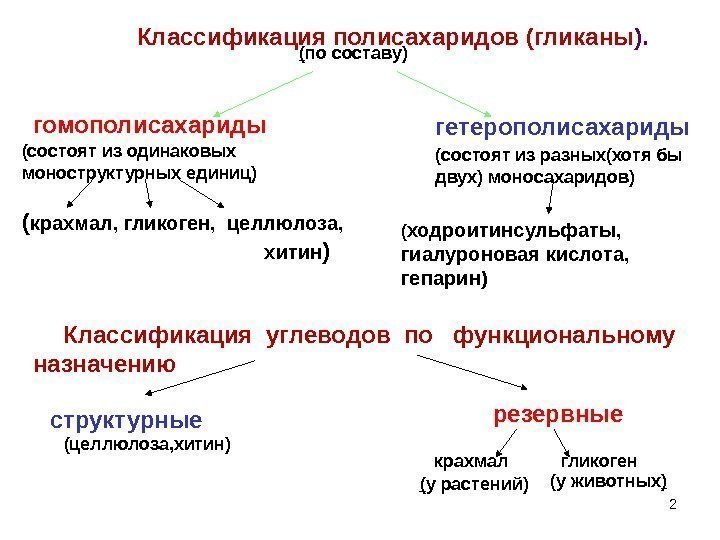
 2 Классификация полисахаридов (гликаны ). ( по составу) гомополисахариды гетерополисахариды (состоят из одинаковых моноструктурных единиц) ( крахмал, гликоген, целлюлоза, хитин ) ( ходроитинсульфаты, гиалуроновая кислота, гепарин) Классификация углеводов по функциональному назначению структурные резервные (целлюлоза, хитин) крахмал ( у растений) гликоген (у животных )(состоят из разных(хотя бы двух) моносахаридов)
2 Классификация полисахаридов (гликаны ). ( по составу) гомополисахариды гетерополисахариды (состоят из одинаковых моноструктурных единиц) ( крахмал, гликоген, целлюлоза, хитин ) ( ходроитинсульфаты, гиалуроновая кислота, гепарин) Классификация углеводов по функциональному назначению структурные резервные (целлюлоза, хитин) крахмал ( у растений) гликоген (у животных )(состоят из разных(хотя бы двух) моносахаридов)
 3 Образуется в результате фотосинтеза в растениях и накапливается в клубнях, семенах, корнях Крахмал : Мм – 106 — 107, (С 6 Н 10 О 5 ) n состоит из моносахаридных звеньев -D— глюкопиранозы. Включает 2 фракции: амилоза (линейная 10 – 20 %) и разветвленная – амилопектин ( 80 -90%). Крахмал :
3 Образуется в результате фотосинтеза в растениях и накапливается в клубнях, семенах, корнях Крахмал : Мм – 106 — 107, (С 6 Н 10 О 5 ) n состоит из моносахаридных звеньев -D— глюкопиранозы. Включает 2 фракции: амилоза (линейная 10 – 20 %) и разветвленная – амилопектин ( 80 -90%). Крахмал :
 4 В горячей воде набухает и подвергается гидролизу, в результате образуются более мелкие полисахариды, конечным продуктом является глюкоза. ( С 6 Н 10 О 5 ) m m<n( С 6 Н 10 О 5 ) n декстрины глю. гидролиз В пищеварительном тракте (основная цепь) происходит гидролиз крахмала – ферментативный и расщепляются (1 4) и (1 6) связи. Конечный продукт мальтоза и глюкоза. олигосахариды Мальтоза Крахмал :
4 В горячей воде набухает и подвергается гидролизу, в результате образуются более мелкие полисахариды, конечным продуктом является глюкоза. ( С 6 Н 10 О 5 ) m m<n( С 6 Н 10 О 5 ) n декстрины глю. гидролиз В пищеварительном тракте (основная цепь) происходит гидролиз крахмала – ферментативный и расщепляются (1 4) и (1 6) связи. Конечный продукт мальтоза и глюкоза. олигосахариды Мальтоза Крахмал :
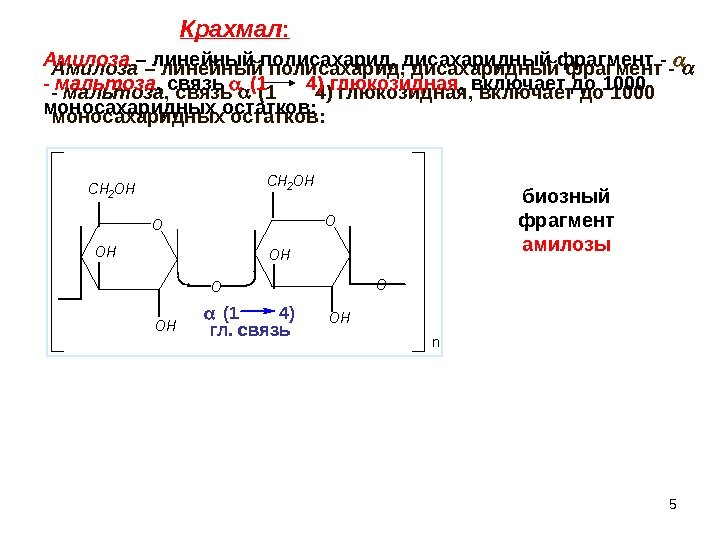
 5 OO CH 2 OH OH OH O n. Амилоза – линейный полисахарид, дисахаридный фрагмент — — мальтоза , связь (1 4) глюкозидная , включает до 1000 моносахаридных остатков: Амилоза – линейный полисахарид, дисахаридный фрагмент — — мальтоза , связь (1 4) глюкозидная , включает до 1000 моносахаридных остатков: (1 4) гл. связь биозный фрагмент амилозы. Крахмал :
5 OO CH 2 OH OH OH O n. Амилоза – линейный полисахарид, дисахаридный фрагмент — — мальтоза , связь (1 4) глюкозидная , включает до 1000 моносахаридных остатков: Амилоза – линейный полисахарид, дисахаридный фрагмент — — мальтоза , связь (1 4) глюкозидная , включает до 1000 моносахаридных остатков: (1 4) гл. связь биозный фрагмент амилозы. Крахмал :
 6 Неразветвленная макромолекула свернута в спираль, на каждый виток приходится 6 моносахаридных звеньев. Внутри спирали могут проходить молекулы, если их размеры позволяют, и образуются соединения включения, так , качественная реакция на I 2 — образование адсорбционного комплекса синего цвета (соединения включения). Крахмал : Амилоза
6 Неразветвленная макромолекула свернута в спираль, на каждый виток приходится 6 моносахаридных звеньев. Внутри спирали могут проходить молекулы, если их размеры позволяют, и образуются соединения включения, так , качественная реакция на I 2 — образование адсорбционного комплекса синего цвета (соединения включения). Крахмал : Амилоза
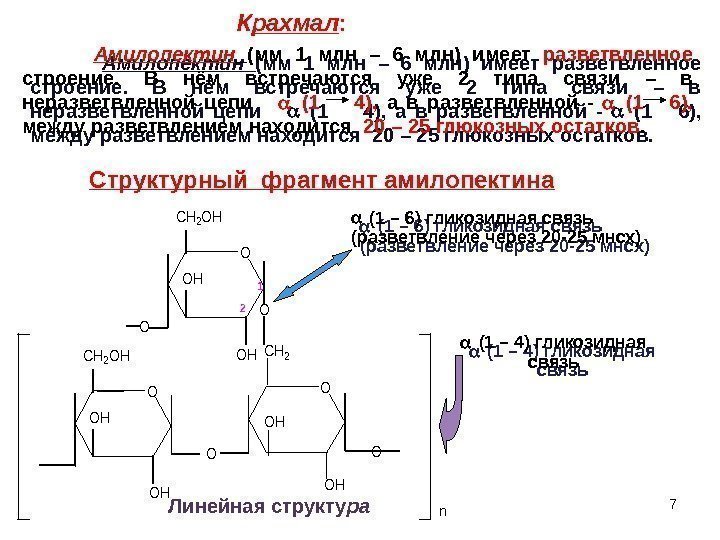
 7 OO CH 2 OH OH OH O CH 2 OH OH O O CH 2 OH OH OH O O 1 2 n. Амилопектин (мм 1 млн – 6 млн) имеет разветвленное строение. В нём встречаются уже 2 типа связи – в неразветвленной цепи (1 4), а в разветвленной — (1 6), между разветвлением находится 20 – 25 глюкозных остатков. Структурный фрагмент амилопектина (1 – 6) гликозидная связь (разветвление через 20 -25 мнсх) (1 – 4) гликозидная связь Линейная структу ра. К рахмал :
7 OO CH 2 OH OH OH O CH 2 OH OH O O CH 2 OH OH OH O O 1 2 n. Амилопектин (мм 1 млн – 6 млн) имеет разветвленное строение. В нём встречаются уже 2 типа связи – в неразветвленной цепи (1 4), а в разветвленной — (1 6), между разветвлением находится 20 – 25 глюкозных остатков. Структурный фрагмент амилопектина (1 – 6) гликозидная связь (разветвление через 20 -25 мнсх) (1 – 4) гликозидная связь Линейная структу ра. К рахмал :
 8 Гликоген – животный крахмал, это структурный и функциональный аналог растительного крахмала, вернее, ее разветвленной фракции – амилопектина. Основное отличие гликогена от амилопектина – значительно большая разветвленность цепей – через каждые 6 – 12 звеньев (почти в два раза, по сравнению с амилопектином) и большая молекулярная масса (100 млн). В организме гликоген содержится преимущественно в печени (до 2, 0 6, 0%), . . . ‒Гликоген
8 Гликоген – животный крахмал, это структурный и функциональный аналог растительного крахмала, вернее, ее разветвленной фракции – амилопектина. Основное отличие гликогена от амилопектина – значительно большая разветвленность цепей – через каждые 6 – 12 звеньев (почти в два раза, по сравнению с амилопектином) и большая молекулярная масса (100 млн). В организме гликоген содержится преимущественно в печени (до 2, 0 6, 0%), . . . ‒Гликоген
 9 Сильное разветвление обеспечивает гликогену выполнение энергетической функции , позволяя в стрессовых ситуациях быстро отщеплять нужное количество глюкозы по многочисленным разветвлениям. Большая молекулярная масса помогает выполнить функцию резервного углевода. Он из-за больших размеров не может проникать через клеточную мембрану и депонирован в клетках, пока не возникает потребность в энергии. ! А глюкоза-основной источник энергии для организма Гликоген
9 Сильное разветвление обеспечивает гликогену выполнение энергетической функции , позволяя в стрессовых ситуациях быстро отщеплять нужное количество глюкозы по многочисленным разветвлениям. Большая молекулярная масса помогает выполнить функцию резервного углевода. Он из-за больших размеров не может проникать через клеточную мембрану и депонирован в клетках, пока не возникает потребность в энергии. ! А глюкоза-основной источник энергии для организма Гликоген
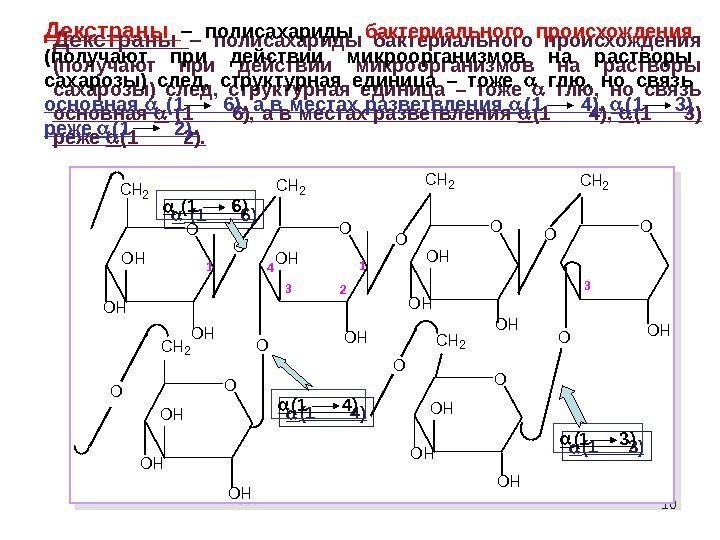
 10 O OH 1 2 O OH CH 2 OH OOO O O CH 2 CH 2 OHOH OH OH 3 4 CH 2 OH OH 3 Декстраны – полисахариды бактериального происхождения (получают при действии микроорганизмов на растворы сахарозы) след, структурная единица – тоже глю, но связь основная (1 6), а в местах разветвления (1 4), (1 3) реже (1 2). (1 6) (1 4) (1 3)
10 O OH 1 2 O OH CH 2 OH OOO O O CH 2 CH 2 OHOH OH OH 3 4 CH 2 OH OH 3 Декстраны – полисахариды бактериального происхождения (получают при действии микроорганизмов на растворы сахарозы) след, структурная единица – тоже глю, но связь основная (1 6), а в местах разветвления (1 4), (1 3) реже (1 2). (1 6) (1 4) (1 3)
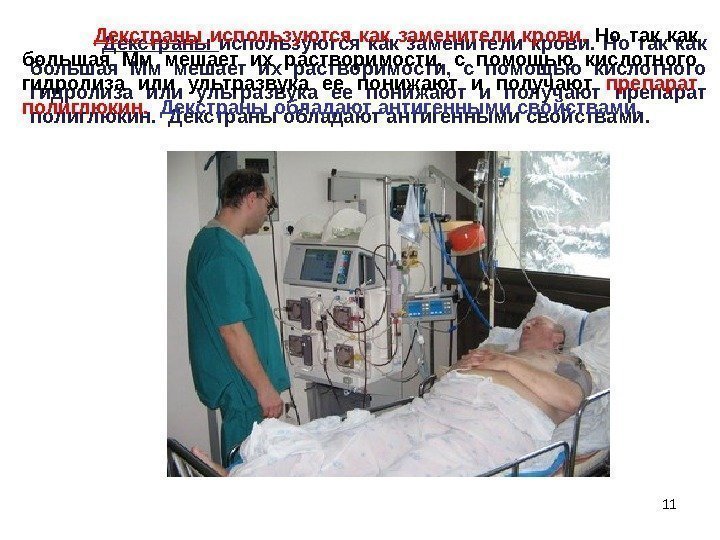
 11 Декстраны используются как заменители крови. Но так как большая Мм мешает их растворимости, с помощью кислотного гидролиза или ультразвука ее понижают и получают препарат полиглюкин. Декстраны обладают антигенными свойствами.
11 Декстраны используются как заменители крови. Но так как большая Мм мешает их растворимости, с помощью кислотного гидролиза или ультразвука ее понижают и получают препарат полиглюкин. Декстраны обладают антигенными свойствами.
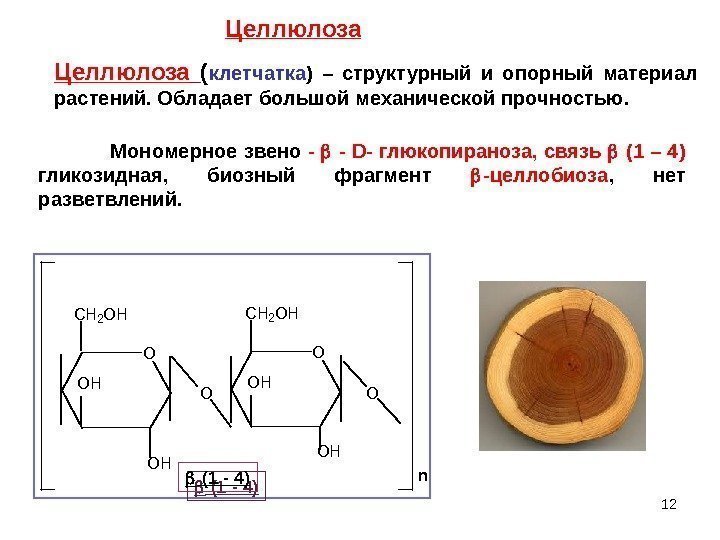
 12 Целлюлоза ( клетчатка ) – структурный и опорный материал растений. Обладает большой механической прочностью. Мономерное звено — — D- глюкопираноза, связь (1 – 4) гликозидная, биозный фрагмент -целлобиоза , нет разветвлений. O OH O CH 2 OH OH OH O n (1 — 4) Целлюлоза
12 Целлюлоза ( клетчатка ) – структурный и опорный материал растений. Обладает большой механической прочностью. Мономерное звено — — D- глюкопираноза, связь (1 – 4) гликозидная, биозный фрагмент -целлобиоза , нет разветвлений. O OH O CH 2 OH OH OH O n (1 — 4) Целлюлоза
 13 В макромолекуле содержится (2500 – 12 тыс. ) глюкозных звеньев. Мм достигает 1 – 2 млн. Линейное строение обусловлено конфигурацией ОН – полуацетального. Кроме того, этому способствует образование водородных связей внутри цепи и между цепями. Такая упаковка цепей обеспечивает механическую прочность, волокнистость, нерастворимость в воде, химическую инертность. Целлюлоза
13 В макромолекуле содержится (2500 – 12 тыс. ) глюкозных звеньев. Мм достигает 1 – 2 млн. Линейное строение обусловлено конфигурацией ОН – полуацетального. Кроме того, этому способствует образование водородных связей внутри цепи и между цепями. Такая упаковка цепей обеспечивает механическую прочность, волокнистость, нерастворимость в воде, химическую инертность. Целлюлоза
 14 Целлюлоза не расщепляется ферментом, желудочно-кишечного тракта (нет глюкозидазы), но есть необходимые вещества, активизирующие перистальтику желудка и кишечника. Целлюлоза
14 Целлюлоза не расщепляется ферментом, желудочно-кишечного тракта (нет глюкозидазы), но есть необходимые вещества, активизирующие перистальтику желудка и кишечника. Целлюлоза
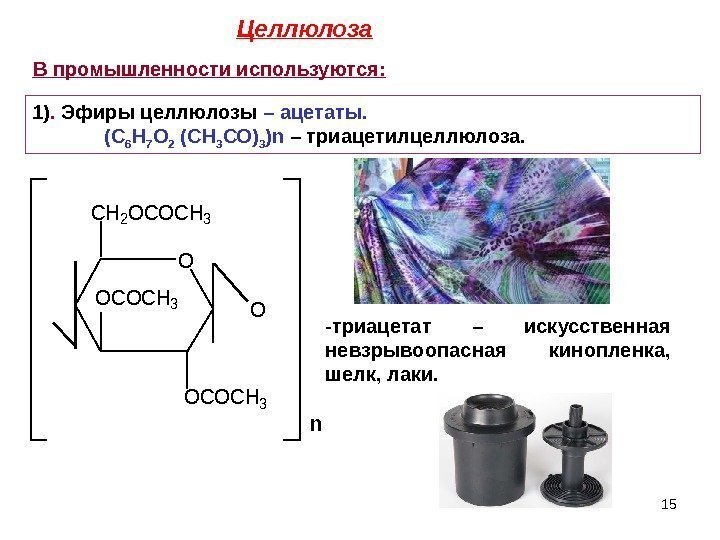
 15 O OCOCH 3 O CH 2 OCOCH 3 n. В промышленности используются: 1). Эфиры целлюлозы – ацетаты. (С 6 Н 7 О 2 (СН 3 СО) 3 ) n – триацетилцеллюлоза. — триацетат – искусственная невзрывоопасная кинопленка, шелк, лаки. Целлюлоза
15 O OCOCH 3 O CH 2 OCOCH 3 n. В промышленности используются: 1). Эфиры целлюлозы – ацетаты. (С 6 Н 7 О 2 (СН 3 СО) 3 ) n – триацетилцеллюлоза. — триацетат – искусственная невзрывоопасная кинопленка, шелк, лаки. Целлюлоза
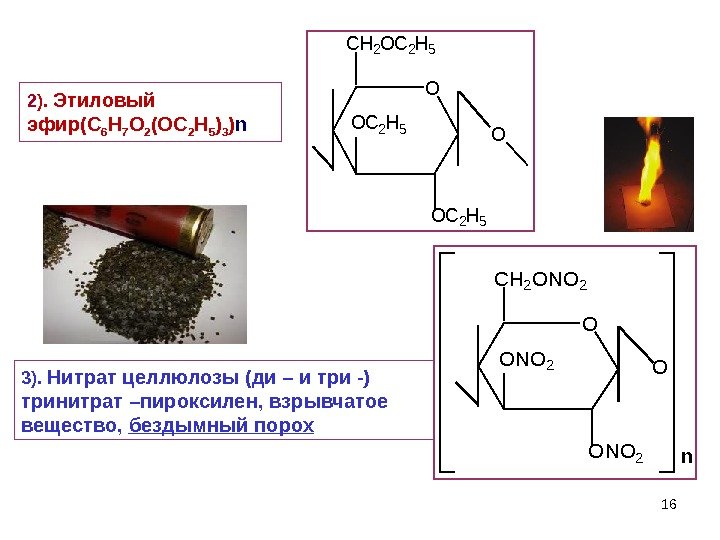
 163). Нитрат целлюлозы (ди – и три -) тринитрат –пироксилен, взрывчатое вещество, бездымный порох. O ONO 2 O CH 2 ONO 2 n O OC 2 H 5 O CH 2 OC 2 H 52 ). Этиловый эфир(С 6 Н 7 О 2 (ОС 2 Н 5 ) 3 ) n
163). Нитрат целлюлозы (ди – и три -) тринитрат –пироксилен, взрывчатое вещество, бездымный порох. O ONO 2 O CH 2 ONO 2 n O OC 2 H 5 O CH 2 OC 2 H 52 ). Этиловый эфир(С 6 Н 7 О 2 (ОС 2 Н 5 ) 3 ) n
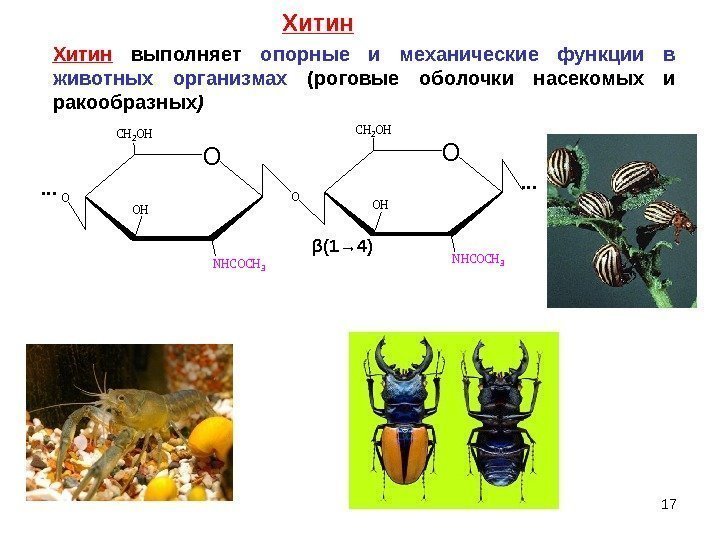
 Хитин выполняет опорные и механические функции в животных организмах (роговые оболочки насекомых и ракообразных )O CH 2 OH OH NHCOCH 3 O … … β (1→ 4) 17 Хитин
Хитин выполняет опорные и механические функции в животных организмах (роговые оболочки насекомых и ракообразных )O CH 2 OH OH NHCOCH 3 O … … β (1→ 4) 17 Хитин
 18 Гетерополисахариды – состоят из остатков разных моносахаридов. Изучены меньше, чем гомополисахариды. Очень важны гетерополисахариды соединительной ткани , которая распространена по всему организму: кожа, хрящи, сухожилия, роговица, стенки крупных кровеносных сосудов, суставная жидкость, кости. Соединительная ткань обуславливает прочность и упругость органов, эластичность, стойкость к проникновению молекул. Гетерополисахариды связаны с белками. рыхлаяплотная соединительнаяткань хрящ, кость,
18 Гетерополисахариды – состоят из остатков разных моносахаридов. Изучены меньше, чем гомополисахариды. Очень важны гетерополисахариды соединительной ткани , которая распространена по всему организму: кожа, хрящи, сухожилия, роговица, стенки крупных кровеносных сосудов, суставная жидкость, кости. Соединительная ткань обуславливает прочность и упругость органов, эластичность, стойкость к проникновению молекул. Гетерополисахариды связаны с белками. рыхлаяплотная соединительнаяткань хрящ, кость,
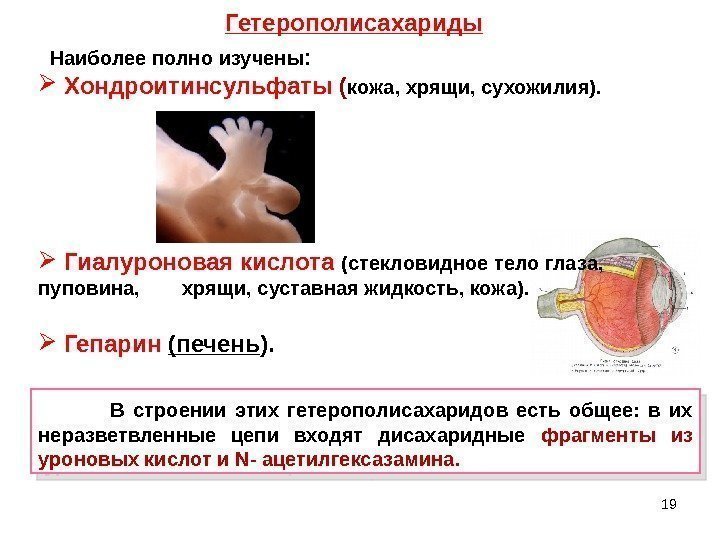
 19 В строении этих гетерополисахаридов есть общее: в их неразветвленные цепи входят дисахаридные фрагменты из уроновых кислот и N — ацетилгексазамина. Наиболее полно изучены : Хондроитинсульфаты ( кожа, хрящи, сухожилия). Гиалуроновая кислота (стекловидное тело глаза, пуповина, хрящи, суставная жидкость, кожа). Гепарин (печень ). Гетерополисахариды
19 В строении этих гетерополисахаридов есть общее: в их неразветвленные цепи входят дисахаридные фрагменты из уроновых кислот и N — ацетилгексазамина. Наиболее полно изучены : Хондроитинсульфаты ( кожа, хрящи, сухожилия). Гиалуроновая кислота (стекловидное тело глаза, пуповина, хрящи, суставная жидкость, кожа). Гепарин (печень ). Гетерополисахариды
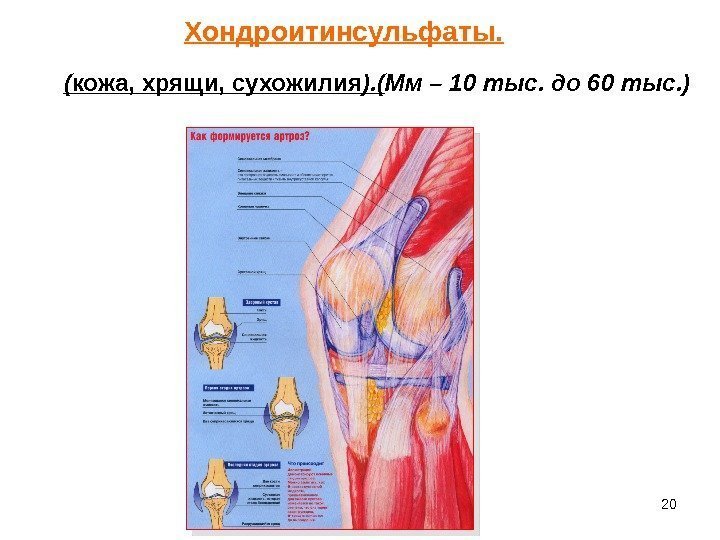
 20 Хондроитинсульфаты. ( кожа, хрящи, сухожилия ). ( Мм – 10 тыс. до 60 тыс. )
20 Хондроитинсульфаты. ( кожа, хрящи, сухожилия ). ( Мм – 10 тыс. до 60 тыс. )
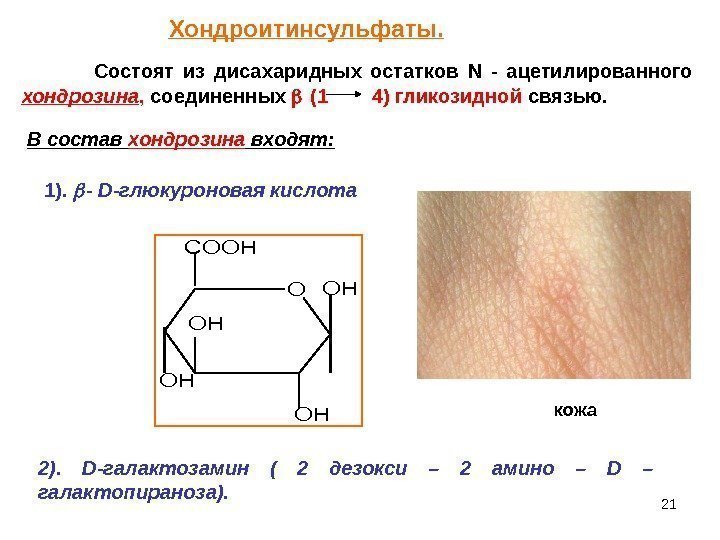
 21 Состоят из дисахаридных остатков N — ацетилированного хондрозина , соединенных (1 4) гликозидной связью. В состав хондрозина входят: 1). — D -глюкуроновая кислота O OH OH COOH OH OH 2). D -галактозамин ( 2 дезокси – 2 амино – D – галактопираноза). кожа. Хондроитинсульфаты.
21 Состоят из дисахаридных остатков N — ацетилированного хондрозина , соединенных (1 4) гликозидной связью. В состав хондрозина входят: 1). — D -глюкуроновая кислота O OH OH COOH OH OH 2). D -галактозамин ( 2 дезокси – 2 амино – D – галактопираноза). кожа. Хондроитинсульфаты.
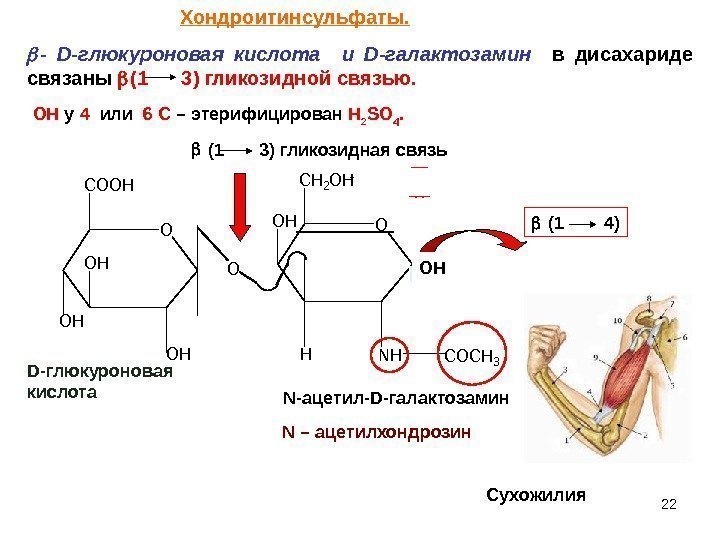
 22 OO COOH OH CH 2 OH OHHNHCOCH 3 OHO CH 2 SO 4 — D -глюкуроновая кислота и D -галактозамин в дисахариде связаны (1 3) гликозидной связью. (1 3) гликозидная связь (1 4) D -глюкуроновая кислота N -ацетил- D -галактозамин N – ацетилхондрозин ОН Сухожилия. Хондроитинсульфаты. ОН у 4 или 6 С – этерифицирован Н 2 SO 4.
22 OO COOH OH CH 2 OH OHHNHCOCH 3 OHO CH 2 SO 4 — D -глюкуроновая кислота и D -галактозамин в дисахариде связаны (1 3) гликозидной связью. (1 3) гликозидная связь (1 4) D -глюкуроновая кислота N -ацетил- D -галактозамин N – ацетилхондрозин ОН Сухожилия. Хондроитинсульфаты. ОН у 4 или 6 С – этерифицирован Н 2 SO 4.
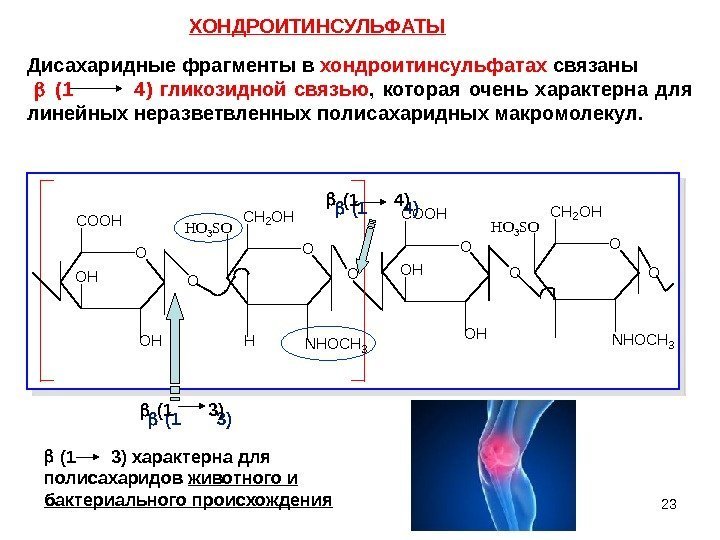
 23 O COOH OH O CH 2 OH OHH O O COOH OH OH O CH 2 OH NHOCH 3 OOO HO 3 SO NHOCH 3 ХОНДРОИТИНСУЛЬФАТЫ Дисахаридные фрагменты в хондроитинсульфатах связаны (1 4) гликозидной связью , которая очень характерна для линейных неразветвленных полисахаридных макромолекул. (1 3) (1 4) (1 3) характерна для полисахаридов животного и бактериального происхождения
23 O COOH OH O CH 2 OH OHH O O COOH OH OH O CH 2 OH NHOCH 3 OOO HO 3 SO NHOCH 3 ХОНДРОИТИНСУЛЬФАТЫ Дисахаридные фрагменты в хондроитинсульфатах связаны (1 4) гликозидной связью , которая очень характерна для линейных неразветвленных полисахаридных макромолекул. (1 3) (1 4) (1 3) характерна для полисахаридов животного и бактериального происхождения
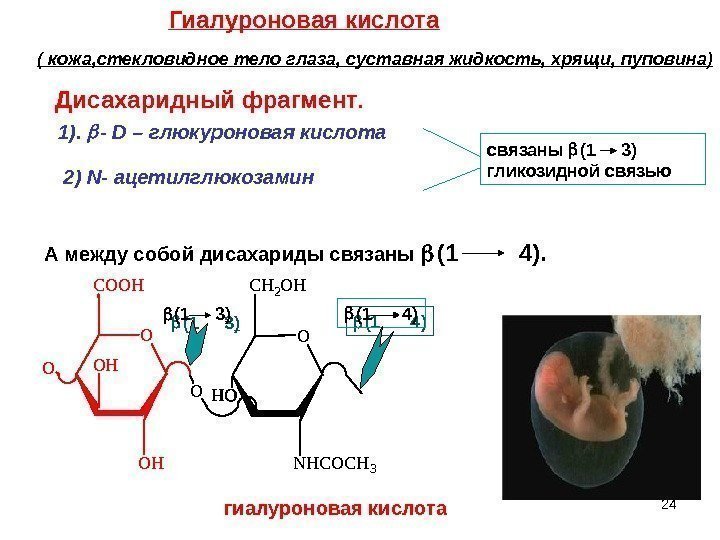
 O O HC O O H O O N H C O C H 3 C H 2 O H O 24 Гиалуроновая кислота ( кожа, стекловидное тело глаза, суставная жидкость, хрящи, пуповина) Дисахаридный фрагмент. 1). — D – глюкуроновая кислота 2) N — ацетилглюкозамин связаны (1 3) гликозидной связью А между собой дисахариды связаны (1 4). (1 3 ) (1 4) гиалуроновая кислота
O O HC O O H O O N H C O C H 3 C H 2 O H O 24 Гиалуроновая кислота ( кожа, стекловидное тело глаза, суставная жидкость, хрящи, пуповина) Дисахаридный фрагмент. 1). — D – глюкуроновая кислота 2) N — ацетилглюкозамин связаны (1 3) гликозидной связью А между собой дисахариды связаны (1 4). (1 3 ) (1 4) гиалуроновая кислота
 25 Гиалуроновая кислота Одним из основных факторов старения кожи является снижение содержания гиалуроновой кислоты и тесно связанное с этим уменьшение естественного запаса влаги в коже. Широко используется косметологии для омоложения кожи
25 Гиалуроновая кислота Одним из основных факторов старения кожи является снижение содержания гиалуроновой кислоты и тесно связанное с этим уменьшение естественного запаса влаги в коже. Широко используется косметологии для омоложения кожи
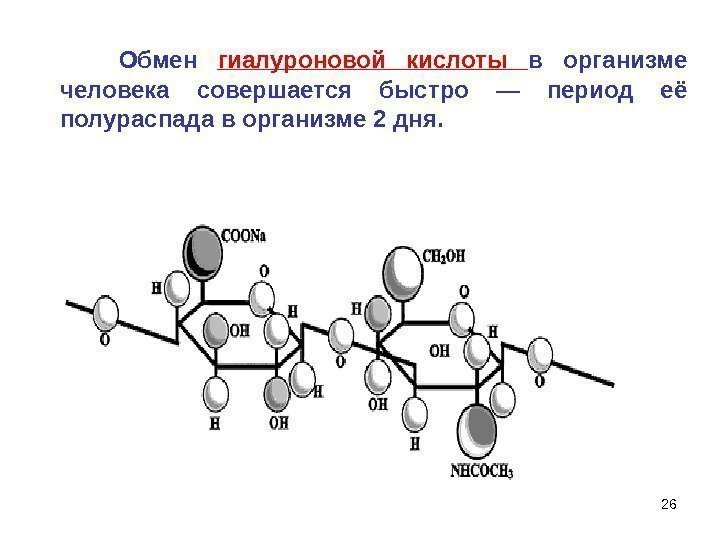
 26 Обмен гиалуроновой кислоты в организме человека совершается быстро — период её полураспада в организме 2 дня.
26 Обмен гиалуроновой кислоты в организме человека совершается быстро — период её полураспада в организме 2 дня.
 27 Гидролиз гиалуроновой кислоты осуществляется гиалуронидазой, которая присутствует в оболочках болезнетворных бактерий, сперме, яде змей, пауков, пчёл, слюнных выделениях пиявок, быстро растущих опухолях.
27 Гидролиз гиалуроновой кислоты осуществляется гиалуронидазой, которая присутствует в оболочках болезнетворных бактерий, сперме, яде змей, пауков, пчёл, слюнных выделениях пиявок, быстро растущих опухолях.
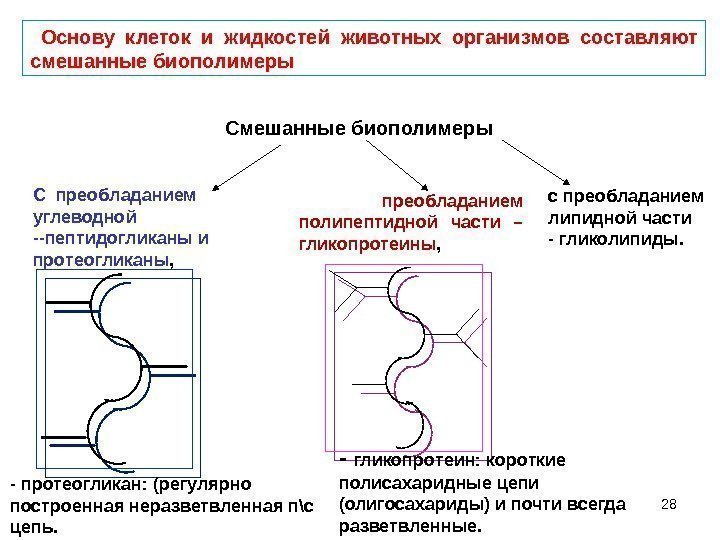
 28 Основу клеток и жидкостей животных организмов составляют смешанные биополимеры С преобладанием углеводной —пептидогликаны и протеогликаны , преобладанием полипептидной части – гликопротеины , Смешанные биополимеры с преобладанием липидной части — гликолипиды. — протеогликан: (регулярно построенная неразветвленная п\с цепь. — гликопротеин: короткие полисахаридные цепи (олигосахариды) и почти всегда разветвленные.
28 Основу клеток и жидкостей животных организмов составляют смешанные биополимеры С преобладанием углеводной —пептидогликаны и протеогликаны , преобладанием полипептидной части – гликопротеины , Смешанные биополимеры с преобладанием липидной части — гликолипиды. — протеогликан: (регулярно построенная неразветвленная п\с цепь. — гликопротеин: короткие полисахаридные цепи (олигосахариды) и почти всегда разветвленные.
 29 Хондроитинсульфаты в свободном состоянии не встречаются, они всегда связаны с белками. На конце цепи хондроитинсульфата имеется тетрасахаридный фрагмент , посредством которого осуществляется связь с полипептидной цепью Тетрасахаридный мостик состоит из D- глюкуроновой кислоты , 2 х остатков D — галактопиранозы и остатка D- ксилопиранозы.
29 Хондроитинсульфаты в свободном состоянии не встречаются, они всегда связаны с белками. На конце цепи хондроитинсульфата имеется тетрасахаридный фрагмент , посредством которого осуществляется связь с полипептидной цепью Тетрасахаридный мостик состоит из D- глюкуроновой кислоты , 2 х остатков D — галактопиранозы и остатка D- ксилопиранозы.
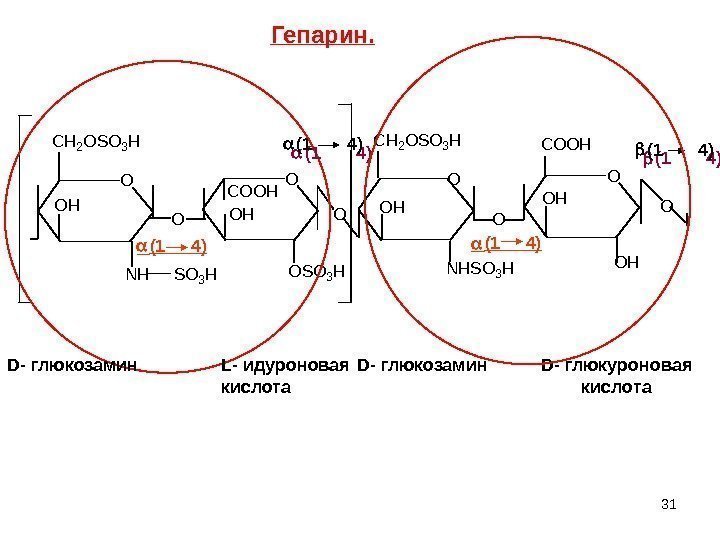
 30 Дисахаридные остатки: D – глюкозамин и 2 уроновые кислоты – D — глюкуроновая и L — идуроновая. Гепарин. содержится в печени ( Мм = 16 тыс. – 20 тыс. ) Преобладает L — идуроновая. В дисахаридном фрагменте связь (1 — 4), если L — идуроновая и (1 – 4) если D — глюкуроновая , кроме того, NH 2 – сульфатирована , у некоторых – ацетилирована. В клинической практике известен как вещество, препятствующее свёртыванию крови — антикоагулянт
30 Дисахаридные остатки: D – глюкозамин и 2 уроновые кислоты – D — глюкуроновая и L — идуроновая. Гепарин. содержится в печени ( Мм = 16 тыс. – 20 тыс. ) Преобладает L — идуроновая. В дисахаридном фрагменте связь (1 — 4), если L — идуроновая и (1 – 4) если D — глюкуроновая , кроме того, NH 2 – сульфатирована , у некоторых – ацетилирована. В клинической практике известен как вещество, препятствующее свёртыванию крови — антикоагулянт
 31 OOO O CH 2 OSO 3 H OH NHSO 3 H OH COOH OSO 3 H CH 2 OSO 3 H OH O COOH OH OHNHSO 3 H (1 4) (1 4) D- глюкозамин L- идуроновая кислота D- глюкозамин D- глюкуроновая кислота. Гепарин.
31 OOO O CH 2 OSO 3 H OH NHSO 3 H OH COOH OSO 3 H CH 2 OSO 3 H OH O COOH OH OHNHSO 3 H (1 4) (1 4) D- глюкозамин L- идуроновая кислота D- глюкозамин D- глюкуроновая кислота. Гепарин.
 32 Биохимические свойства гепарина Синтезируется в организме животных и человека. Антикоагулянтные свойства: препятствует свертываемости крови. Регулятор многих биохимических и физиологических процессов, протекающих в животном организме. Антилипемические свойства. Антимитотическое влияния. Является естественным противосвертывающим фактором.
32 Биохимические свойства гепарина Синтезируется в организме животных и человека. Антикоагулянтные свойства: препятствует свертываемости крови. Регулятор многих биохимических и физиологических процессов, протекающих в животном организме. Антилипемические свойства. Антимитотическое влияния. Является естественным противосвертывающим фактором.
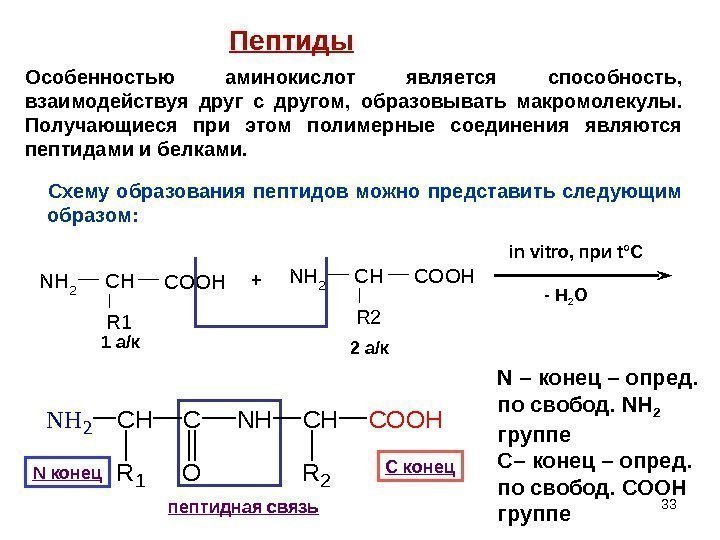
 33 NH 2 CHCOOH R 1 NH 2 CHCOOH R 2+ in vitro, при t °C — H 2 O 1 а/к 2 а/к N конец С конец пептидная связь N – конец – опред. по свобод. NH 2 группе С – конец – опред. по свобод. COOH группе NH 2 CH R 1 C O NHCH R 2 COOHПептиды Схему образования пептидов можно представить следующим образом: Особенностью аминокислот является способность, взаимодействуя друг с другом, образовывать макромолекулы. Получающиеся при этом полимерные соединения являются пептидами и белками.
33 NH 2 CHCOOH R 1 NH 2 CHCOOH R 2+ in vitro, при t °C — H 2 O 1 а/к 2 а/к N конец С конец пептидная связь N – конец – опред. по свобод. NH 2 группе С – конец – опред. по свобод. COOH группе NH 2 CH R 1 C O NHCH R 2 COOHПептиды Схему образования пептидов можно представить следующим образом: Особенностью аминокислот является способность, взаимодействуя друг с другом, образовывать макромолекулы. Получающиеся при этом полимерные соединения являются пептидами и белками.
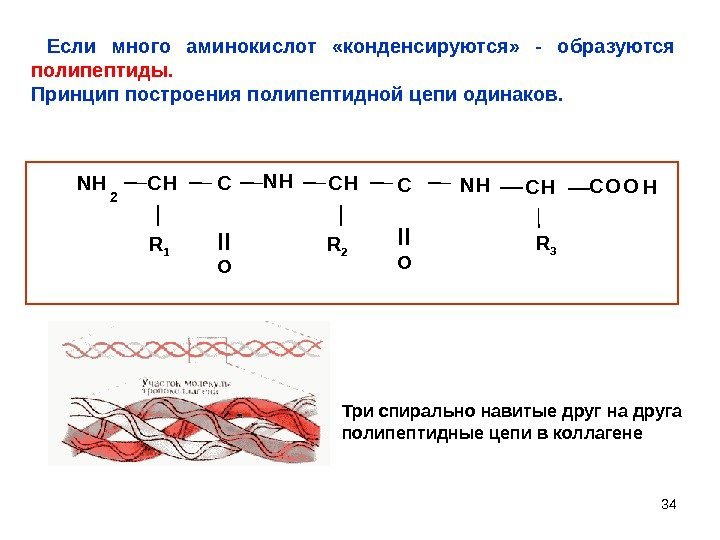
 34 N H 2 C H C R 1 N H C H R 2 C N H C H R 3 C O O H II o Если много аминокислот «конденсируются» — образуются полипептиды. Принцип построения полипептидной цепи одинаков. Три спирально навитые друг на друга полипептидные цепи в коллагене
34 N H 2 C H C R 1 N H C H R 2 C N H C H R 3 C O O H II o Если много аминокислот «конденсируются» — образуются полипептиды. Принцип построения полипептидной цепи одинаков. Три спирально навитые друг на друга полипептидные цепи в коллагене
 35 Все операции проводятся в определённой запрограммированной последовательности Каскадный синтез пептидов. (ала-гли) 1) Защита NH 2 группы I ак (ала) 2) Защита СООН-группы II ак (гли) 3) Активация СООН-группы I ак (ала) 4) Синтез ( S N ) 5) Снятие защиты
35 Все операции проводятся в определённой запрограммированной последовательности Каскадный синтез пептидов. (ала-гли) 1) Защита NH 2 группы I ак (ала) 2) Защита СООН-группы II ак (гли) 3) Активация СООН-группы I ак (ала) 4) Синтез ( S N ) 5) Снятие защиты
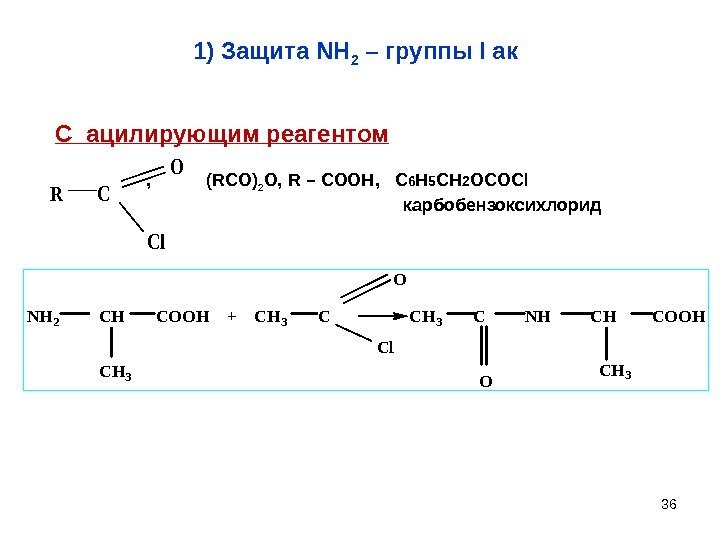
 361) Защита NH 2 – группы I ак. NH 2 CH COOH + CH 3 C NH CH COOH CH 3 O Cl CH 3 O С ацилирующим реагентом , ( RCO ) 2 O, R – COOH , C 6 H 5 CH 2 OCOCl карбобензоксихлорид R C O Cl
361) Защита NH 2 – группы I ак. NH 2 CH COOH + CH 3 C NH CH COOH CH 3 O Cl CH 3 O С ацилирующим реагентом , ( RCO ) 2 O, R – COOH , C 6 H 5 CH 2 OCOCl карбобензоксихлорид R C O Cl
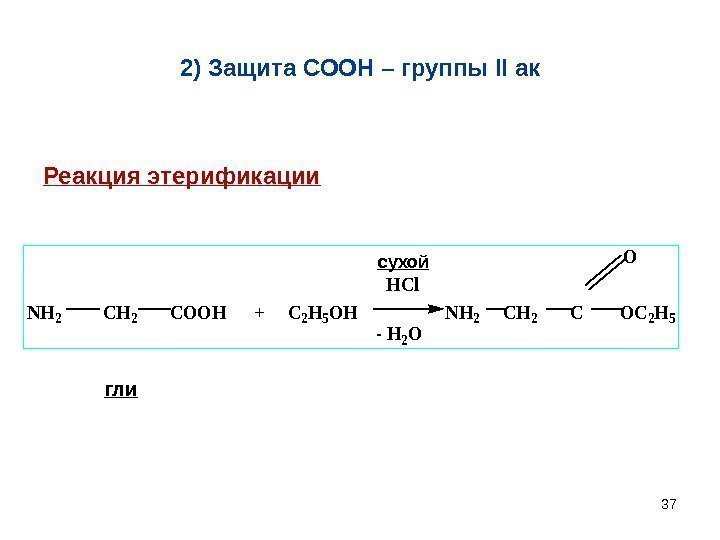
 372) Защита СООН – группы II ак. NH 2 CH 2 COOH + C 2 H 5 OH NH 2 CH 2 C OC 2 H 5 O HCl — H 2 O сухой гли. Реакция этерификации
372) Защита СООН – группы II ак. NH 2 CH 2 COOH + C 2 H 5 OH NH 2 CH 2 C OC 2 H 5 O HCl — H 2 O сухой гли. Реакция этерификации
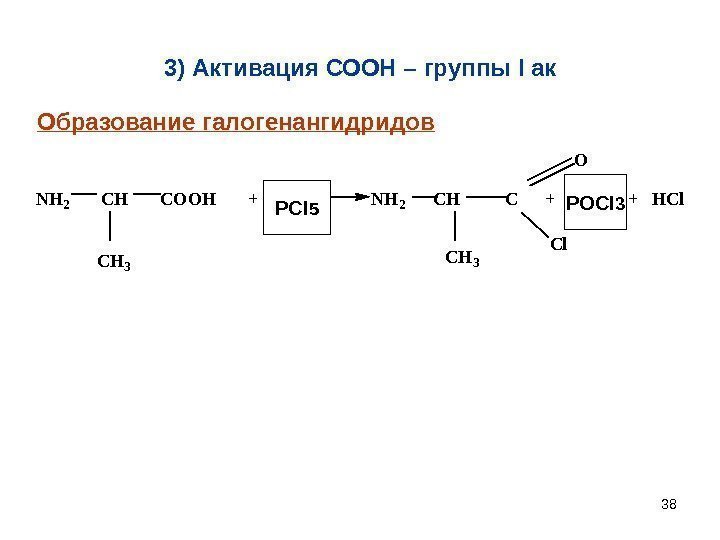
 383) Активация СООН – группы I ак. NH 2 CH COOH + PCl 3 NH 2 CH C + PCl 3 + HCl CH 3 Cl O PCl 5 POCl 3 Образование галогенангидридов
383) Активация СООН – группы I ак. NH 2 CH COOH + PCl 3 NH 2 CH C + PCl 3 + HCl CH 3 Cl O PCl 5 POCl 3 Образование галогенангидридов
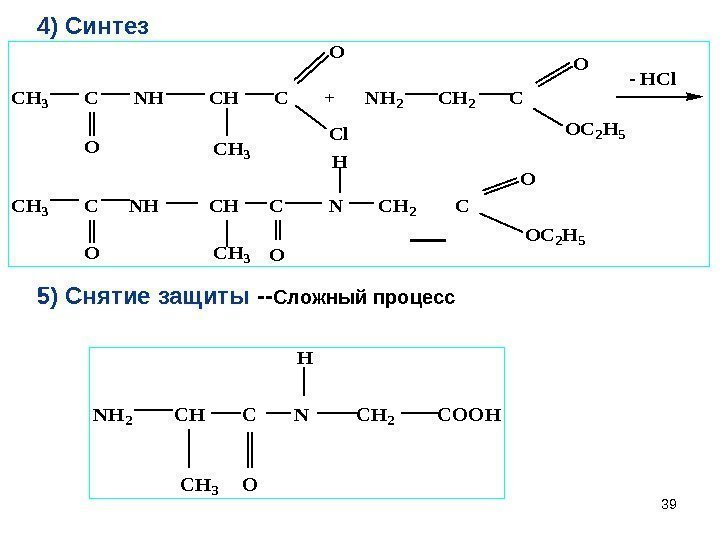
 394) Синтез. CH 3 C NH CH C + NH 2 C CH 3 C NH CH C N CH 2 C — HCl OCH 3 O Cl O OC 2 H 5 OCH 3 O H O OC 2 H 5 5) Снятие защиты — Сложный процесс NH 2 CH C N CH 2 COOH CH 3 O H
394) Синтез. CH 3 C NH CH C + NH 2 C CH 3 C NH CH C N CH 2 C — HCl OCH 3 O Cl O OC 2 H 5 OCH 3 O H O OC 2 H 5 5) Снятие защиты — Сложный процесс NH 2 CH C N CH 2 COOH CH 3 O H
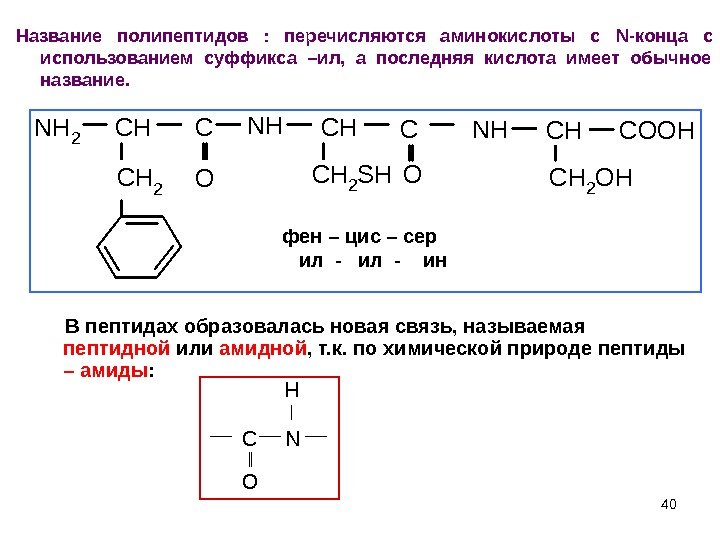
 40 Название полипептидов : перечисляются аминокислоты с N- конца с использованием суффикса –ил, а последняя кислота имеет обычное название. N H 2 C H C C H 2 N H C H 2 S H C N H C H 2 O H C O O H O O фен – цис – сер ил — ин В пептидах образовалась новая связь, называемая пептидной или амидной , т. к. по химической природе пептиды – амиды : CN O H
40 Название полипептидов : перечисляются аминокислоты с N- конца с использованием суффикса –ил, а последняя кислота имеет обычное название. N H 2 C H C C H 2 N H C H 2 S H C N H C H 2 O H C O O H O O фен – цис – сер ил — ин В пептидах образовалась новая связь, называемая пептидной или амидной , т. к. по химической природе пептиды – амиды : CN O H
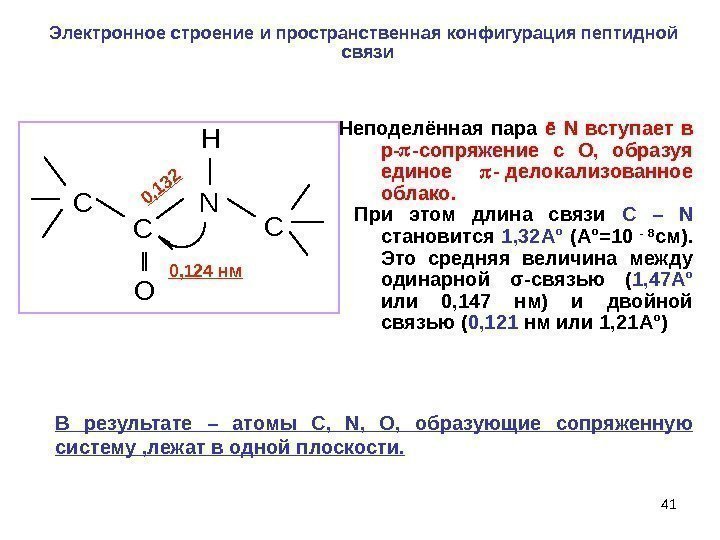
 41 C C O H N C 0, 1320, 124 нм Электронное строение и пространственная конфигурация пептидной связи Неподелённая пара ē N вступает в р- -сопряжение с О, образуя единое — делокализованное облако. При этом длина связи C – N становится 1, 32 А ° (А ° =10 — 8 см). Это средняя величина между одинарной σ -связью ( 1, 47 А ° или 0, 147 нм) и двойной связью ( 0, 121 нм или 1, 21 А ° ) В результате – атомы C, N, O, образующие сопряженную систему , лежат в одной плоскости.
41 C C O H N C 0, 1320, 124 нм Электронное строение и пространственная конфигурация пептидной связи Неподелённая пара ē N вступает в р- -сопряжение с О, образуя единое — делокализованное облако. При этом длина связи C – N становится 1, 32 А ° (А ° =10 — 8 см). Это средняя величина между одинарной σ -связью ( 1, 47 А ° или 0, 147 нм) и двойной связью ( 0, 121 нм или 1, 21 А ° ) В результате – атомы C, N, O, образующие сопряженную систему , лежат в одной плоскости.
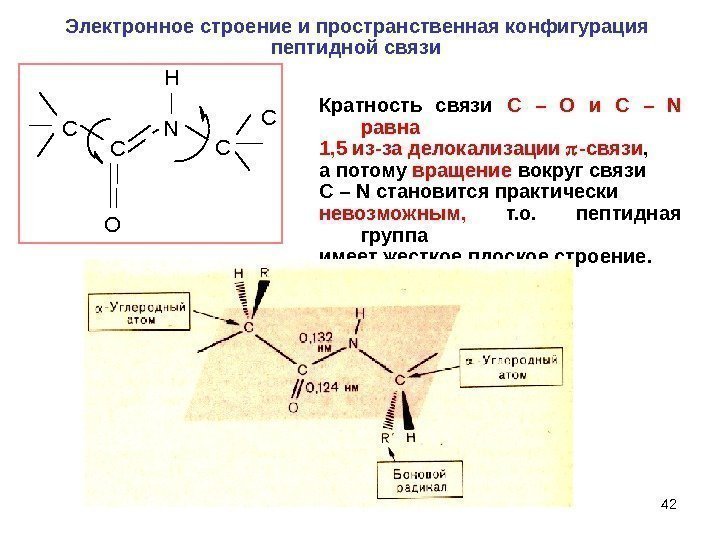
 42 C C O H N C CЭлектронное строение и пространственная конфигурация пептидной связи Кратность связи C – O и C – N равна 1, 5 из-за делокализации -связи , а потому вращение вокруг связи C – N становится практически невозможным, т. о. пептидная группа имеет жесткое плоское строение.
42 C C O H N C CЭлектронное строение и пространственная конфигурация пептидной связи Кратность связи C – O и C – N равна 1, 5 из-за делокализации -связи , а потому вращение вокруг связи C – N становится практически невозможным, т. о. пептидная группа имеет жесткое плоское строение.
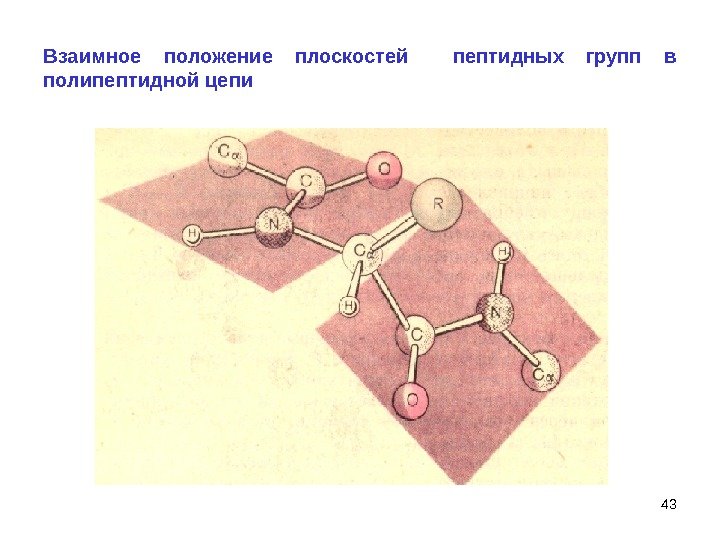
 43 Взаимное положение плоскостей пептидных групп в полипептидной цепи
43 Взаимное положение плоскостей пептидных групп в полипептидной цепи
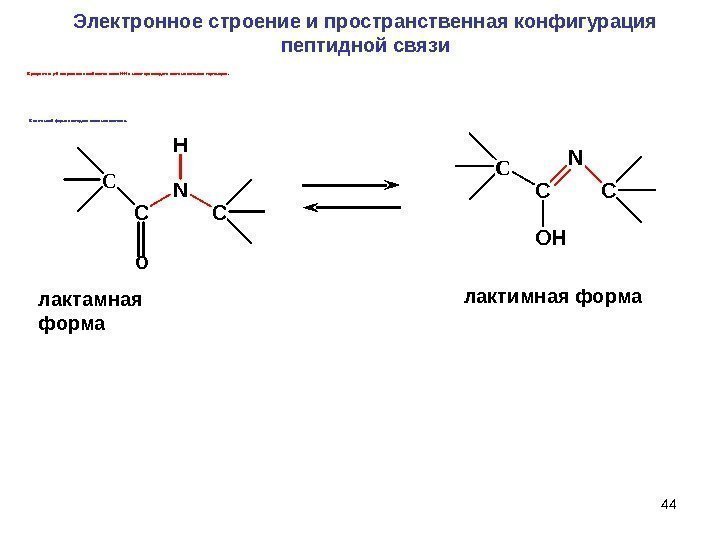
 44 лактамная форма лактимная форма. C C OH N CC C NH CЭлектронное строение и пространственная конфигурация пептидной связи ОВ результате p- сопряжения ослабляется связь N-H и может происход ить лактим-лактамная таутомерия. В лактимной форме пептидная связь малоактивна.
44 лактамная форма лактимная форма. C C OH N CC C NH CЭлектронное строение и пространственная конфигурация пептидной связи ОВ результате p- сопряжения ослабляется связь N-H и может происход ить лактим-лактамная таутомерия. В лактимной форме пептидная связь малоактивна.
 45 Фишер (Fischer) Эмиль (9. 10. 1852– 15. 7. 1919), немецкий химик-органик и биохимик. Иностранный член-корреспондент Петербургской АН (1899). Нобелевская премия (1902). Данилевский Александр Яковлевич [10(22). 12. 1838, Харьков, — 18. 7. 1923, Петроград], русский биохимик, член-корреспондент Петербургской АН (1898). Предложил теорию строения белковой молекулы, «теорию элементарных рядов» . Наличие пептидной с вязи в белках и пептидах было предположено А. Я. Данилевским и Э. Фишером и затем подтверждено химическими и физическими данными
45 Фишер (Fischer) Эмиль (9. 10. 1852– 15. 7. 1919), немецкий химик-органик и биохимик. Иностранный член-корреспондент Петербургской АН (1899). Нобелевская премия (1902). Данилевский Александр Яковлевич [10(22). 12. 1838, Харьков, — 18. 7. 1923, Петроград], русский биохимик, член-корреспондент Петербургской АН (1898). Предложил теорию строения белковой молекулы, «теорию элементарных рядов» . Наличие пептидной с вязи в белках и пептидах было предположено А. Я. Данилевским и Э. Фишером и затем подтверждено химическими и физическими данными
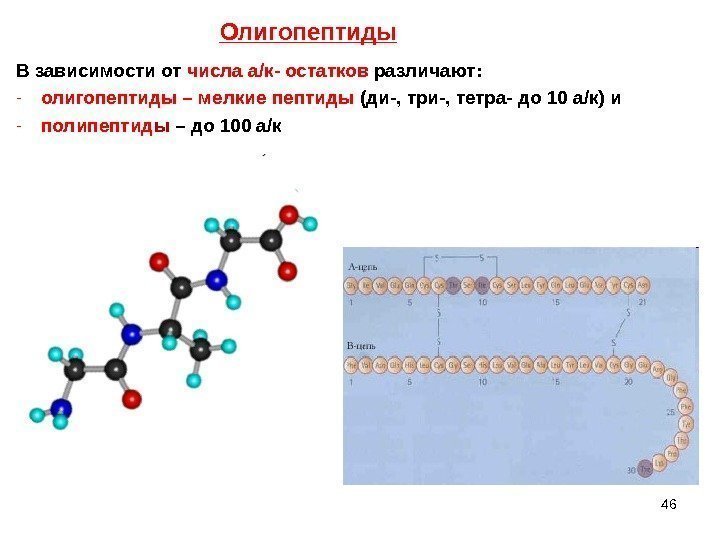
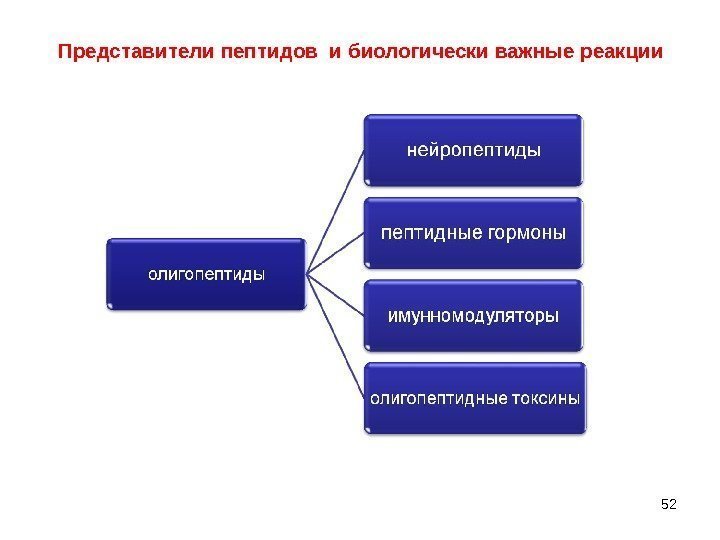
 46 В зависимости от числа а/к- остатков различают: — олигопептиды – мелкие пептиды (ди-, три-, тетра- до 10 а/к) и — полипептид ы – до 100 а/к Олигопептиды
46 В зависимости от числа а/к- остатков различают: — олигопептиды – мелкие пептиды (ди-, три-, тетра- до 10 а/к) и — полипептид ы – до 100 а/к Олигопептиды
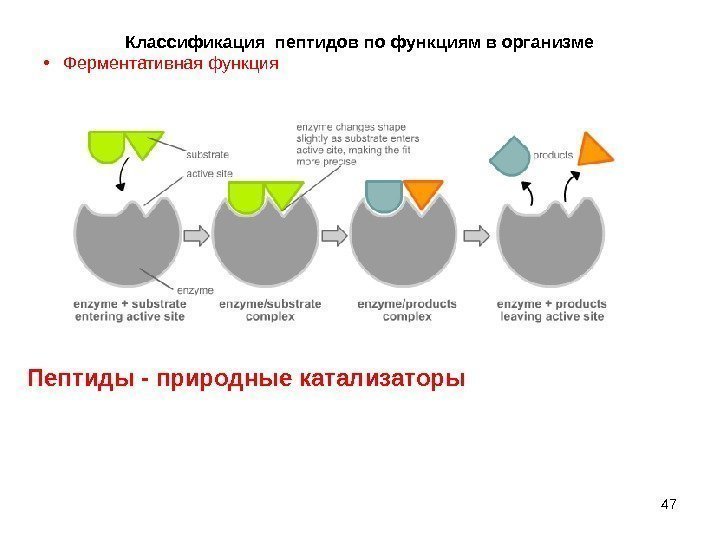
 47 Классификация пептидов по функциям в организме • Ферментативнаяфункция Пептиды — природные катализаторы
47 Классификация пептидов по функциям в организме • Ферментативнаяфункция Пептиды — природные катализаторы
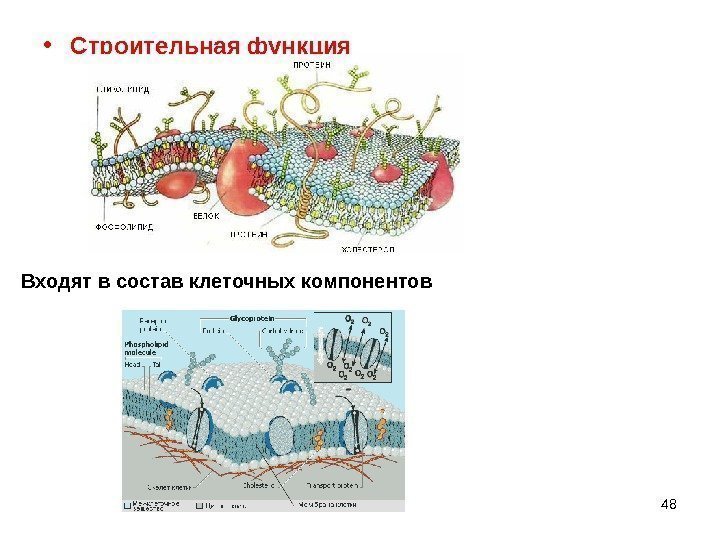
 48 • Строительная функция Входят в состав клеточных компонентов
48 • Строительная функция Входят в состав клеточных компонентов
 49 • Энергетическая функция 1 грамм пептида = 17, 6 к. Дж энергии • Двигательная функция 3 белковыесистемы: – Флагелин – Актин-миозин – Тубулин–динеин
49 • Энергетическая функция 1 грамм пептида = 17, 6 к. Дж энергии • Двигательная функция 3 белковыесистемы: – Флагелин – Актин-миозин – Тубулин–динеин
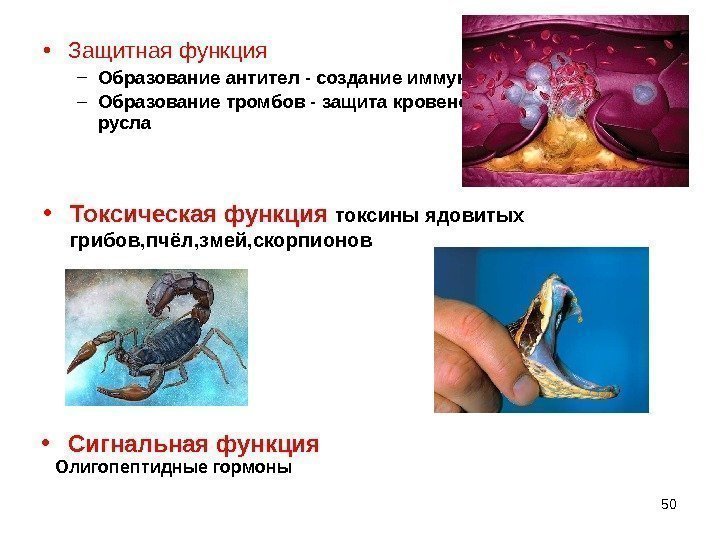
 50 • Защитнаяфункция – Образование антител — создание иммунитета – Образование тромбов — защита кровеносного русла • Токсическая функция токсины ядовитых грибов, пчёл, змей, скорпионов • Сигнальная функция Олигопептидные гормоны
50 • Защитнаяфункция – Образование антител — создание иммунитета – Образование тромбов — защита кровеносного русла • Токсическая функция токсины ядовитых грибов, пчёл, змей, скорпионов • Сигнальная функция Олигопептидные гормоны
 51 • Транспортная функция • Антибиотическая функция Олигопептидные антибиотики синтезируются бактериями и низшими грибами • Рецепторная фунция Взаимодействие с окружающей средой
51 • Транспортная функция • Антибиотическая функция Олигопептидные антибиотики синтезируются бактериями и низшими грибами • Рецепторная фунция Взаимодействие с окружающей средой
 52 Представители пептидов и биологически важные реакции
52 Представители пептидов и биологически важные реакции
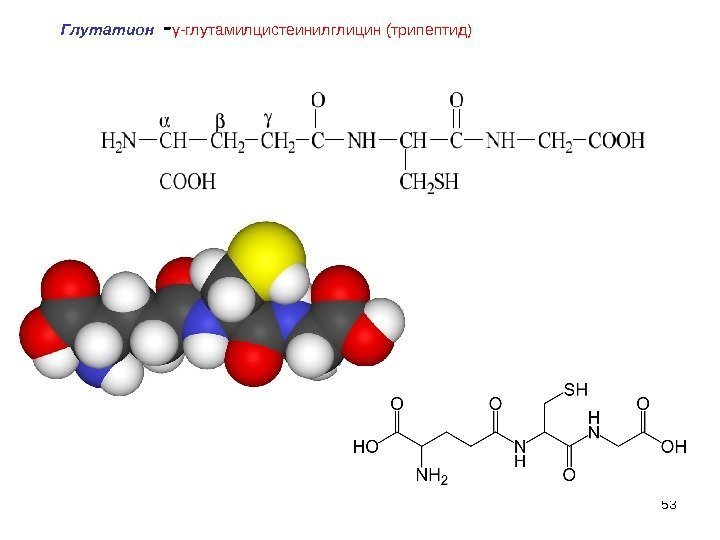
 53 Глутатион — γ-глутамилцистеинилглицин(трипептид)
53 Глутатион — γ-глутамилцистеинилглицин(трипептид)
 54 Эритроциты в норме Клетки в отсутствии глутатиона. Защищает гемоглобин и его белки, мембрану эритроцитов от окислителей. Глутатион — γ-глутамилцистеинилглицин
54 Эритроциты в норме Клетки в отсутствии глутатиона. Защищает гемоглобин и его белки, мембрану эритроцитов от окислителей. Глутатион — γ-глутамилцистеинилглицин
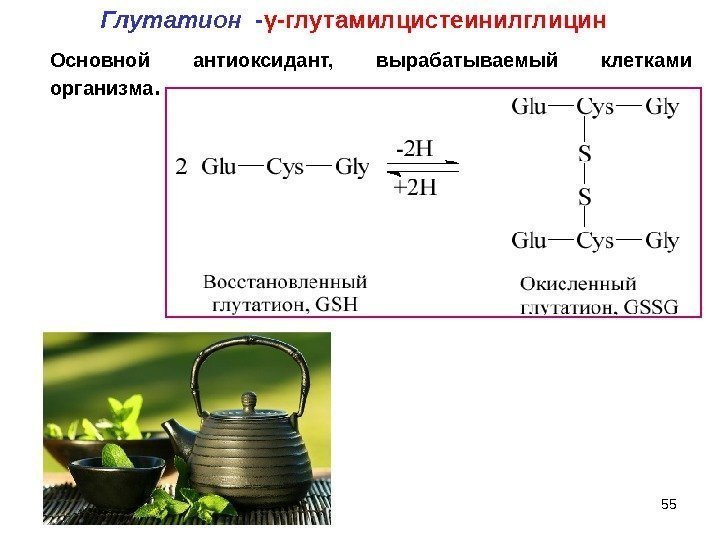
 55 Основной антиоксидант, вырабатываемый клетками организма. Глутатион — γ-глутамилцистеинилглицин
55 Основной антиоксидант, вырабатываемый клетками организма. Глутатион — γ-глутамилцистеинилглицин
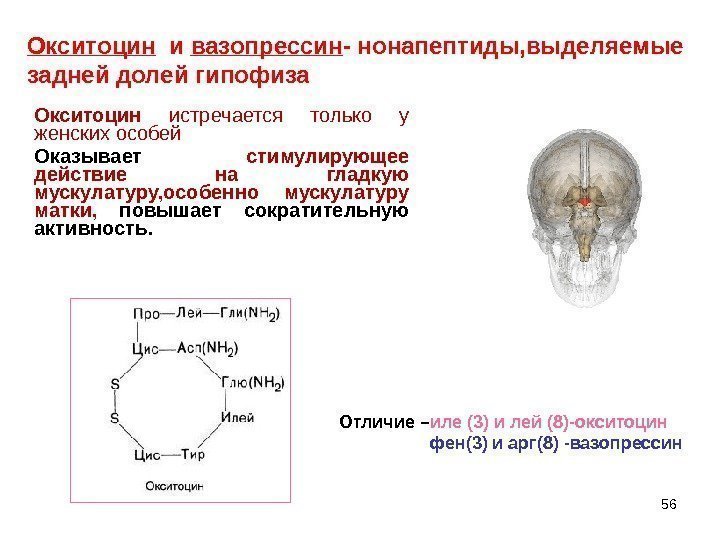
 56 Окситоцин истречается только у женскихособей Оказывает стимулирующее действие на гладкую мускулатуру, особенно мускулатуру матки, повышает сократительную активность. Окситоцин и вазопрессин — нонапептиды, выделяемые задней долей гипофиза Отличие – иле (3) и лей (8)-окситоцин фен(3) и арг(8) -вазопрессин
56 Окситоцин истречается только у женскихособей Оказывает стимулирующее действие на гладкую мускулатуру, особенно мускулатуру матки, повышает сократительную активность. Окситоцин и вазопрессин — нонапептиды, выделяемые задней долей гипофиза Отличие – иле (3) и лей (8)-окситоцин фен(3) и арг(8) -вазопрессин
 57 Гормон доверчивости. Участвует сразу же после родов вформированииотношения мать-ребенок. Окситоцин
57 Гормон доверчивости. Участвует сразу же после родов вформированииотношения мать-ребенок. Окситоцин
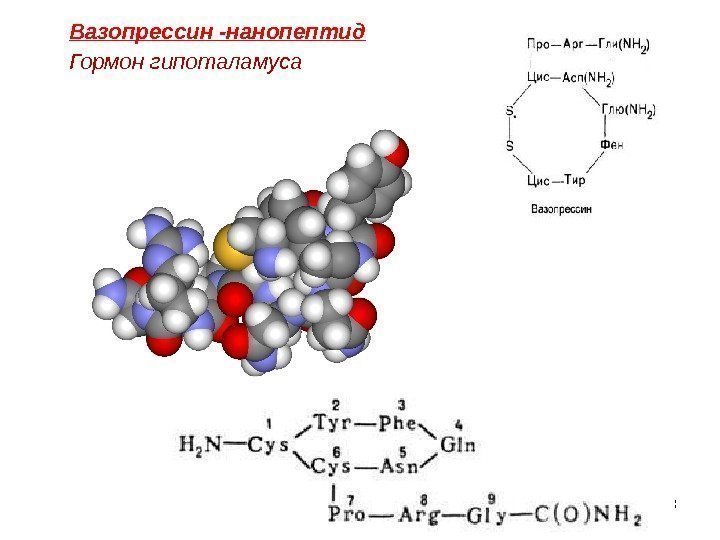
 58 Вазопрессин -нанопептид Гормон гипоталамуса
58 Вазопрессин -нанопептид Гормон гипоталамуса
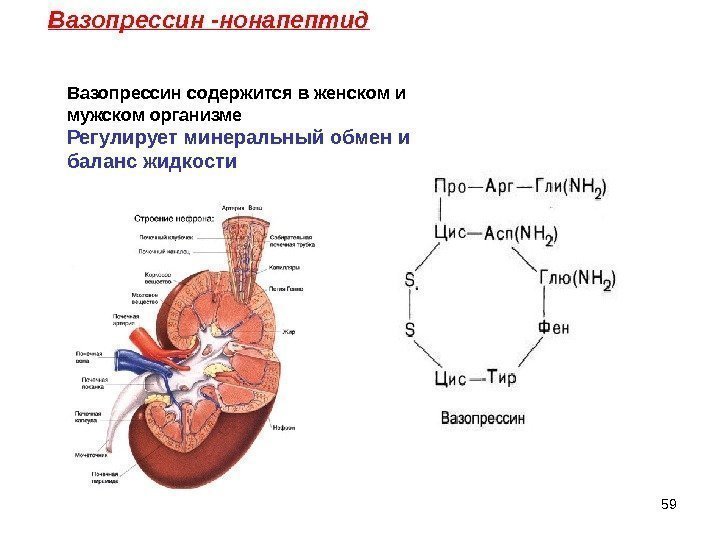
 59 Вазопрессин -нонапептид Вазопрессин содержится в женском и мужском организме Регулирует минеральный обмен и баланс жидкости
59 Вазопрессин -нонапептид Вазопрессин содержится в женском и мужском организме Регулирует минеральный обмен и баланс жидкости
 60 Таблетки верности Вазопрессин управляет родительским поведением, а также узнаванием «своих» и формированием привязанности, нежности и ласки. Мощный стимулятор запоминания Вазопрессин
60 Таблетки верности Вазопрессин управляет родительским поведением, а также узнаванием «своих» и формированием привязанности, нежности и ласки. Мощный стимулятор запоминания Вазопрессин
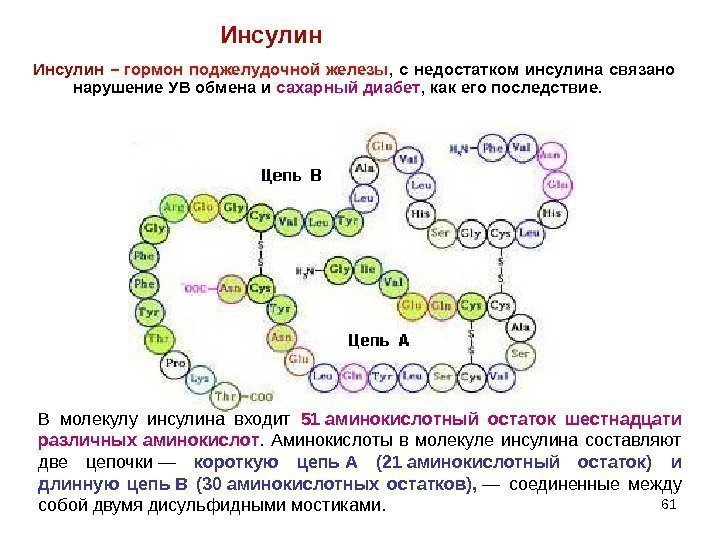
 61 Инсулин – гормон поджелудочной железы , с недостатком инсулина связано нарушение УВ обмена и сахарный диабет , как его последствие. Инсулин В молекулу инсулина входит 51 аминокислотный остаток шестнадцати различных аминокислот. Аминокислоты в молекуле инсулина составляют две цепочки— короткую цепь А (21 аминокислотный остаток) и длинную цепь В (30 аминокислотных остатков), — соединенные между собойдвумядисульфиднымимостиками.
61 Инсулин – гормон поджелудочной железы , с недостатком инсулина связано нарушение УВ обмена и сахарный диабет , как его последствие. Инсулин В молекулу инсулина входит 51 аминокислотный остаток шестнадцати различных аминокислот. Аминокислоты в молекуле инсулина составляют две цепочки— короткую цепь А (21 аминокислотный остаток) и длинную цепь В (30 аминокислотных остатков), — соединенные между собойдвумядисульфиднымимостиками.
 62 Расшифровка первичной структуры пептидов – мощный стимул для развития работ по их синтезу. Впервые бычий инсулин был расшифрован Фредериком С егером , за что в 1958 году ему была вручена Нобелевская премия В 1980 году- 2 -ая Нобелевская премия за разработку методов расшифровки нуклеиновых кислот ). Инсулин Синсулинаначаласьноваяэпохавбиотехнологии
62 Расшифровка первичной структуры пептидов – мощный стимул для развития работ по их синтезу. Впервые бычий инсулин был расшифрован Фредериком С егером , за что в 1958 году ему была вручена Нобелевская премия В 1980 году- 2 -ая Нобелевская премия за разработку методов расшифровки нуклеиновых кислот ). Инсулин Синсулинаначаласьноваяэпохавбиотехнологии
 63 Нейропептиды — природные олигопептиды, образующиеся в центральной или периферической нервной системе и регулирующие физиологические функции организма человека и животных. Нейропептиды
63 Нейропептиды — природные олигопептиды, образующиеся в центральной или периферической нервной системе и регулирующие физиологические функции организма человека и животных. Нейропептиды
 64 Пептиды служат важным «средством общения» между собой нервных клеток наряду с давно известными медиаторами – дофамином, норадреналином, ацетилхолином.
64 Пептиды служат важным «средством общения» между собой нервных клеток наряду с давно известными медиаторами – дофамином, норадреналином, ацетилхолином.
 65 Нейропептиды: • влияютнапроцессы обученияи запоминания • регулируютсон • обладаюто безболивающей функцией • ответственнызачувствоголода, страхаит. д.
65 Нейропептиды: • влияютнапроцессы обученияи запоминания • регулируютсон • обладаюто безболивающей функцией • ответственнызачувствоголода, страхаит. д.
 66 Многие пептиды работают в системе удовольствия , моделируя поведение нервных импульсов по тем нервным путям, которые создают чувство радости, веселья, обезболивания.
66 Многие пептиды работают в системе удовольствия , моделируя поведение нервных импульсов по тем нервным путям, которые создают чувство радости, веселья, обезболивания.
 67 К таким пептидам относятся опиоидные нейропептиды – энкефалины и эндорфины. Они образуются в мозге и оказывают на ЦНС действие, сходное с дейстивием морфина. Однако, к ним не возникает наркотического привыкания, о чем свидетельствует их физиологически управляемый синтез. Опиоидные пептиды
67 К таким пептидам относятся опиоидные нейропептиды – энкефалины и эндорфины. Они образуются в мозге и оказывают на ЦНС действие, сходное с дейстивием морфина. Однако, к ним не возникает наркотического привыкания, о чем свидетельствует их физиологически управляемый синтез. Опиоидные пептиды
 68 COOHLeu. Phe. Gly. Tyr. NH 2 COOHMet. Phe. Gly. Tyr. NH 2 Опиоидные пептиды — группа природных и синтетических пептидов, сходных с опиатами ( морфин, кодеин и др. ) по способности связываться с опиатными рецепторами организма. Энкефалины: лейцин- энкефалин Метионин-энкефалин
68 COOHLeu. Phe. Gly. Tyr. NH 2 COOHMet. Phe. Gly. Tyr. NH 2 Опиоидные пептиды — группа природных и синтетических пептидов, сходных с опиатами ( морфин, кодеин и др. ) по способности связываться с опиатными рецепторами организма. Энкефалины: лейцин- энкефалин Метионин-энкефалин
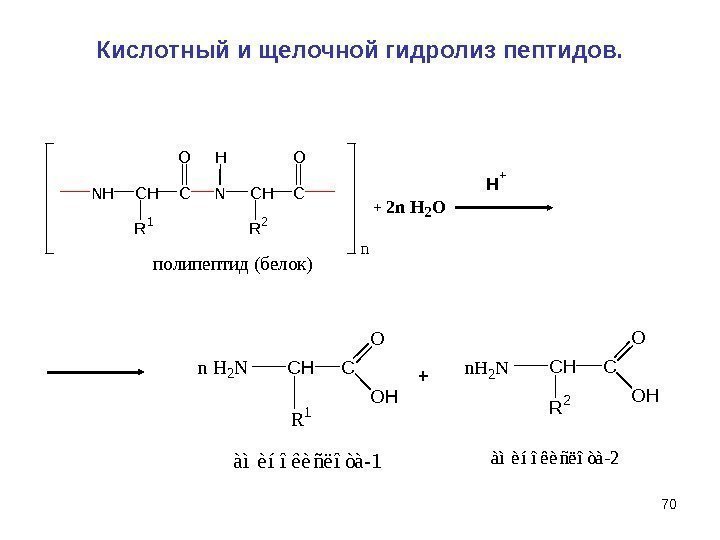
 69 Кислотный и щелочной гидролиз пептидов. Важное свойство пептидов — способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Гидролиз пептидов может происходить в кислой или щелочной среде , а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно , т. е. позволяет расщеплять строго определенные участки пептидной цепи.
69 Кислотный и щелочной гидролиз пептидов. Важное свойство пептидов — способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Гидролиз пептидов может происходить в кислой или щелочной среде , а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно , т. е. позволяет расщеплять строго определенные участки пептидной цепи.
 70 Кислотный и щелочной гидролиз пептидов. N H C R 1 O N H C H R 2 CO n полипептид (белок) n H 2 N C H C O O H à ì è í î ê è ñ ë î ò à — 1 R 1 n H 2 N C H C R 2 O O H à ì è í î ê è ñ ë î ò à — 2 +2 n H 2 OH + +
70 Кислотный и щелочной гидролиз пептидов. N H C R 1 O N H C H R 2 CO n полипептид (белок) n H 2 N C H C O O H à ì è í î ê è ñ ë î ò à — 1 R 1 n H 2 N C H C R 2 O O H à ì è í î ê è ñ ë î ò à — 2 +2 n H 2 OH + +
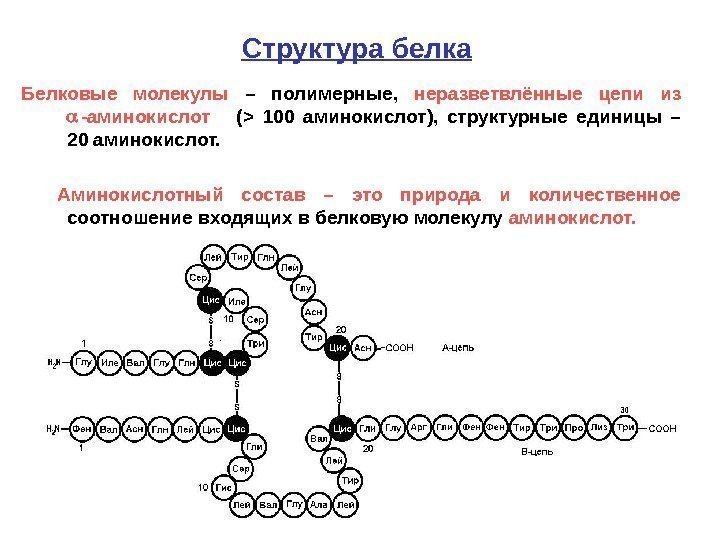
 71 Структура белка Белковые молекулы – полимерные, неразветвлённые цепи из -аминокислот ( > 100 аминокислот), структурные единицы – 20 аминокислот. Аминокислотный состав – это природа и количественное соотношение входящих в белковую молекулу аминокислот.
71 Структура белка Белковые молекулы – полимерные, неразветвлённые цепи из -аминокислот ( > 100 аминокислот), структурные единицы – 20 аминокислот. Аминокислотный состав – это природа и количественное соотношение входящих в белковую молекулу аминокислот.
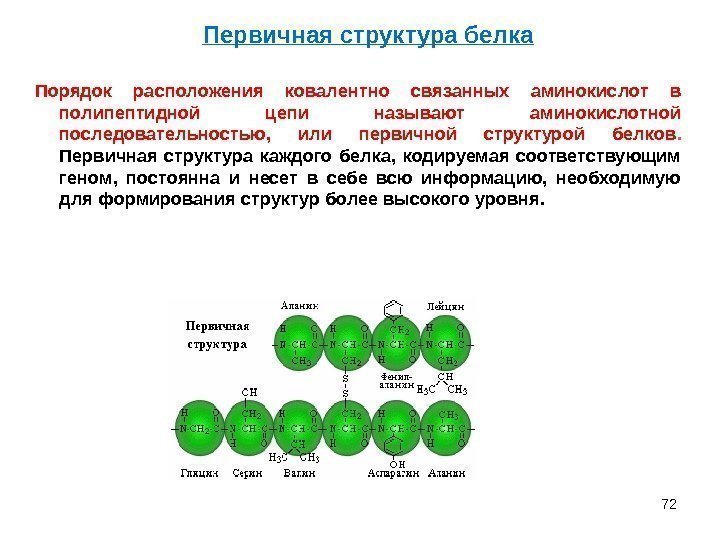
 72 Порядок расположения ковалентно связанных аминокислот в полипептидной цепи называют аминокислотной последовательностью, или первичной структурой белков. Первичная структура каждого белка, кодируемая соответствующим геном, постоянна и несет в себе всю информацию, необходимую для формирования структур более высокого уровня. Первичная структура белка
72 Порядок расположения ковалентно связанных аминокислот в полипептидной цепи называют аминокислотной последовательностью, или первичной структурой белков. Первичная структура каждого белка, кодируемая соответствующим геном, постоянна и несет в себе всю информацию, необходимую для формирования структур более высокого уровня. Первичная структура белка
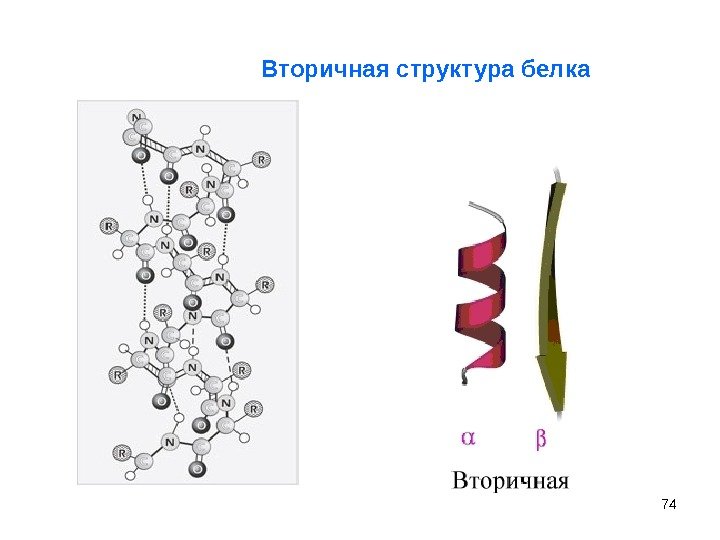
 73 Вторичная структура фиксируется водородными связями между пептидными группами. II Вторичная структура — укладка первичной структуры белка , возможны два вида конформации: Наиболее выгодная — -спираль (правозакрученная): цилиндр обвивает полипептидная цепь (степень спирализации от 5 до 80 %). Вторая структура – складчатый слой ( -структура ): полипептидные цепи лежат антипараллельно или параллельно другу (водородные связи соединяют 2 различные цепи). Вторичная структура
73 Вторичная структура фиксируется водородными связями между пептидными группами. II Вторичная структура — укладка первичной структуры белка , возможны два вида конформации: Наиболее выгодная — -спираль (правозакрученная): цилиндр обвивает полипептидная цепь (степень спирализации от 5 до 80 %). Вторая структура – складчатый слой ( -структура ): полипептидные цепи лежат антипараллельно или параллельно другу (водородные связи соединяют 2 различные цепи). Вторичная структура
 74 Вторичная структура белка
74 Вторичная структура белка
 75 Третичная структура – укладка вторичных структур одной полипептидной цепи в глобулу. В формировании третичной структуры, кроме водородных связей, большую роль играет ионное и гидрофобное взаимодействие. Основные виды взаимодействия : — Взаимодействие боковых радикалов , которые при изгибе цепи сближаются — Водородные связи — Дисульфидные ковалентные связи и другие. Третичная структура белка
75 Третичная структура – укладка вторичных структур одной полипептидной цепи в глобулу. В формировании третичной структуры, кроме водородных связей, большую роль играет ионное и гидрофобное взаимодействие. Основные виды взаимодействия : — Взаимодействие боковых радикалов , которые при изгибе цепи сближаются — Водородные связи — Дисульфидные ковалентные связи и другие. Третичная структура белка
 76 Третичная структура белка
76 Третичная структура белка
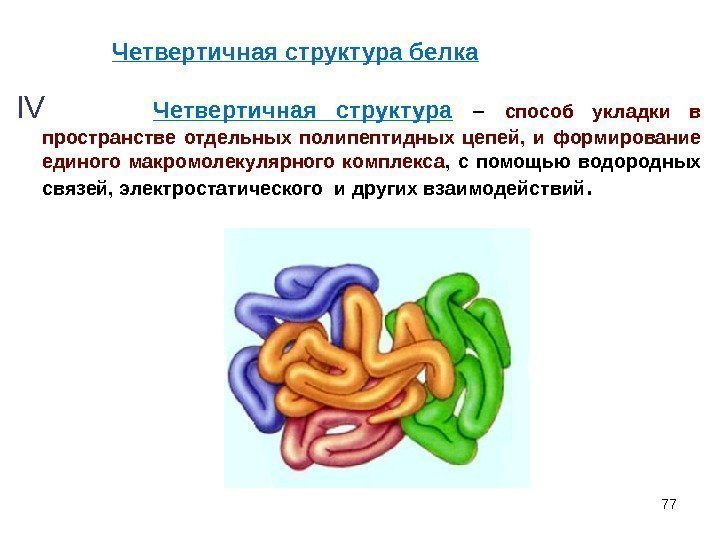
 77 IV Четвертичная структура – способ укладки в пространстве отдельных полипептидных цепей, и формирование единого макромолекулярного комплекса , с помощью водородных связей, электростатического и других взаимодействий. Четвертичная структура белка
77 IV Четвертичная структура – способ укладки в пространстве отдельных полипептидных цепей, и формирование единого макромолекулярного комплекса , с помощью водородных связей, электростатического и других взаимодействий. Четвертичная структура белка
 781. Гликопротеины. 2. Липопротеины. 3. Нуклеопротеины. 4. Фосфопротеины. 5. Металлопротеины. Классификация сложных белков
781. Гликопротеины. 2. Липопротеины. 3. Нуклеопротеины. 4. Фосфопротеины. 5. Металлопротеины. Классификация сложных белков
 79 Спасибо за внимание!
79 Спасибо за внимание!
