1 Алкены Алкенами называются ненасыщенные углеводороды, молекулы















- Размер: 3.1 Mегабайта
- Количество слайдов: 60
Описание презентации 1 Алкены Алкенами называются ненасыщенные углеводороды, молекулы по слайдам
 1 Алкены Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. С n Н 2 n олефины
1 Алкены Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. С n Н 2 n олефины
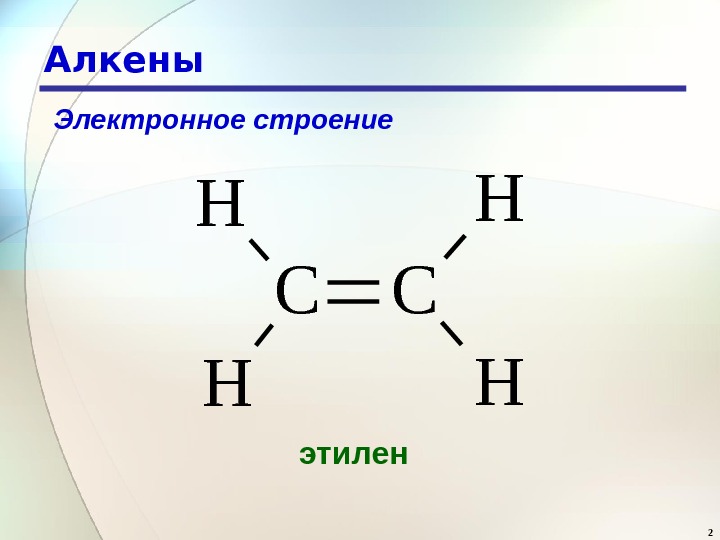
 2 Алкены. CC H H этилен. Электронное строение
2 Алкены. CC H H этилен. Электронное строение
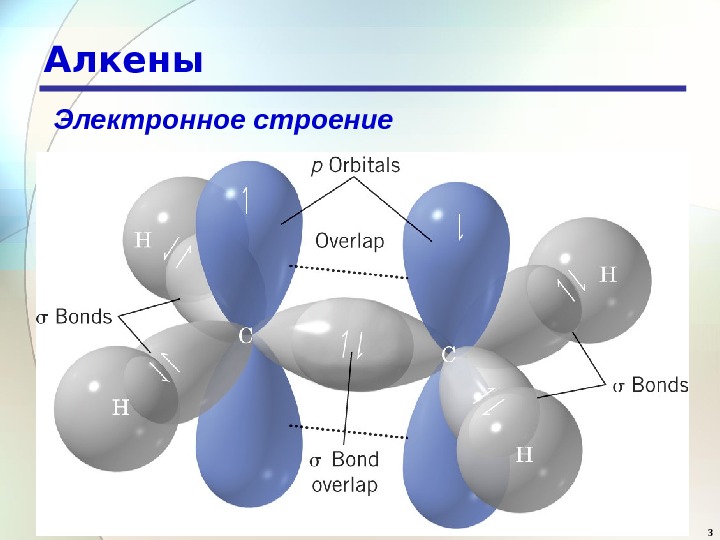
 3 Алкены Электронное строение
3 Алкены Электронное строение
 4 Алкены Изомерия Пространственная изомерия Цис- и транс-изомеры бутена-
4 Алкены Изомерия Пространственная изомерия Цис- и транс-изомеры бутена-
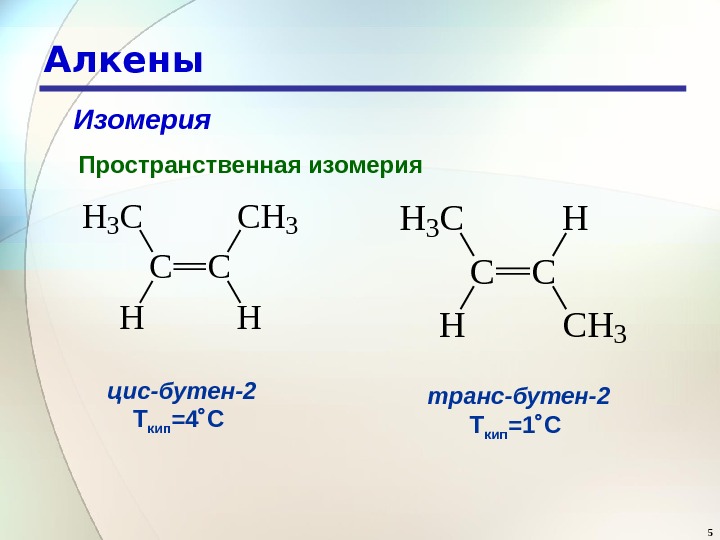
 5 Алкены Изомерия Пространственная изомерия CC H 3 CCH 3 HH C CH 3 C C H 3 H H цис-бутен-2 Т кип =4 С транс-бутен-2 Т кип =1 С
5 Алкены Изомерия Пространственная изомерия CC H 3 CCH 3 HH C CH 3 C C H 3 H H цис-бутен-2 Т кип =4 С транс-бутен-2 Т кип =1 С
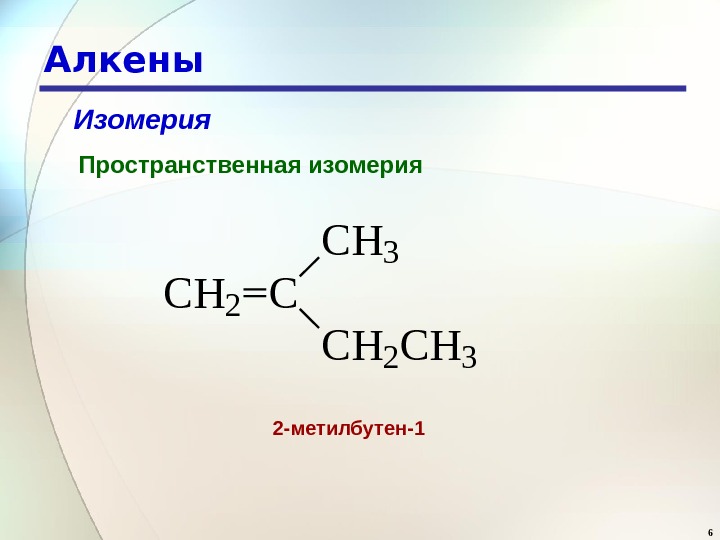
 6 Алкены Изомерия Пространственная изомерия C H 2 C C H 3 C H 2 C H 3 2 -метилбутен-
6 Алкены Изомерия Пространственная изомерия C H 2 C C H 3 C H 2 C H 3 2 -метилбутен-
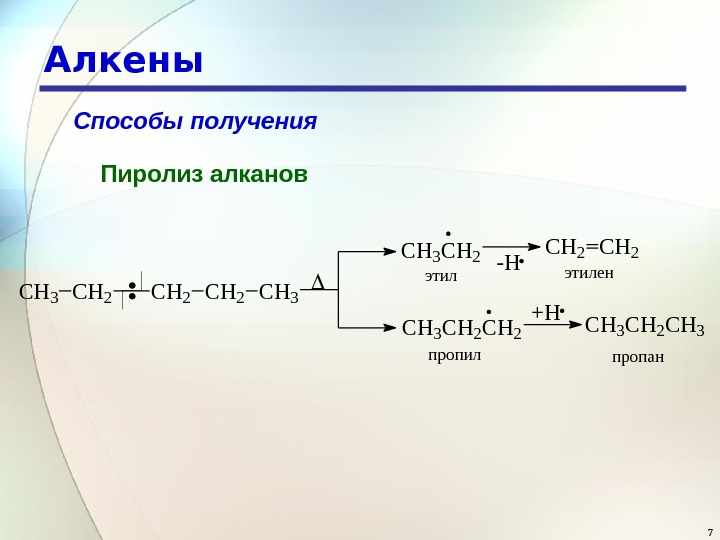
 7 Алкены Способы получения Пиролиз алканов CH 3 CH 2 CH 2 CH 3 CH 2 -H CH 2 этиленэтил CH 3 CH 2 +H CH 3 CH 2 CH 3 пропанпропил
7 Алкены Способы получения Пиролиз алканов CH 3 CH 2 CH 2 CH 3 CH 2 -H CH 2 этиленэтил CH 3 CH 2 +H CH 3 CH 2 CH 3 пропанпропил
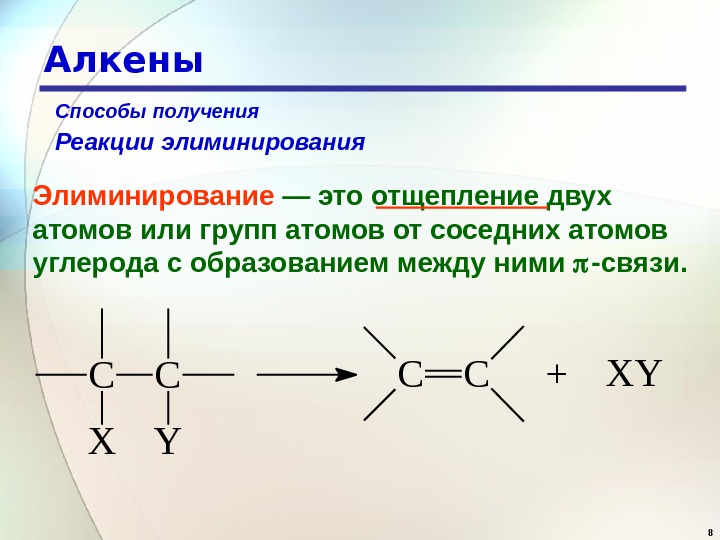
 8 Алкены Реакции элиминирования Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи. C C X Y C C + X YСпособы получения
8 Алкены Реакции элиминирования Элиминирование — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи. C C X Y C C + X YСпособы получения
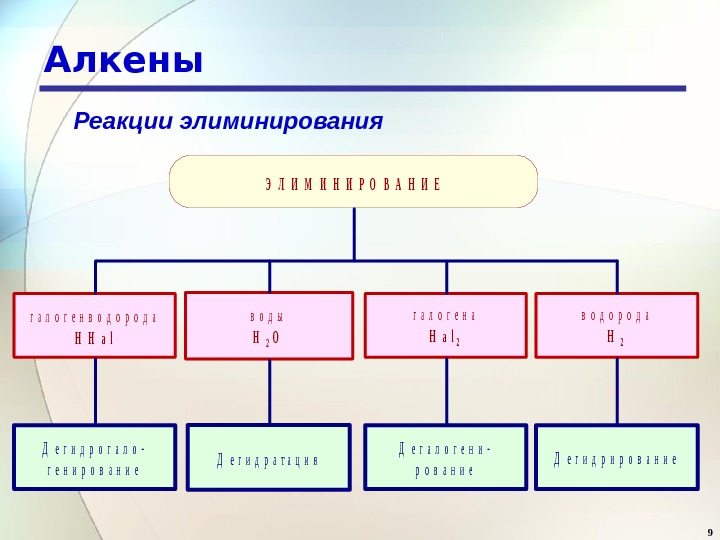
 9 Алкены Реакции элиминированияг а л о г е н в о д о р о д а H H a l в о д ы H 2 O г а л о г е н а H a l 2 в о д о р о д а H 2 Д е г и д р о г а л о — г е н и р о в а н и е Д е г и д р а т а ц и я Д е г а л о г е н и — р о в а н и е Д е г и д р и р о в а н и е Э Л И М И Н И Р О В А Н И Е
9 Алкены Реакции элиминированияг а л о г е н в о д о р о д а H H a l в о д ы H 2 O г а л о г е н а H a l 2 в о д о р о д а H 2 Д е г и д р о г а л о — г е н и р о в а н и е Д е г и д р а т а ц и я Д е г а л о г е н и — р о в а н и е Д е г и д р и р о в а н и е Э Л И М И Н И Р О В А Н И Е
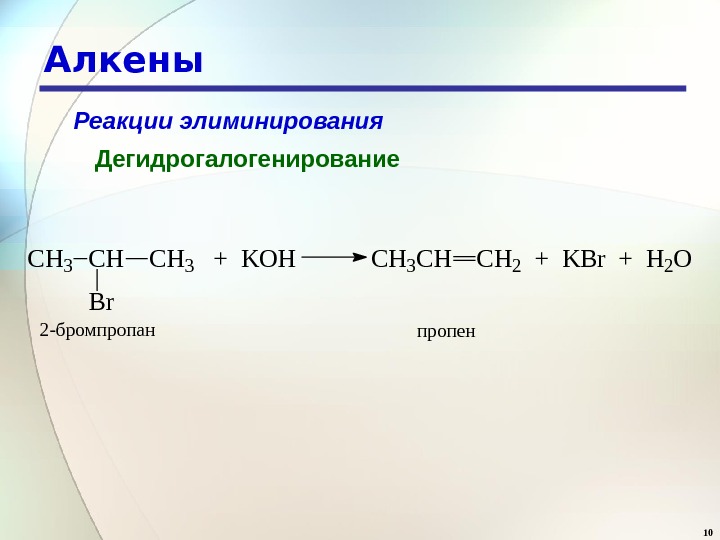
 10 Алкены Реакции элиминирования Дегидрогалогенирование CH 3 CHCH 3 + KOH Br CH 3 CHCH 2 + KBr + H 2 O 2 -бромпропанпропен
10 Алкены Реакции элиминирования Дегидрогалогенирование CH 3 CHCH 3 + KOH Br CH 3 CHCH 2 + KBr + H 2 O 2 -бромпропанпропен
 11 Алкены Реакции элиминирования Дегидрогалогенирование C H 3 C H C H 2 C H 3 + K O H C H 3 B r 3 -бром-2 -метилпентан C H 3 C H C H 2 C H 3 + K B r + H 2 O 2 -метилпентен-2 Правило Зайцева В случае несимметричных алкилгалогенидов отщепление атома водорода происходит от наименее гидрогенизированного атома углерода.
11 Алкены Реакции элиминирования Дегидрогалогенирование C H 3 C H C H 2 C H 3 + K O H C H 3 B r 3 -бром-2 -метилпентан C H 3 C H C H 2 C H 3 + K B r + H 2 O 2 -метилпентен-2 Правило Зайцева В случае несимметричных алкилгалогенидов отщепление атома водорода происходит от наименее гидрогенизированного атома углерода.
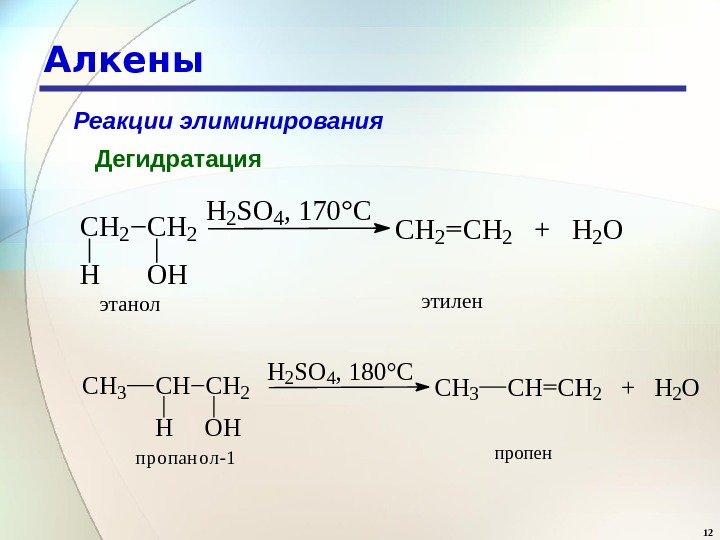
 12 Алкены Реакции элиминирования Дегидратация CH 2 OHH H 2 SO 4, 170°C CH 2 + H 2 O этанолэтилен C H 2 O HHC H 3 H 2 S O 4 , 180°C C H 2 + H 2 OC H 3 пропанол-1 пропен
12 Алкены Реакции элиминирования Дегидратация CH 2 OHH H 2 SO 4, 170°C CH 2 + H 2 O этанолэтилен C H 2 O HHC H 3 H 2 S O 4 , 180°C C H 2 + H 2 OC H 3 пропанол-1 пропен
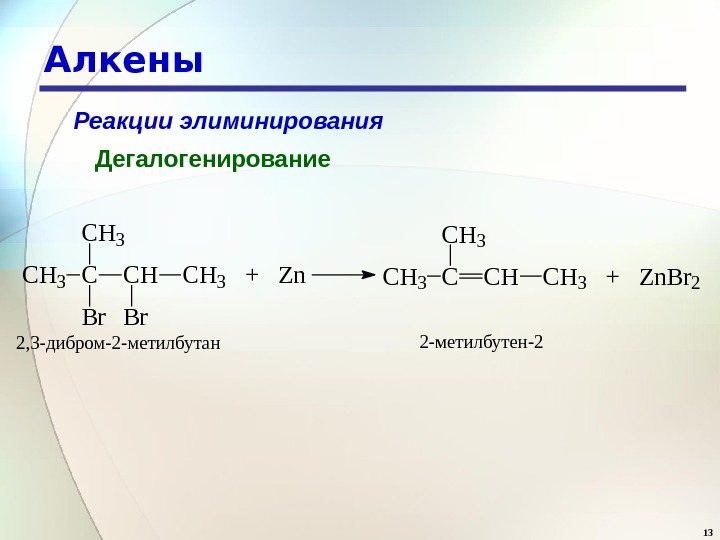
 13 Алкены Реакции элиминирования Дегалогенирование C H 3 C C H 3 + Z n. C H 3 B r C H 3 C C H 3 + Z n. B r 2 C H 3 2, 3 -дибром-2 -метилбутан 2 -метилбутен-
13 Алкены Реакции элиминирования Дегалогенирование C H 3 C C H 3 + Z n. C H 3 B r C H 3 C C H 3 + Z n. B r 2 C H 3 2, 3 -дибром-2 -метилбутан 2 -метилбутен-
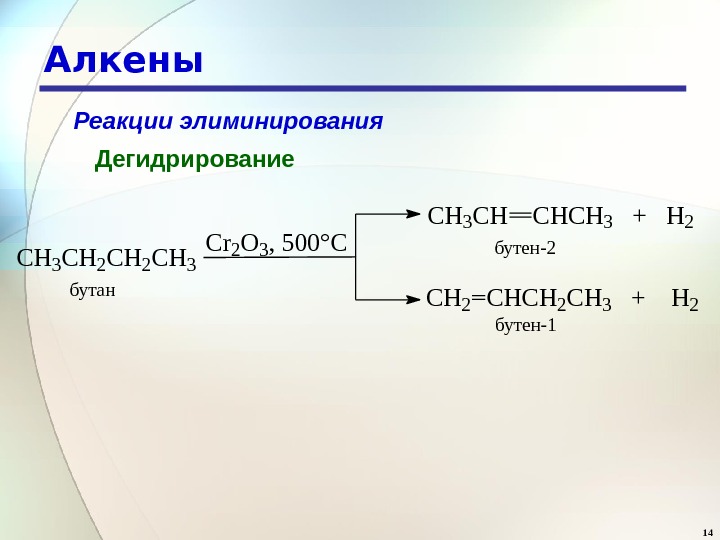
 14 Алкены Реакции элиминирования Дегидрирование. CH 3 CH 2 CH 3 Cr 2 O 3, 500°C CH 3 CHCHCH 3 + H 2 бутен-2 CH 2 CH 3 + H 2 бутен-1 бутан
14 Алкены Реакции элиминирования Дегидрирование. CH 3 CH 2 CH 3 Cr 2 O 3, 500°C CH 3 CHCHCH 3 + H 2 бутен-2 CH 2 CH 3 + H 2 бутен-1 бутан
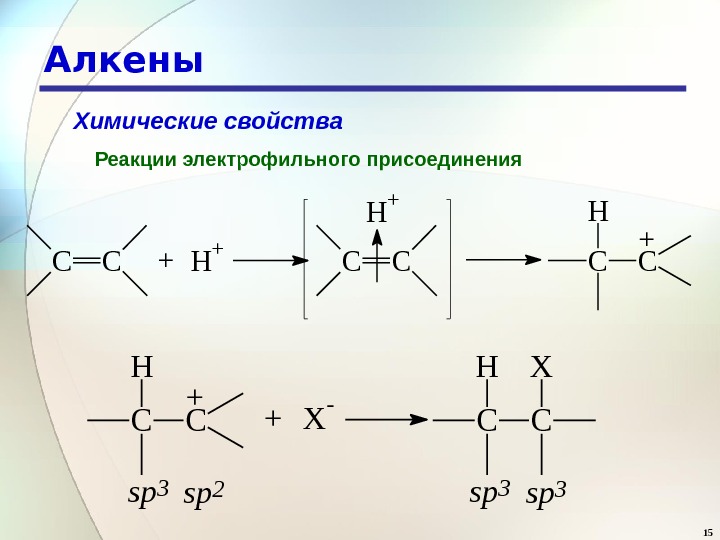
 15 Алкены Химические свойства Реакции электрофильного присоединения C C + H + C CH + + X- C CXH sp 3 sp
15 Алкены Химические свойства Реакции электрофильного присоединения C C + H + C CH + + X- C CXH sp 3 sp
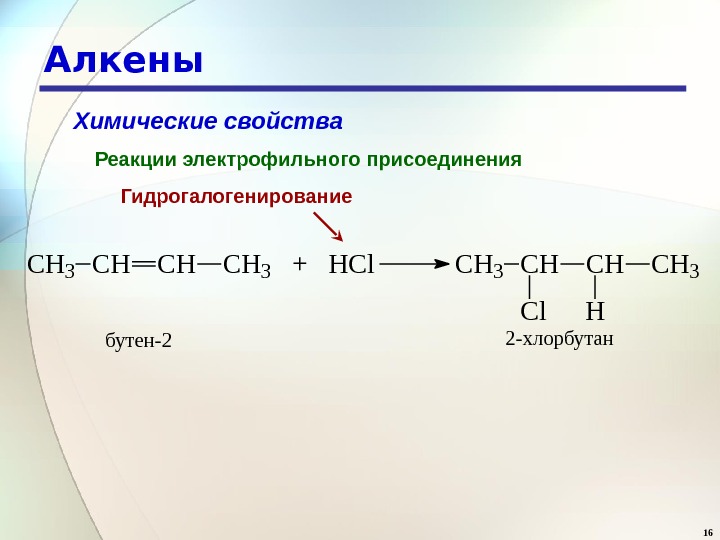
 16 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование. CH 3 CHCHCH 3 + HCl. CH 3 CHCHCH 3 Cl. H бутен-22 -хлорбутан
16 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование. CH 3 CHCHCH 3 + HCl. CH 3 CHCHCH 3 Cl. H бутен-22 -хлорбутан
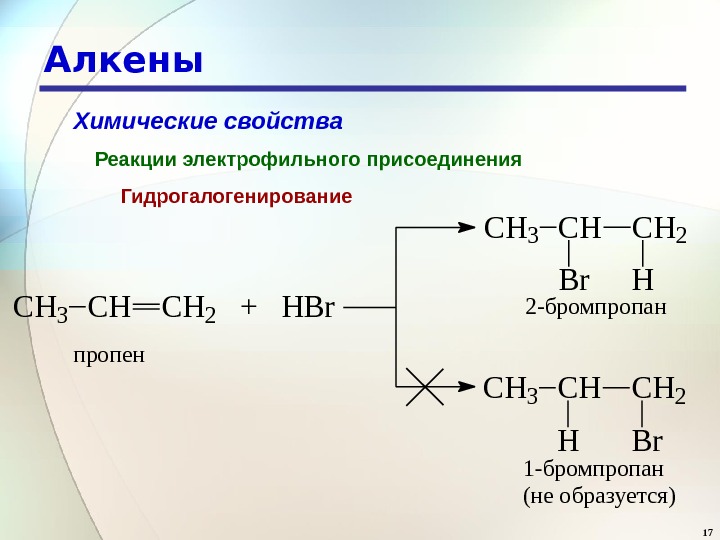
 17 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование C H 3 C H 2 + H B r C H 3 C H 2 B r H C H 3 C H 2 H B rпропен 2 -бромпропан 1 -бромпропан (не образуется)
17 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование C H 3 C H 2 + H B r C H 3 C H 2 B r H C H 3 C H 2 H B rпропен 2 -бромпропан 1 -бромпропан (не образуется)
 18 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование Правило Марковникова: присоединении молекул типа НХ к несимметричным алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
18 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование Правило Марковникова: присоединении молекул типа НХ к несимметричным алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
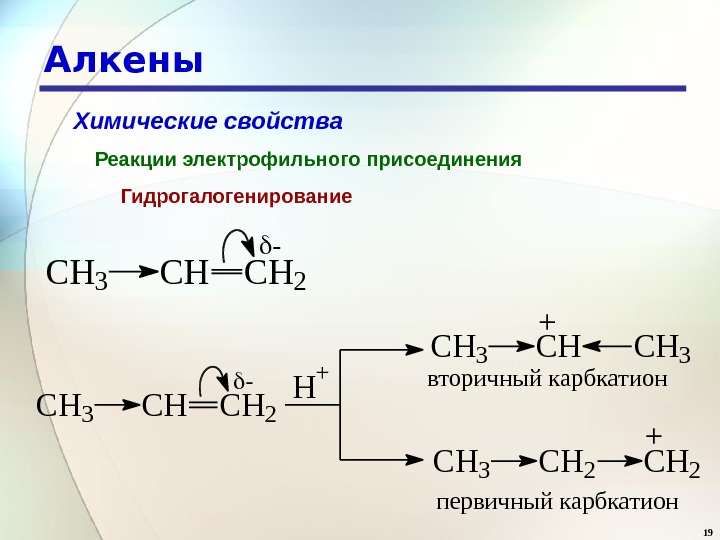
 19 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование. CH 3 CHCH 2 — H + CH 3 CHCH 3 + CH 3 CH 2 +вторичный карбкатион первичный карбкатион
19 Алкены Химические свойства Реакции электрофильного присоединения Гидрогалогенирование. CH 3 CHCH 2 — H + CH 3 CHCH 3 + CH 3 CH 2 +вторичный карбкатион первичный карбкатион
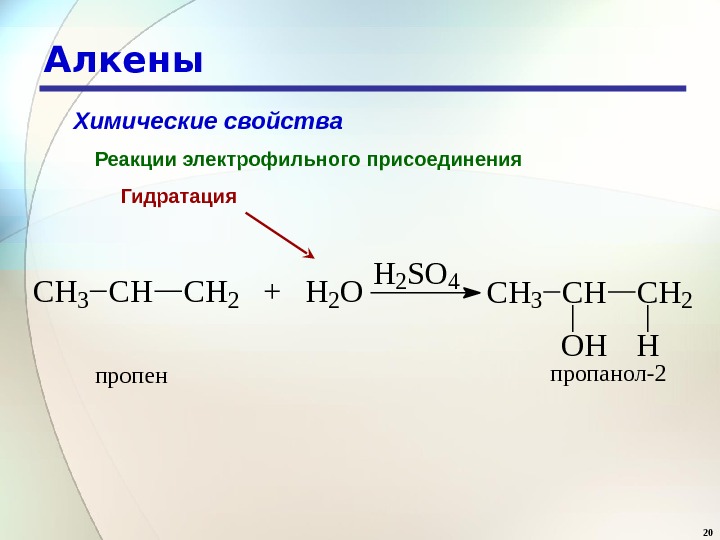
 20 Алкены Химические свойства Реакции электрофильного присоединения Гидратация. CH 3 CHCH 2 + H 2 O H 2 SO 4 CH 3 CHCH 2 OHH пропенпропанол-
20 Алкены Химические свойства Реакции электрофильного присоединения Гидратация. CH 3 CHCH 2 + H 2 O H 2 SO 4 CH 3 CHCH 2 OHH пропенпропанол-
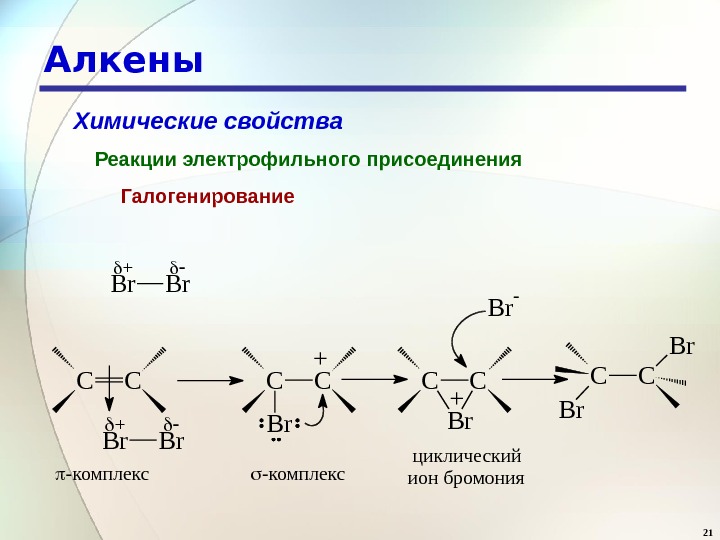
 21 Алкены Химические свойства Реакции электрофильного присоединения Галогенирование. Br + B r + C C -комплекс C C B r + +C C B r -комплекс циклический ион бромония B r — C C B r
21 Алкены Химические свойства Реакции электрофильного присоединения Галогенирование. Br + B r + C C -комплекс C C B r + +C C B r -комплекс циклический ион бромония B r — C C B r
 22 Алкены Химические свойства Окисление Горение C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O
22 Алкены Химические свойства Окисление Горение C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O
 23 Алкены Химические свойства Окисление по Вагнеру3 CH 2 + 2 KMn. O 4 + 4 H 2 O 3 CH 2 + 2 KOH + 2 Mn. O 2 OHOH этиленгликоль
23 Алкены Химические свойства Окисление по Вагнеру3 CH 2 + 2 KMn. O 4 + 4 H 2 O 3 CH 2 + 2 KOH + 2 Mn. O 2 OHOH этиленгликоль
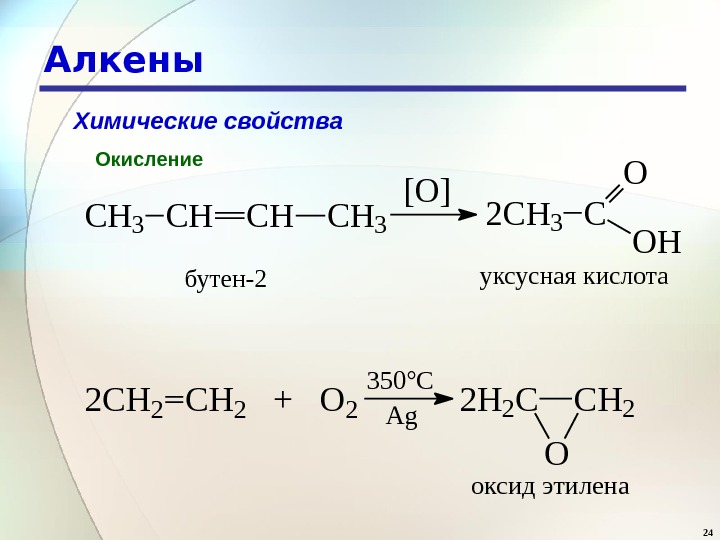
![24 Алкены Химические свойства Окисление C H 3 C H C H 3 [O] 2 C 24 Алкены Химические свойства Окисление C H 3 C H C H 3 [O] 2 C](/docs//alken-in_images/alken-in_23.jpg) 24 Алкены Химические свойства Окисление C H 3 C H C H 3 [O] 2 C H 3 C O O H бутен-2 уксусная кислота 2 C H 2 + O 2 350°C Ag 2 H 2 C C H 2 O оксид этилена
24 Алкены Химические свойства Окисление C H 3 C H C H 3 [O] 2 C H 3 C O O H бутен-2 уксусная кислота 2 C H 2 + O 2 350°C Ag 2 H 2 C C H 2 O оксид этилена
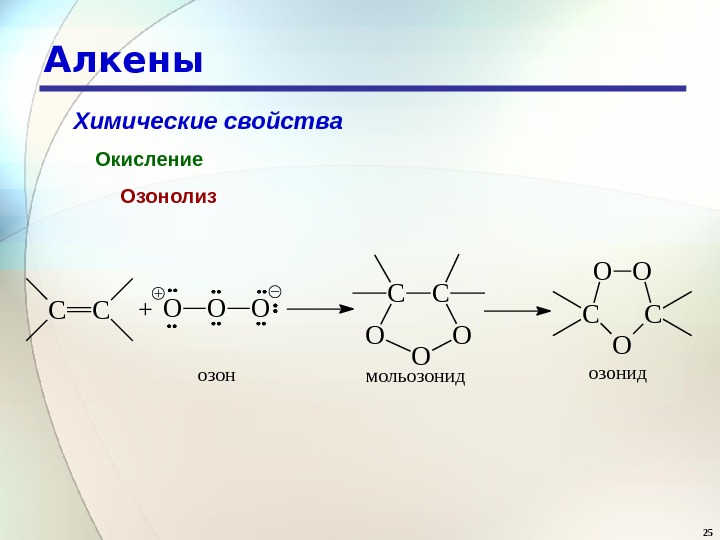
 25 Алкены Химические свойства Окисление Озонолиз. CC+OOO CC OO O мольозонидозон C OO озонид
25 Алкены Химические свойства Окисление Озонолиз. CC+OOO CC OO O мольозонидозон C OO озонид
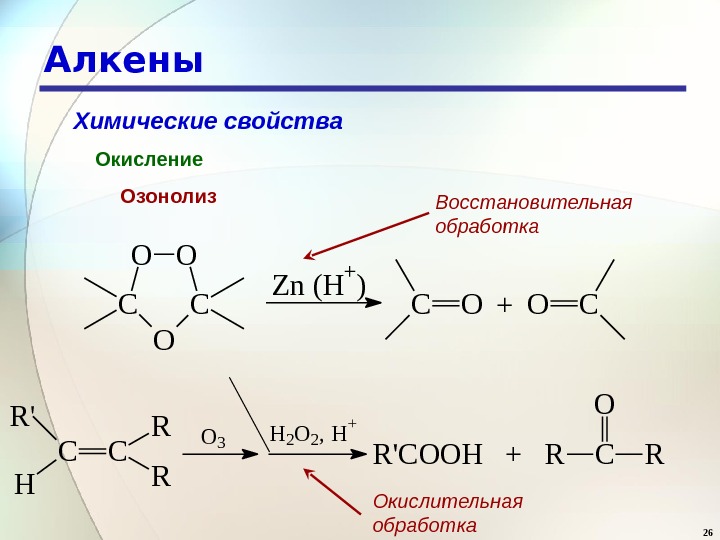
 26 Алкены Химические свойства Окисление Озонолиз C C R RR ‘ H O 3 H 2 O 2 , H + R ‘ C O O H + R CO RC O C OO Zn (H+) COCO+ Восстановительная обработка Окислительная обработка
26 Алкены Химические свойства Окисление Озонолиз C C R RR ‘ H O 3 H 2 O 2 , H + R ‘ C O O H + R CO RC O C OO Zn (H+) COCO+ Восстановительная обработка Окислительная обработка
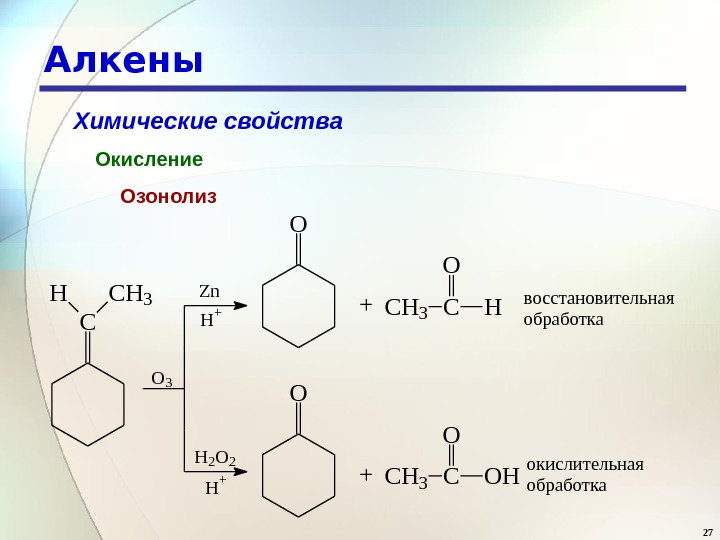
 27 Алкены Химические свойства Окисление Озонолиз. C HCH 3 O +CH 3 C O HZ n CH 3 C O OH+ OH + H +H 2 O 2 восстановительная обработка окислительная обработка
27 Алкены Химические свойства Окисление Озонолиз. C HCH 3 O +CH 3 C O HZ n CH 3 C O OH+ OH + H +H 2 O 2 восстановительная обработка окислительная обработка
 28 Алкены Химические свойства Восстановление (гидрирование)RCHCHR’ + H 2 Ni, 150 -300°C RCH 2 R’ алкен алкан
28 Алкены Химические свойства Восстановление (гидрирование)RCHCHR’ + H 2 Ni, 150 -300°C RCH 2 R’ алкен алкан
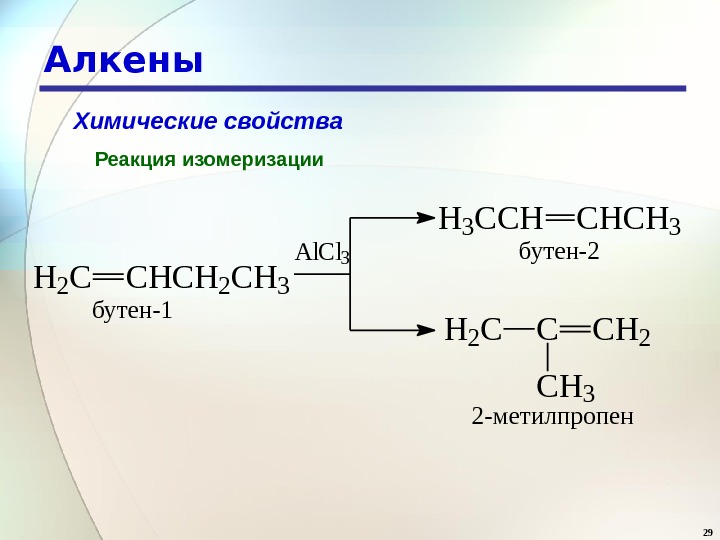
 29 Алкены Химические свойства Реакция изомеризации. H 2 CCHCH 2 CH 3 H 3 CCHCHCH 3 H 2 CCCH 2 CH 3 бутен-1 бутен-2 2 -метилпропен Al. Cl
29 Алкены Химические свойства Реакция изомеризации. H 2 CCHCH 2 CH 3 H 3 CCHCHCH 3 H 2 CCCH 2 CH 3 бутен-1 бутен-2 2 -метилпропен Al. Cl
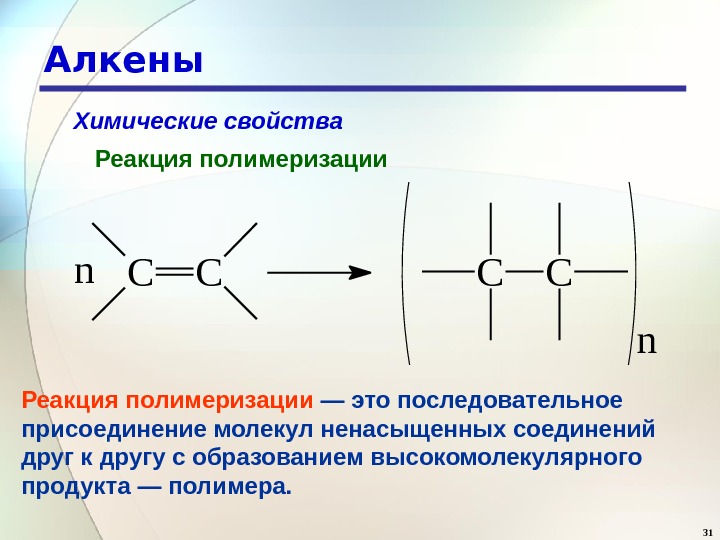
 30 Алкены Химические свойства Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного продукта — полимера.
30 Алкены Химические свойства Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного продукта — полимера.
 31 Алкены Химические свойства Реакция полимеризации. CCCCn n Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного продукта — полимера.
31 Алкены Химические свойства Реакция полимеризации. CCCCn n Реакция полимеризации — это последовательное присоединение молекул ненасыщенных соединений друг к другу с образованием высокомолекулярного продукта — полимера.
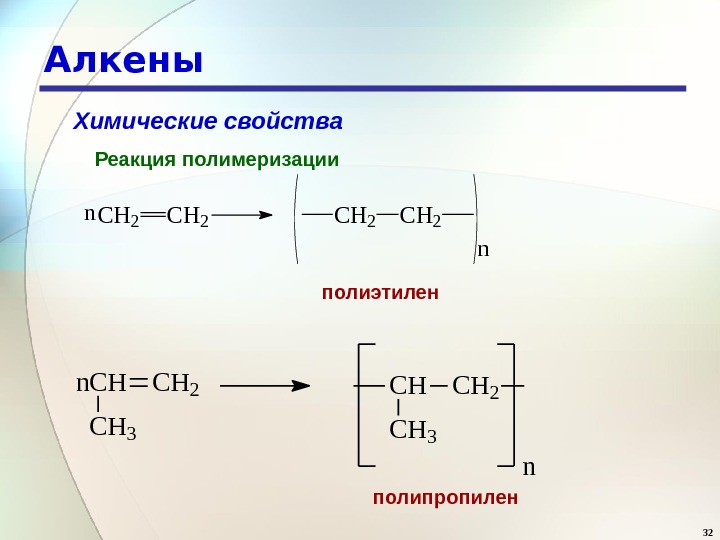
 32 Алкены Химические свойства Реакция полимеризации C H 2 n n полиэтилен n C H C H 2 C H 3 n полипропилен
32 Алкены Химические свойства Реакция полимеризации C H 2 n n полиэтилен n C H C H 2 C H 3 n полипропилен
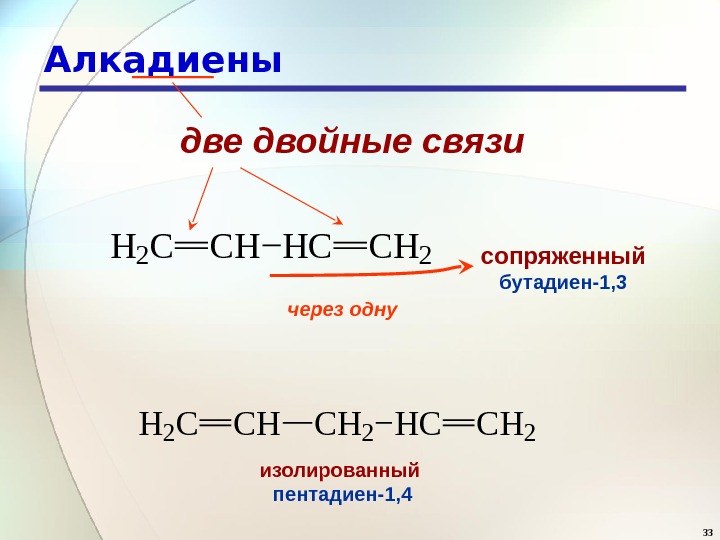
 33 Алкадиены две двойные связи. H 2 CCHHCCH 2 сопряженный бутадиен-1, 3 H 2 CCHCH 2 HCCH 2 изолированный пентадиен-1, 4 через одну
33 Алкадиены две двойные связи. H 2 CCHHCCH 2 сопряженный бутадиен-1, 3 H 2 CCHCH 2 HCCH 2 изолированный пентадиен-1, 4 через одну
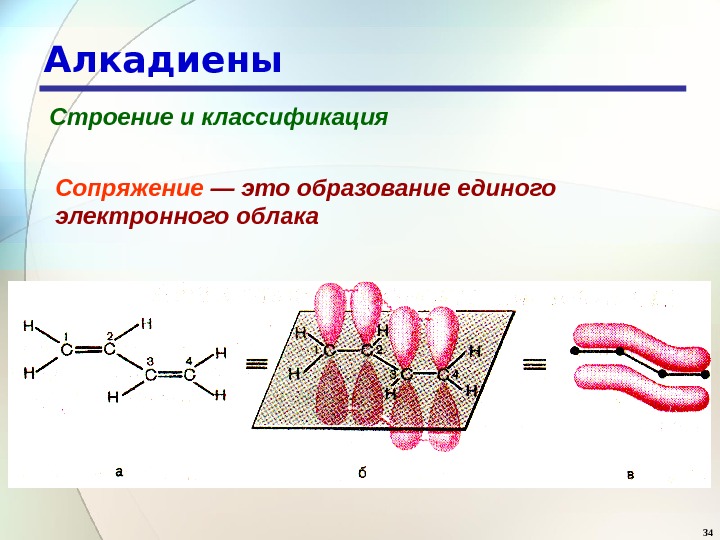
 34 Алкадиены Строение и классификация Сопряжение — это образование единого электронного облака
34 Алкадиены Строение и классификация Сопряжение — это образование единого электронного облака
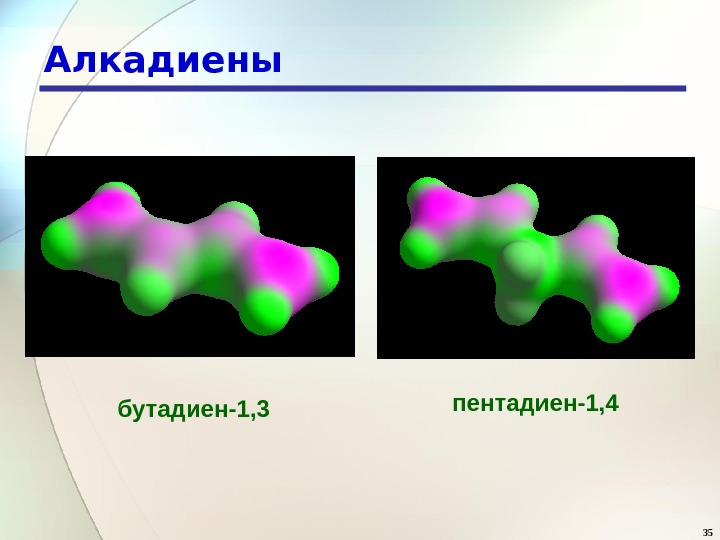
 35 Алкадиены пентадиен-1, 4 бутадиен-1,
35 Алкадиены пентадиен-1, 4 бутадиен-1,
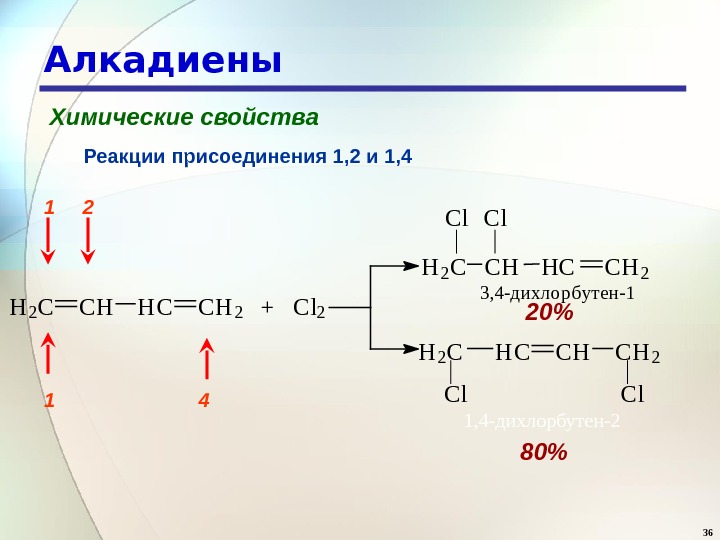
 36 Алкадиены Химические свойства Реакции присоединения 1, 2 и 1, 4 80% 20%H 2 C C H H C C H 2 + C l 2 H 2 CC l C H H C C H 2 C H C H 23 , 4 — д и х л о р б у т е н — 1 C l 1, 4 -дихлорбутен-2 C l
36 Алкадиены Химические свойства Реакции присоединения 1, 2 и 1, 4 80% 20%H 2 C C H H C C H 2 + C l 2 H 2 CC l C H H C C H 2 C H C H 23 , 4 — д и х л о р б у т е н — 1 C l 1, 4 -дихлорбутен-2 C l
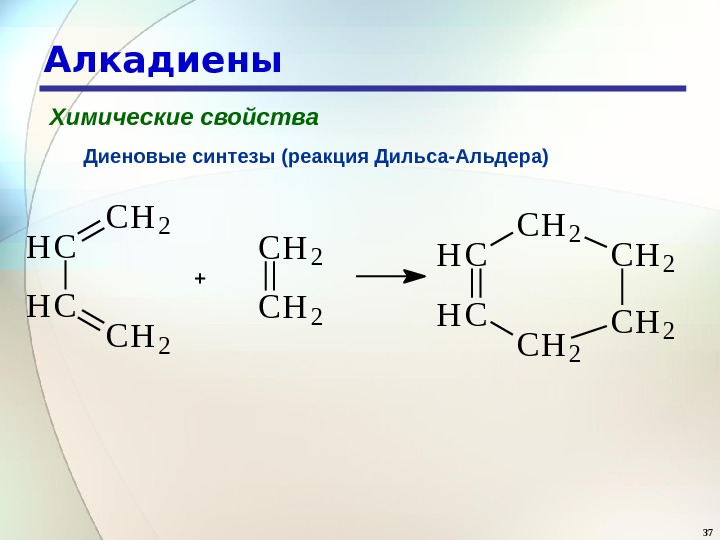
 37 Алкадиены Химические свойства Диеновые синтезы (реакция Дильса-Альдера) H C C H 2 C H 2 H C C H
37 Алкадиены Химические свойства Диеновые синтезы (реакция Дильса-Альдера) H C C H 2 C H 2 H C C H
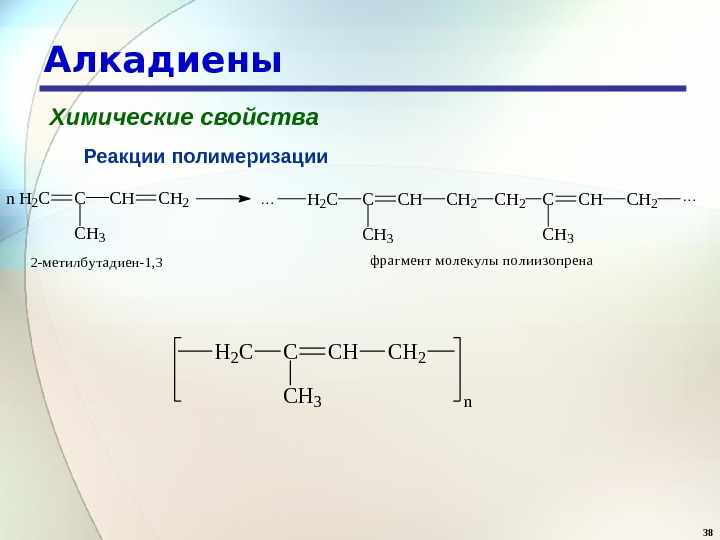
 38 Алкадиены Химические свойства Реакции полимеризацииn H 2 CC CH 3 CHCH 2 CH 2 CCHCH 2 CH 3 2 -метилбутадиен-1, 3 фрагмент молекулы полиизопрена H 2 CC CH 3 CHCH 2 n
38 Алкадиены Химические свойства Реакции полимеризацииn H 2 CC CH 3 CHCH 2 CH 2 CCHCH 2 CH 3 2 -метилбутадиен-1, 3 фрагмент молекулы полиизопрена H 2 CC CH 3 CHCH 2 n
 39 Алкадиены Каучуконосы ГЕВЕЯ БРАЗИЛЬСКАЯ ( Hevea brasiliensis ) Содержание каучука в млечном соке у этого каучукового дерева бассейна Амазонки, достигает 40— 50%. Каучук, добываемый из этого растения, составляет 90— 92% мирового производства натурального каучука. В настоящее время гевея бразильская широко культивируется в тропической Азии (остров Шри-Ланка, полуостров Малакка, Малайский архипелаг), Африке (Нигерия). ГЕВЕЯ БРАЗИЛЬСКАЯ ( Hevea brasiliensis )
39 Алкадиены Каучуконосы ГЕВЕЯ БРАЗИЛЬСКАЯ ( Hevea brasiliensis ) Содержание каучука в млечном соке у этого каучукового дерева бассейна Амазонки, достигает 40— 50%. Каучук, добываемый из этого растения, составляет 90— 92% мирового производства натурального каучука. В настоящее время гевея бразильская широко культивируется в тропической Азии (остров Шри-Ланка, полуостров Малакка, Малайский архипелаг), Африке (Нигерия). ГЕВЕЯ БРАЗИЛЬСКАЯ ( Hevea brasiliensis )
 40 Алкадиены Каучуконосы ГЕВЕЯ БРАЗИЛЬСКАЯ ( Hevea brasiliensis )
40 Алкадиены Каучуконосы ГЕВЕЯ БРАЗИЛЬСКАЯ ( Hevea brasiliensis )
 41 Алкадиены Каучуконосы Одуванчик кок-сагыз ( Taraxacum kok-saghyz Rodin ) открыт в 1931 г. Распространен в долинах восточного Тянь-Шаня (Нарынкольский район Алма-Атинской обл. ). В культуре его возделывали в России, Казахстане, Белоруссии, на Украине (в 1956 г. здесь засевалось 7 тыс. га), в странах Прибалтики, Швеции, Северном Китае, США. Эффективный каучуконос. В корнях содержится 6 -11% каучука (в корнях дикорастущих растений — до 27%), который по качеству не уступает каучуку из гевеи. На полях кок-сагыза. Фото 1943 года
41 Алкадиены Каучуконосы Одуванчик кок-сагыз ( Taraxacum kok-saghyz Rodin ) открыт в 1931 г. Распространен в долинах восточного Тянь-Шаня (Нарынкольский район Алма-Атинской обл. ). В культуре его возделывали в России, Казахстане, Белоруссии, на Украине (в 1956 г. здесь засевалось 7 тыс. га), в странах Прибалтики, Швеции, Северном Китае, США. Эффективный каучуконос. В корнях содержится 6 -11% каучука (в корнях дикорастущих растений — до 27%), который по качеству не уступает каучуку из гевеи. На полях кок-сагыза. Фото 1943 года
 42 Алкадиены Каучуконосы Кок-сагыз
42 Алкадиены Каучуконосы Кок-сагыз
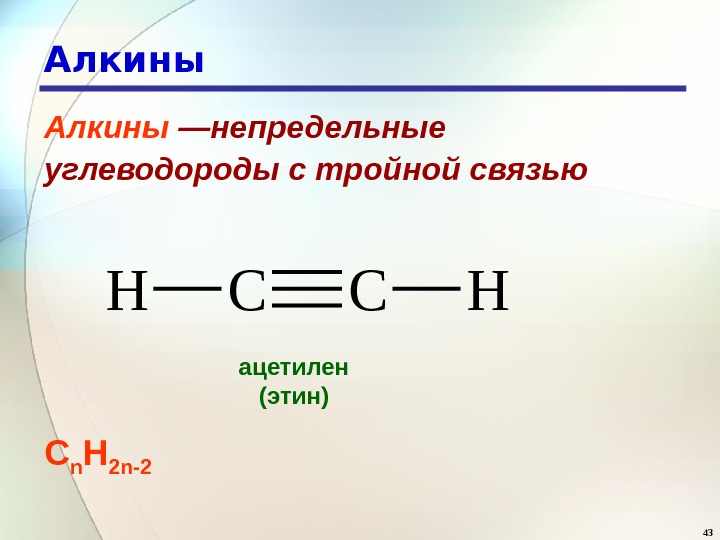
 43 Алкины —непредельные углеводороды с тройной связью С n Н 2 n-2 CCHH ацетилен (этин)
43 Алкины —непредельные углеводороды с тройной связью С n Н 2 n-2 CCHH ацетилен (этин)
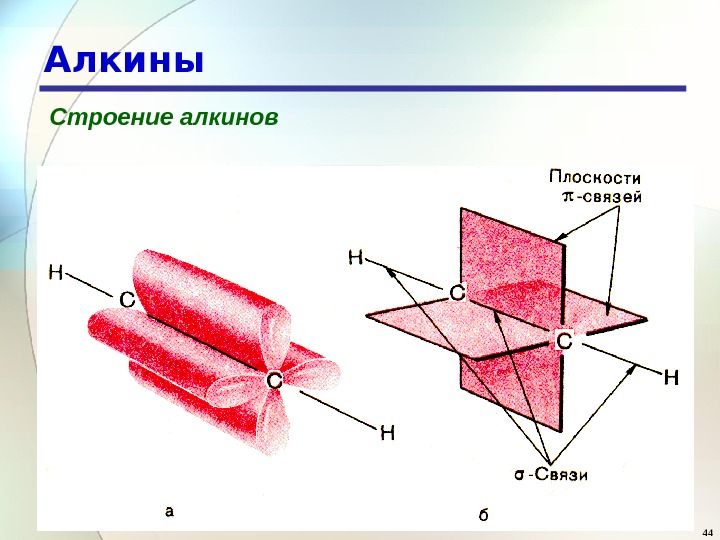
 44 Алкины Строение алкинов
44 Алкины Строение алкинов
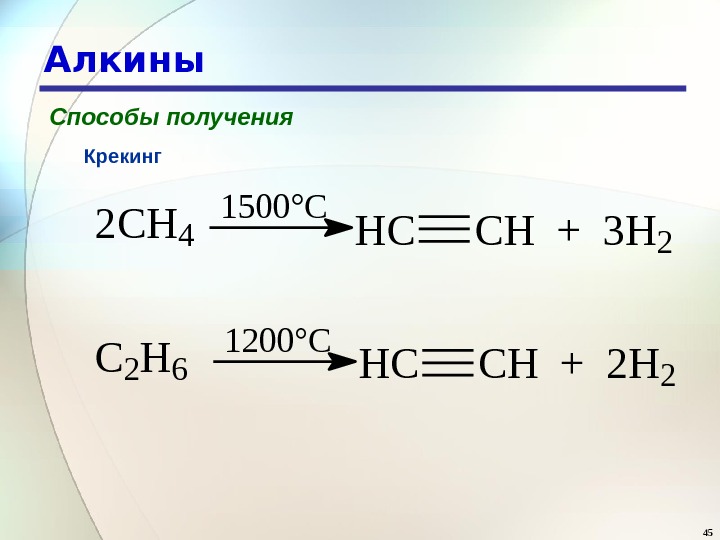
 45 Алкины Способы получения Крекинг 2 CH 4 1500°C HCCH + 3 H 2 C 2 H 6 1200°C HCCH + 2 H
45 Алкины Способы получения Крекинг 2 CH 4 1500°C HCCH + 3 H 2 C 2 H 6 1200°C HCCH + 2 H
 46 Алкины Способы получения Из карбида кальция. Ca. O + 3 C 2500°C Ca. C 2 + CO Ca. C 2 + 2 H 2 OHCCH + Ca(OH)
46 Алкины Способы получения Из карбида кальция. Ca. O + 3 C 2500°C Ca. C 2 + CO Ca. C 2 + 2 H 2 OHCCH + Ca(OH)
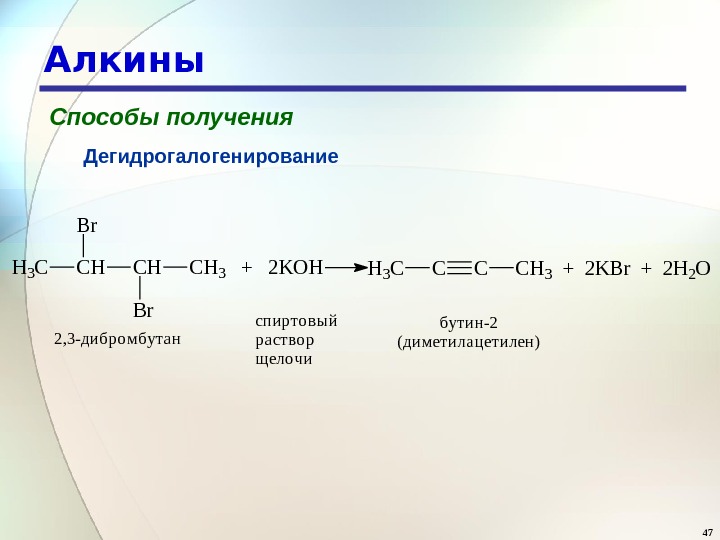
 47 Алкины Способы получения Дегидрогалогенирование. H 3 CCHCHCH 3 + 2 KOH Br Br H 3 CCCCH 3 + 2 KBr + 2 H 2 O 2, 3 -дибромбутан спиртовый раствор щелочи бутин-2 (диметилацетилен)
47 Алкины Способы получения Дегидрогалогенирование. H 3 CCHCHCH 3 + 2 KOH Br Br H 3 CCCCH 3 + 2 KBr + 2 H 2 O 2, 3 -дибромбутан спиртовый раствор щелочи бутин-2 (диметилацетилен)
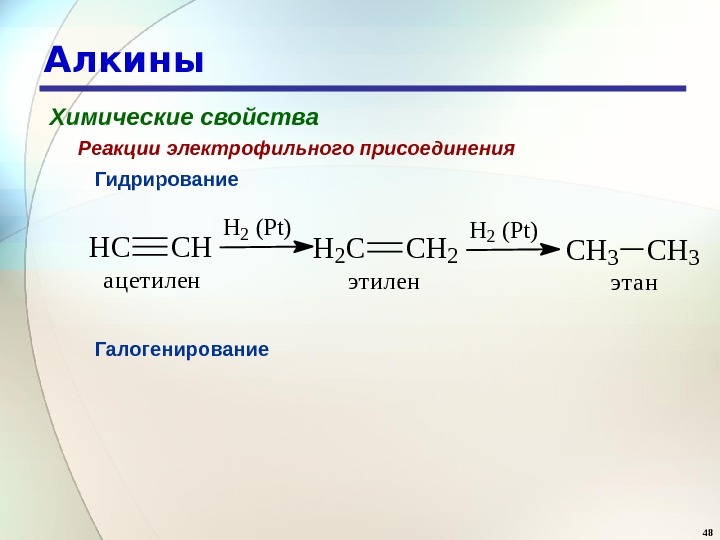
 48 Алкины Химические свойства Гидрирование. Реакции электрофильного присоединения. HCCH H 2 (Pt) H 2 CCH 2 (Pt) CH 3 ацетиленэтан Галогенирование
48 Алкины Химические свойства Гидрирование. Реакции электрофильного присоединения. HCCH H 2 (Pt) H 2 CCH 2 (Pt) CH 3 ацетиленэтан Галогенирование
 49 Алкины Химические свойства Гидрогалогенирование. Реакции электрофильного присоединения
49 Алкины Химические свойства Гидрогалогенирование. Реакции электрофильного присоединения
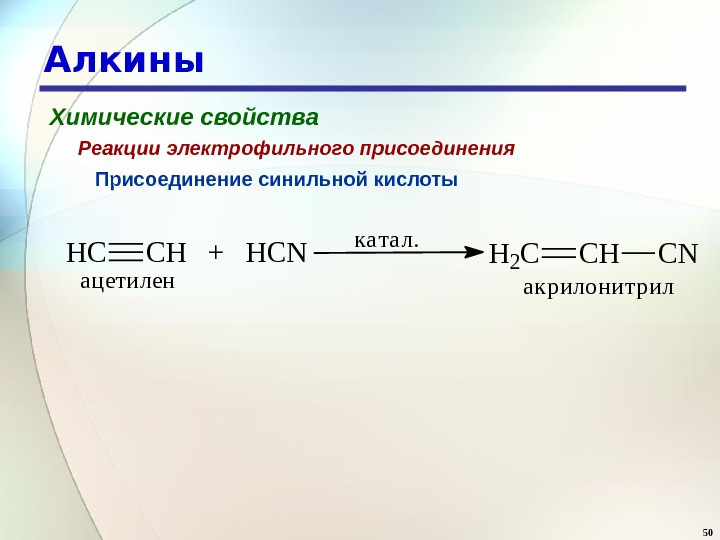
 50 Алкины Химические свойства Присоединение синильной кислоты. Реакции электрофильного присоединения. HCCH + HCN ацетилен катал. H 2 CCHCN акрилонитрил
50 Алкины Химические свойства Присоединение синильной кислоты. Реакции электрофильного присоединения. HCCH + HCN ацетилен катал. H 2 CCHCN акрилонитрил
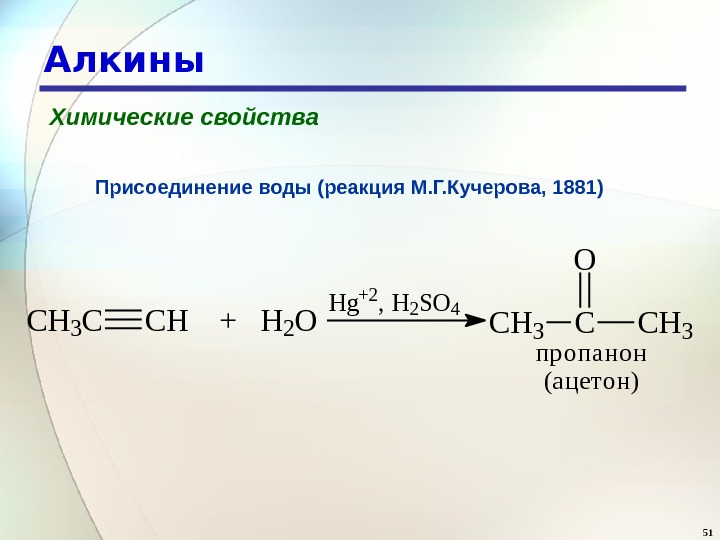
 51 Алкины Химические свойства Присоединение воды (реакция М. Г. Кучерова, 1881) CH 3 CCH + H 2 O H g +2 , H 2 S O 4 CH 3 CCH 3 O п р о п а н о н ( а ц е т о н )
51 Алкины Химические свойства Присоединение воды (реакция М. Г. Кучерова, 1881) CH 3 CCH + H 2 O H g +2 , H 2 S O 4 CH 3 CCH 3 O п р о п а н о н ( а ц е т о н )
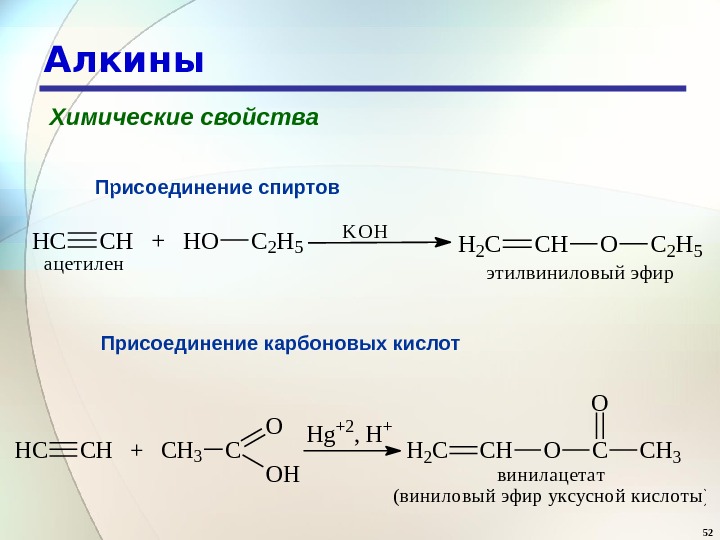
 52 Алкины Химические свойства Присоединение спиртов. HCCH + HOC 2 H 5 ацетилен KOH H 2 CCHOC 2 H 5 этилвиниловый эфир H C C H + C H 3 C O O H H g + 2 , H + H 2 C C H O CO C H 3 в и н и л а ц е т а т ( в и н и л о в ы й э ф и р у к с у с н о й к и с л о т ы )Присоединение карбоновых кислот
52 Алкины Химические свойства Присоединение спиртов. HCCH + HOC 2 H 5 ацетилен KOH H 2 CCHOC 2 H 5 этилвиниловый эфир H C C H + C H 3 C O O H H g + 2 , H + H 2 C C H O CO C H 3 в и н и л а ц е т а т ( в и н и л о в ы й э ф и р у к с у с н о й к и с л о т ы )Присоединение карбоновых кислот
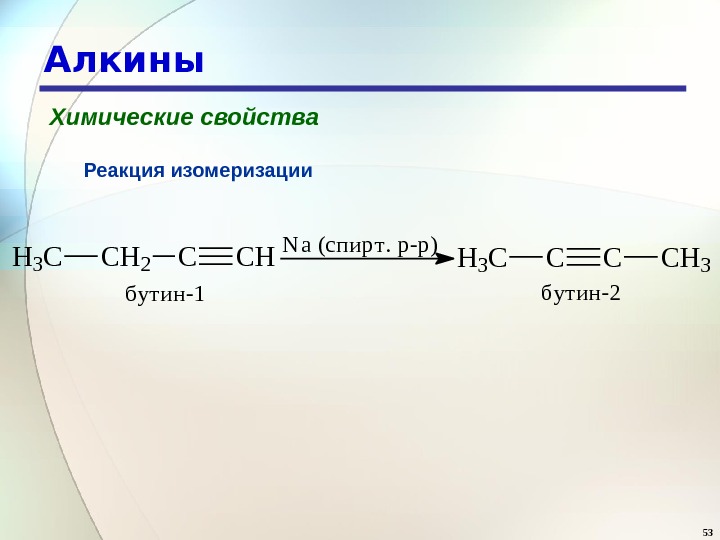
 53 Алкины Химические свойства Реакция изомеризации. H 3 CCH 2 CCH Na (спирт. р-р) H 3 CCCCH 3 бутин-1 бутин-
53 Алкины Химические свойства Реакция изомеризации. H 3 CCH 2 CCH Na (спирт. р-р) H 3 CCCCH 3 бутин-1 бутин-
 54 Алкины Химические свойства Реакции полимеризации. HCCH + HCCH Cu 2 Cl 2 80°C HCCHCCH 2 винилацетилен (бутен-1 -ин-3)
54 Алкины Химические свойства Реакции полимеризации. HCCH + HCCH Cu 2 Cl 2 80°C HCCHCCH 2 винилацетилен (бутен-1 -ин-3)
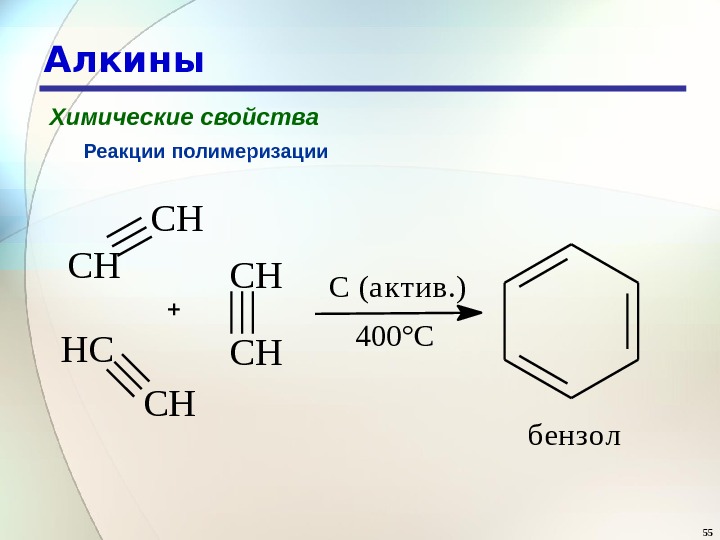
 55 Алкины Химические свойства Реакции полимеризации. CH CH HC CH C (актив. ) 400°С бензол
55 Алкины Химические свойства Реакции полимеризации. CH CH HC CH C (актив. ) 400°С бензол
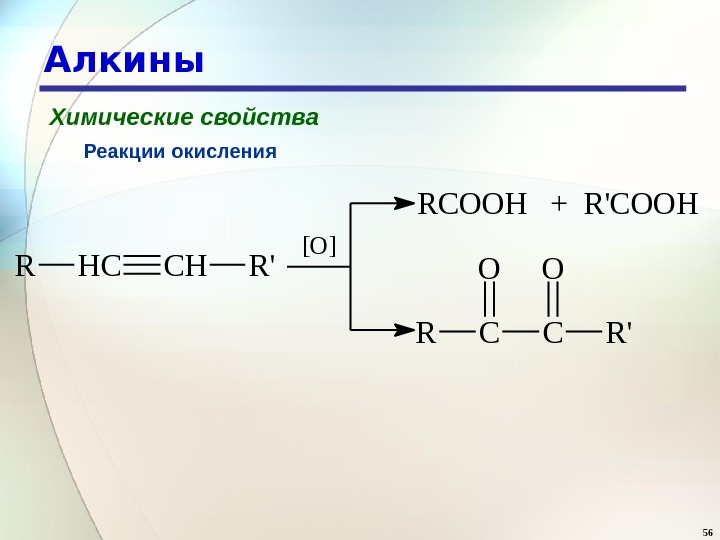
![56 Алкины Химические свойства Реакции окисления R H C C H R ' [ O ] 56 Алкины Химические свойства Реакции окисления R H C C H R ' [ O ]](/docs//alken-in_images/alken-in_55.jpg) 56 Алкины Химические свойства Реакции окисления R H C C H R ‘ [ O ] R C O O H + R ‘ C O O H R C C R ‘O O
56 Алкины Химические свойства Реакции окисления R H C C H R ‘ [ O ] R C O O H + R ‘ C O O H R C C R ‘O O
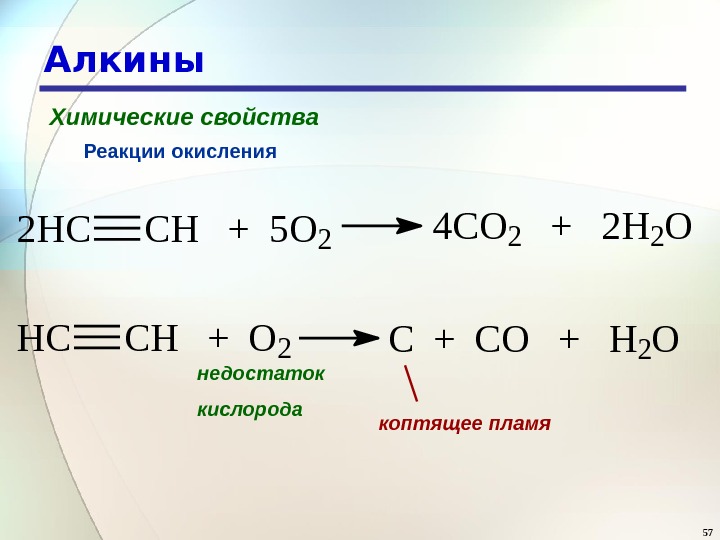
 57 Алкины Химические свойства Реакции окисления 2 HCCH + 5 O 2 4 CO 2 + 2 H 2 O HCCH + O 2 C + CO + H 2 O коптящее пламянедостаток кислорода
57 Алкины Химические свойства Реакции окисления 2 HCCH + 5 O 2 4 CO 2 + 2 H 2 O HCCH + O 2 C + CO + H 2 O коптящее пламянедостаток кислорода
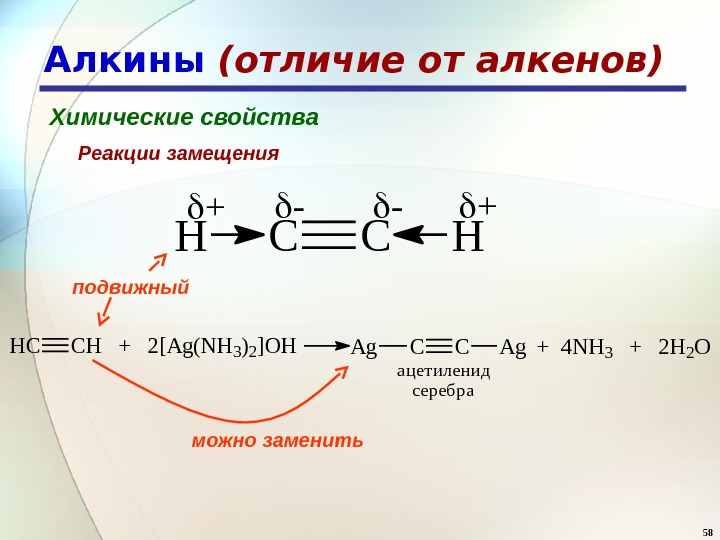
 58 Алкины (отличие от алкенов) Химические свойства Реакции замещения. HCCH + + — — HCCH + 2[Ag(NH 3)2]OHAg. CCAg + 4 NH 3 + 2 H 2 O ацетиленид серебра подвижный можно заменить
58 Алкины (отличие от алкенов) Химические свойства Реакции замещения. HCCH + + — — HCCH + 2[Ag(NH 3)2]OHAg. CCAg + 4 NH 3 + 2 H 2 O ацетиленид серебра подвижный можно заменить
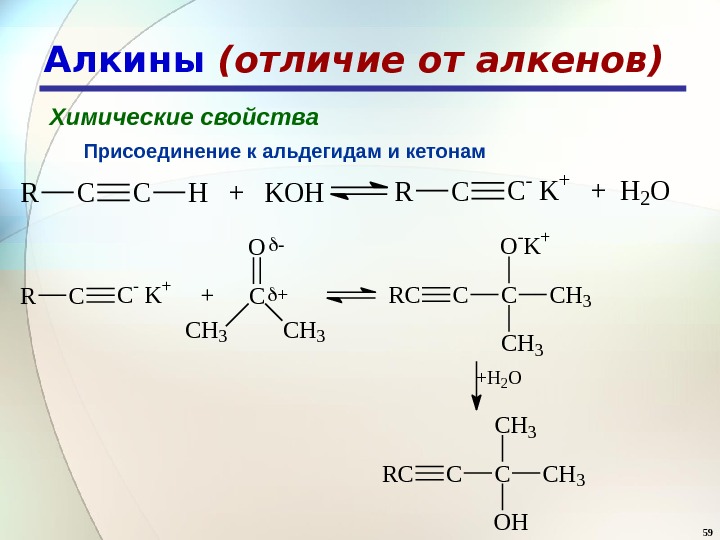
 59 Алкины (отличие от алкенов) Химические свойства Присоединение к альдегидам и кетонам. RCCH + KOHRCC — K + + H 2 O +H 2 O RCCCCH 3 OH CH 3 RCC- K + + C O CH 3 — +RCCC O -K + CH
59 Алкины (отличие от алкенов) Химические свойства Присоединение к альдегидам и кетонам. RCCH + KOHRCC — K + + H 2 O +H 2 O RCCCCH 3 OH CH 3 RCC- K + + C O CH 3 — +RCCC O -K + CH
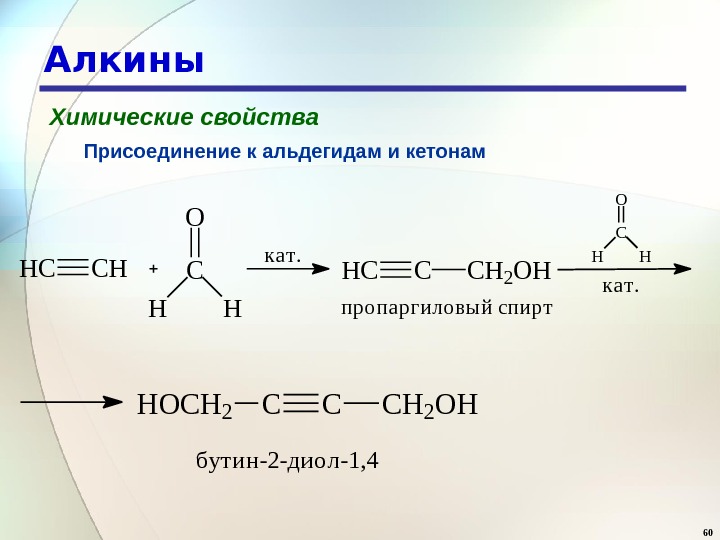
 60 Алкины Химические свойства Присоединение к альдегидам и кетонам. HCCHC O HH к а т. HCCCH 2 OH к а т. CO H H п р о п а р г и л о в ы й с п и р т HOCH 2 CCCH 2 OH бутин-2 -диол-1,
60 Алкины Химические свойства Присоединение к альдегидам и кетонам. HCCHC O HH к а т. HCCCH 2 OH к а т. CO H H п р о п а р г и л о в ы й с п и р т HOCH 2 CCCH 2 OH бутин-2 -диол-1,
