• Алкінами або ацетиленовими вуглеводнями називаються вуглеводні,









- Размер: 908 Кб
- Количество слайдов: 33
Описание презентации • Алкінами або ацетиленовими вуглеводнями називаються вуглеводні, по слайдам
 • Алкінами або ацетиленовими вуглеводнями називаються вуглеводні, які мають в молекулі один потрійний зв’язок —С С—. • Вони утворюють гомологічний ряд загальної формули Сn Н 2 n-2 ; • n = 2 та більше • Перший представник цього ряду – етин ( ацетилен ); n = 2. АЛКІНИ Структурна формула (традиційне зображення) Номенклатура Прийняті тепер способи зображення IUPAC Раціональна Етин Ацетилен Пропін Метилацетилен 1 -Бутин Етилацетилен 2 -Бутин Диметилацетилен 1 -Пентин Пропілацетилен 2 -Метилбутин Ізопропіл-ацетиле н HCCH HCCCH 3 HCCCH 2 CH 3 CCCH 3 H 3 C HCCCH 2 CH 3 HCCCH(CH 3)CH 3 HC CH 3 C H 3 H 3 C HCCH 3 H C C H 3 HCCH
• Алкінами або ацетиленовими вуглеводнями називаються вуглеводні, які мають в молекулі один потрійний зв’язок —С С—. • Вони утворюють гомологічний ряд загальної формули Сn Н 2 n-2 ; • n = 2 та більше • Перший представник цього ряду – етин ( ацетилен ); n = 2. АЛКІНИ Структурна формула (традиційне зображення) Номенклатура Прийняті тепер способи зображення IUPAC Раціональна Етин Ацетилен Пропін Метилацетилен 1 -Бутин Етилацетилен 2 -Бутин Диметилацетилен 1 -Пентин Пропілацетилен 2 -Метилбутин Ізопропіл-ацетиле н HCCH HCCCH 3 HCCCH 2 CH 3 CCCH 3 H 3 C HCCCH 2 CH 3 HCCCH(CH 3)CH 3 HC CH 3 C H 3 H 3 C HCCH 3 H C C H 3 HCCH
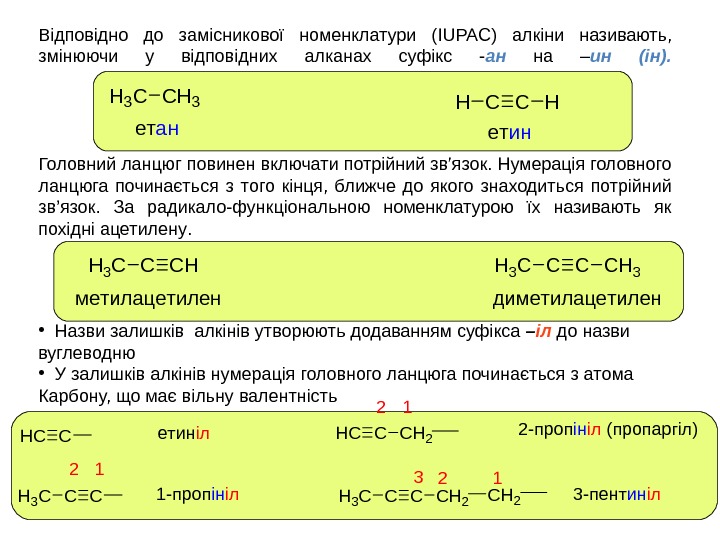
 Відповідно до замісникової номенклатури ( IUPAC ) алкіни називають, змінюючи у відповідних алканах суфікс — ан на – ин (ін). Головний ланцюг повинен включати потрійний зв’язок. Нумерація головного ланцюга починається з того кінця, ближче до якого знаходиться потрійний зв’язок. За радикало-функціональною номенклатурою їх називають як похідні ацетилену. H 3 CСH 3 CCHH етанетин • Назви залишків алкінів утворюють додаванням суфікса – іл до назви вуглеводн ю • У залишків алкінів нумерація головного ланцюга починається з атома Карбону, що має вільну валентність HCC CCH 3 C CHCCH 2 CCCH 2 H 3 C етиніл 1 -пропініл 2 -пропініл (пропаргіл) 3 -пентиніл 123 12 12 CCHH 3 C метилацетилен CCH 3 диметилацетилен
Відповідно до замісникової номенклатури ( IUPAC ) алкіни називають, змінюючи у відповідних алканах суфікс — ан на – ин (ін). Головний ланцюг повинен включати потрійний зв’язок. Нумерація головного ланцюга починається з того кінця, ближче до якого знаходиться потрійний зв’язок. За радикало-функціональною номенклатурою їх називають як похідні ацетилену. H 3 CСH 3 CCHH етанетин • Назви залишків алкінів утворюють додаванням суфікса – іл до назви вуглеводн ю • У залишків алкінів нумерація головного ланцюга починається з атома Карбону, що має вільну валентність HCC CCH 3 C CHCCH 2 CCCH 2 H 3 C етиніл 1 -пропініл 2 -пропініл (пропаргіл) 3 -пентиніл 123 12 12 CCHH 3 C метилацетилен CCH 3 диметилацетилен
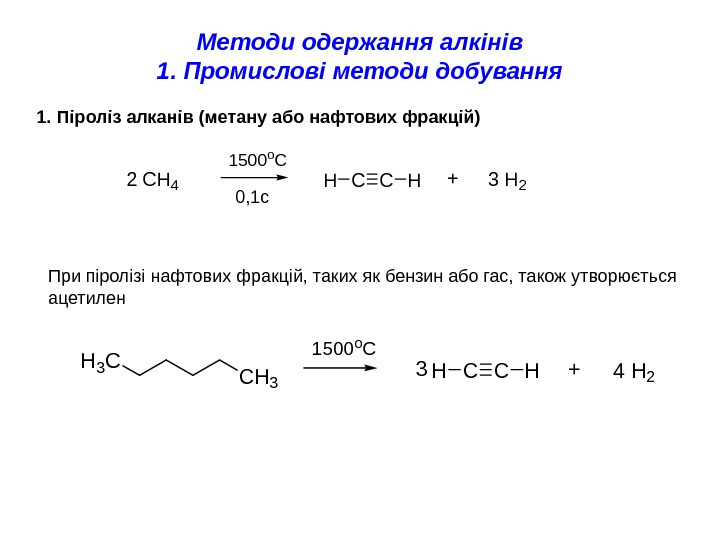
 Методи одержання алкінів 1. Промислові методи добування 1. Піроліз алканів (метану або нафтових фракцій)CCHH 2 CH 4 1500 o. C +3 H 2 H 3 C CH 3 CCHH 1500 o. C +4 H 23 При піролізі нафтових фракцій, таких як бензин або гас, також утворюється ацетилен 0, 1 с
Методи одержання алкінів 1. Промислові методи добування 1. Піроліз алканів (метану або нафтових фракцій)CCHH 2 CH 4 1500 o. C +3 H 2 H 3 C CH 3 CCHH 1500 o. C +4 H 23 При піролізі нафтових фракцій, таких як бензин або гас, також утворюється ацетилен 0, 1 с
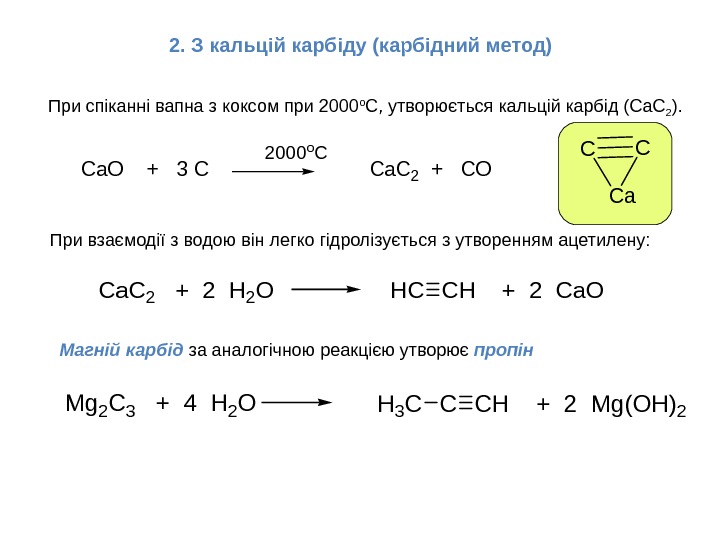
 2. З кальцій карбіду (карбідний метод)CC Ca Ca. O + 3 C 2000 o. C Ca. C 2 + CO При взаємодії з водою він легко гідролізується з утворенням ацетилену: При спіканні вапна з коксом при 2000 о С, утворюється кальцій карбід (Са. С 2 ). Ca. C 2 + 2 H 2 OHCCH + 2 Ca. O Магній карбід за аналогічною реакцією утворює пропін Mg 2 C 3 + 4 H 2 OCCH + 2 Mg(OH)2 H
2. З кальцій карбіду (карбідний метод)CC Ca Ca. O + 3 C 2000 o. C Ca. C 2 + CO При взаємодії з водою він легко гідролізується з утворенням ацетилену: При спіканні вапна з коксом при 2000 о С, утворюється кальцій карбід (Са. С 2 ). Ca. C 2 + 2 H 2 OHCCH + 2 Ca. O Магній карбід за аналогічною реакцією утворює пропін Mg 2 C 3 + 4 H 2 OCCH + 2 Mg(OH)2 H
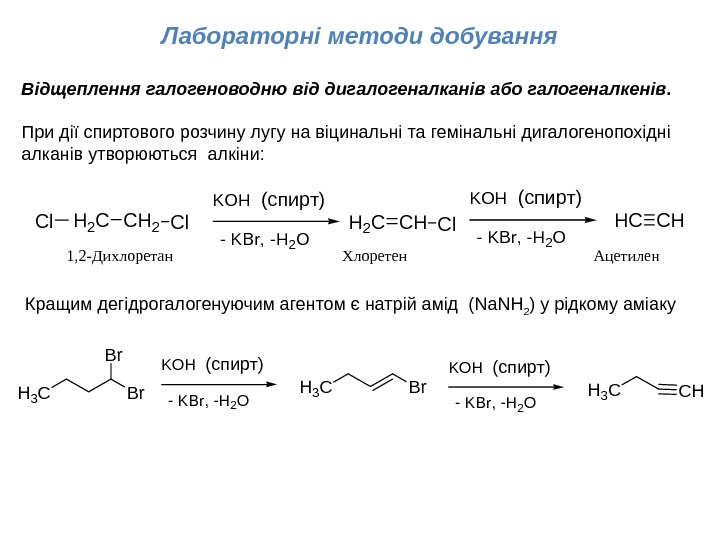
 Лабораторні методи добування 1, 2 — Дихлоретан Хлоретен Ацетилен. Відщеплення галогеноводню від дигалогеналканів або галогеналкенів. При дії спиртового розчину лугу на віцинальні та гемінальні дигалогенопохідні алканів утворюються алкіни: Br Br H 3 C KOH(спирт) Br. H 3 C — KBr, -H 2 O KOH(спирт) — KBr, -H 2 O CHH 3 C CH 2 H 2 CCl. Cl KOH(спирт) — KBr, -H 2 O CHH 2 CCl KOH(спирт) — KBr, -H 2 O CHHC Кращим дегідрогалогенуючим агентом є натрій амід ( Na. NH 2 ) у рідкому аміаку
Лабораторні методи добування 1, 2 — Дихлоретан Хлоретен Ацетилен. Відщеплення галогеноводню від дигалогеналканів або галогеналкенів. При дії спиртового розчину лугу на віцинальні та гемінальні дигалогенопохідні алканів утворюються алкіни: Br Br H 3 C KOH(спирт) Br. H 3 C — KBr, -H 2 O KOH(спирт) — KBr, -H 2 O CHH 3 C CH 2 H 2 CCl. Cl KOH(спирт) — KBr, -H 2 O CHH 2 CCl KOH(спирт) — KBr, -H 2 O CHHC Кращим дегідрогалогенуючим агентом є натрій амід ( Na. NH 2 ) у рідкому аміаку
 2. Реакції алкілування ацетилену через стадію утворення металоорганічних сполук (ацетиленідів). CHHC Na. NH 2 — NH 3 CNa. HC RHal CHCR — Na. Hal Натрій ацетиленідалкілацетилен У реакцію добре вступають первинні та вторинні алкілгалогеніди. Взаємодія ацетиленідів з третинними галогенідами практично не відбувається Атоми гідрогену в ацетилені можуть бути заміщені на атоми металів. Одержані ацетиленід и при дії алкілгалогенідів утворюють відповідні алкі лацетилени. CHC CH 3 Mg. Br — CH 4 CMg. Br. C RBr CCR — Mg. Br 2 H 3 CH
2. Реакції алкілування ацетилену через стадію утворення металоорганічних сполук (ацетиленідів). CHHC Na. NH 2 — NH 3 CNa. HC RHal CHCR — Na. Hal Натрій ацетиленідалкілацетилен У реакцію добре вступають первинні та вторинні алкілгалогеніди. Взаємодія ацетиленідів з третинними галогенідами практично не відбувається Атоми гідрогену в ацетилені можуть бути заміщені на атоми металів. Одержані ацетиленід и при дії алкілгалогенідів утворюють відповідні алкі лацетилени. CHC CH 3 Mg. Br — CH 4 CMg. Br. C RBr CCR — Mg. Br 2 H 3 CH
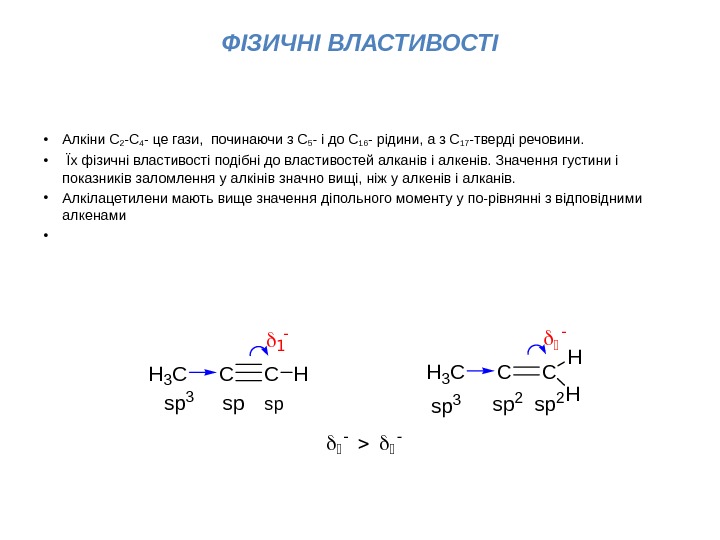
 ФІЗИЧНІ ВЛАСТИВОСТІ • Алкіни С 2 -С 4 — це гази, починаючи з С 5 — і до С 16 — рідини, а з С 17 -тверді речовини. • Їх фізичні властивості подібні до властивостей алканів і алкенів. Значення густини і показників заломлення у алкінів значно вищі, ніж у алкенів і алканів. • Алкілацетилени мають вище значення діпольного моменту у по-рівнянні з відповідними алкенами • CCH 3 C H spspsp 3 CCH 3 C H sp 3 Hsp
ФІЗИЧНІ ВЛАСТИВОСТІ • Алкіни С 2 -С 4 — це гази, починаючи з С 5 — і до С 16 — рідини, а з С 17 -тверді речовини. • Їх фізичні властивості подібні до властивостей алканів і алкенів. Значення густини і показників заломлення у алкінів значно вищі, ніж у алкенів і алканів. • Алкілацетилени мають вище значення діпольного моменту у по-рівнянні з відповідними алкенами • CCH 3 C H spspsp 3 CCH 3 C H sp 3 Hsp
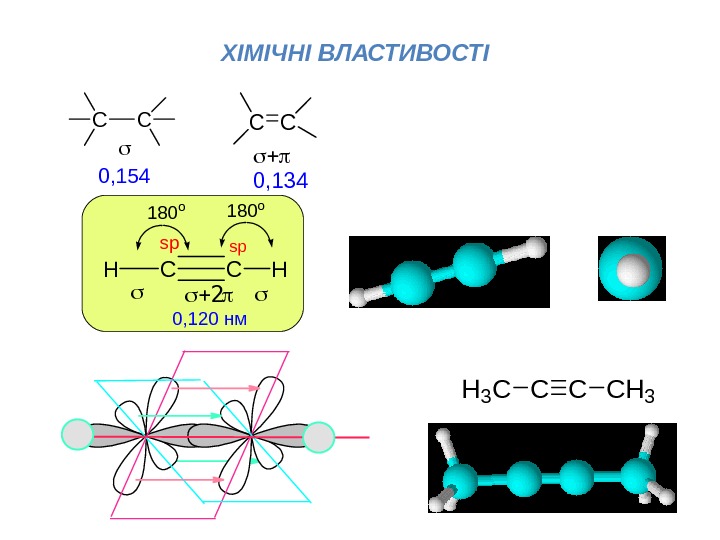
 ХІМІЧНІ ВЛАСТИВОСТІCCHH spsp 180 o 0, 120 нм CC 0, 154 CC 0, 134 CCCH 3 H
ХІМІЧНІ ВЛАСТИВОСТІCCHH spsp 180 o 0, 120 нм CC 0, 154 CC 0, 134 CCCH 3 H
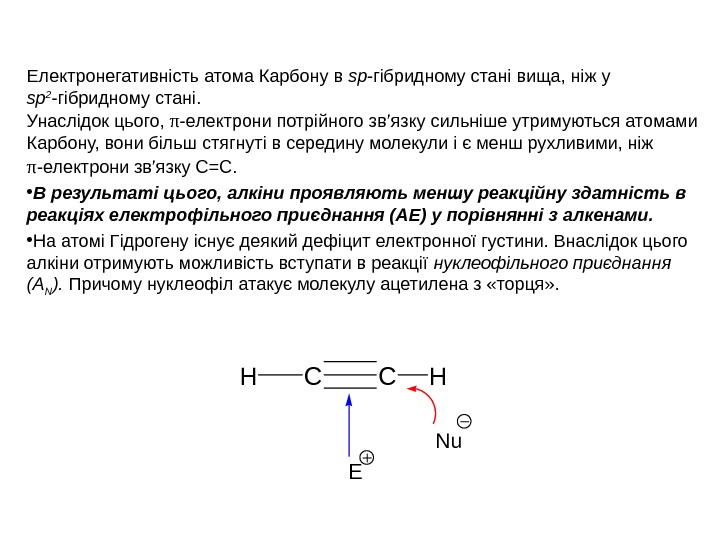
 Електронегативність атома Карбону в sp -гібридному стані вища, ніж у sp 2 -гібридному стані. Унаслідок цього, π -електрони потрійного зв’язку сильніше утримуються атомами Карбону, вони більш стягнуті в середину молекули і є менш рухливими, ніж π -електрони зв’язку С=С. • В результаті цього, алкіни проявляють меншу реакційну здатність в реакціях електрофільного приєднання (АЕ) у порівнянні з алкенами. • На атомі Гідрогену існує деякий дефіцит електронної густини. Внаслідок цього алкіни отримують можливість вступати в реакції нуклеофільного приєднання (А N ). Причому нуклеофіл атакує молекулу ацетилена з «торця» . CCHH E Nu
Електронегативність атома Карбону в sp -гібридному стані вища, ніж у sp 2 -гібридному стані. Унаслідок цього, π -електрони потрійного зв’язку сильніше утримуються атомами Карбону, вони більш стягнуті в середину молекули і є менш рухливими, ніж π -електрони зв’язку С=С. • В результаті цього, алкіни проявляють меншу реакційну здатність в реакціях електрофільного приєднання (АЕ) у порівнянні з алкенами. • На атомі Гідрогену існує деякий дефіцит електронної густини. Внаслідок цього алкіни отримують можливість вступати в реакції нуклеофільного приєднання (А N ). Причому нуклеофіл атакує молекулу ацетилена з «торця» . CCHH E Nu
 • В молекулі ацетилену зв’язок С-Н утворений sp — гібридною орбіталлю атома С. • Відомо, що електронегативність гібридної орбіталі зростає зі збільшенням у ній частки s — орбіталі: sp 3 – 2, 5; sp 2 – 2, 75; sp – 3, 2 (за шкалою Л. Полінга) • Вища електронегативність атома С sp призводить до того, що електрона густина σ -зв ’ язку C sp -H зміщена до атома С, унаслідок чого зв ’ язок С-Н є полярним, а на Гідрогені виникає дефіцит електронної густини. • Це означає, що атоми Гідрогену в ацетилені протонізовані значно більше, ніж в етилені або в етані. Це полегшує відрив атома Н основою. • П ро це свідчать значення констант й онізації цих сполук: • р. К (ацетилен) = 25; • р. К (етилен) = 44. • Для порівняння р. К (Н 2 О) = 15, 7. • Отже ацетилен проявляє кислотні властивості (С-Н кислота), хоча є слабшою кислотою, ніж вода.
• В молекулі ацетилену зв’язок С-Н утворений sp — гібридною орбіталлю атома С. • Відомо, що електронегативність гібридної орбіталі зростає зі збільшенням у ній частки s — орбіталі: sp 3 – 2, 5; sp 2 – 2, 75; sp – 3, 2 (за шкалою Л. Полінга) • Вища електронегативність атома С sp призводить до того, що електрона густина σ -зв ’ язку C sp -H зміщена до атома С, унаслідок чого зв ’ язок С-Н є полярним, а на Гідрогені виникає дефіцит електронної густини. • Це означає, що атоми Гідрогену в ацетилені протонізовані значно більше, ніж в етилені або в етані. Це полегшує відрив атома Н основою. • П ро це свідчать значення констант й онізації цих сполук: • р. К (ацетилен) = 25; • р. К (етилен) = 44. • Для порівняння р. К (Н 2 О) = 15, 7. • Отже ацетилен проявляє кислотні властивості (С-Н кислота), хоча є слабшою кислотою, ніж вода.
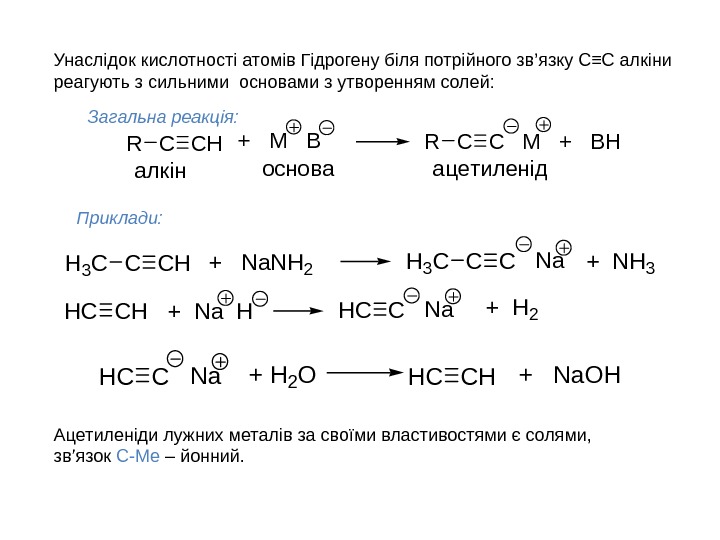
 Унаслідок кислотності атомів Гідрогену біля потрійного зв ’ язку C ≡C алкіни реагують з сильними основами з утворенням солей: CHCR+ M BCCRM + BH ацетиленідосноваалкін Загальна реакція: Приклади: CHCNa+ H 2 OCHHC+ Na. OH CHCH 3 C+ Na. NH 2 CCH 3 CNa+ NH 3 CHHC+ Na HCHCNa+ H 2 Ацетиленіди лужних металів за своїми властивостями є солями, зв ’ язок С-Ме – йонний.
Унаслідок кислотності атомів Гідрогену біля потрійного зв ’ язку C ≡C алкіни реагують з сильними основами з утворенням солей: CHCR+ M BCCRM + BH ацетиленідосноваалкін Загальна реакція: Приклади: CHCNa+ H 2 OCHHC+ Na. OH CHCH 3 C+ Na. NH 2 CCH 3 CNa+ NH 3 CHHC+ Na HCHCNa+ H 2 Ацетиленіди лужних металів за своїми властивостями є солями, зв ’ язок С-Ме – йонний.
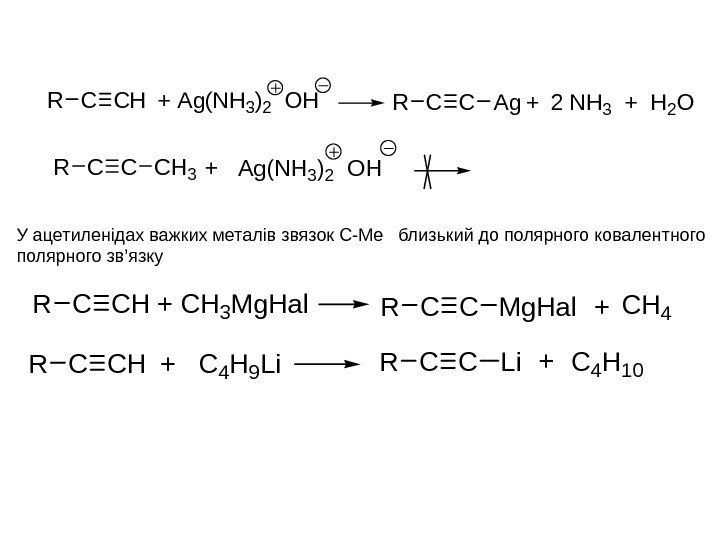
 CHCR+ CH 3 Mg. Hal. CCRMg. Hal+CH 4 CHCR+ C 4 H 9 Li. CCRLi+C 4 H 10 CCR+ Ag(NH 3)2 OHCH 3 CHCR+ Ag(NH 3)2 OHCCRAg+2 NH 3 + H 2 OУ ацетиленідах важких металів звязок С-Ме близький до полярного ковалентного полярного зв ’ язку
CHCR+ CH 3 Mg. Hal. CCRMg. Hal+CH 4 CHCR+ C 4 H 9 Li. CCRLi+C 4 H 10 CCR+ Ag(NH 3)2 OHCH 3 CHCR+ Ag(NH 3)2 OHCCRAg+2 NH 3 + H 2 OУ ацетиленідах важких металів звязок С-Ме близький до полярного ковалентного полярного зв ’ язку
 • Таким чином для алкінів характерні реакції приєднання (АЕ та АN ), полімеризації, окиснення, та заміщення за «кислим” воднем.
• Таким чином для алкінів характерні реакції приєднання (АЕ та АN ), полімеризації, окиснення, та заміщення за «кислим” воднем.
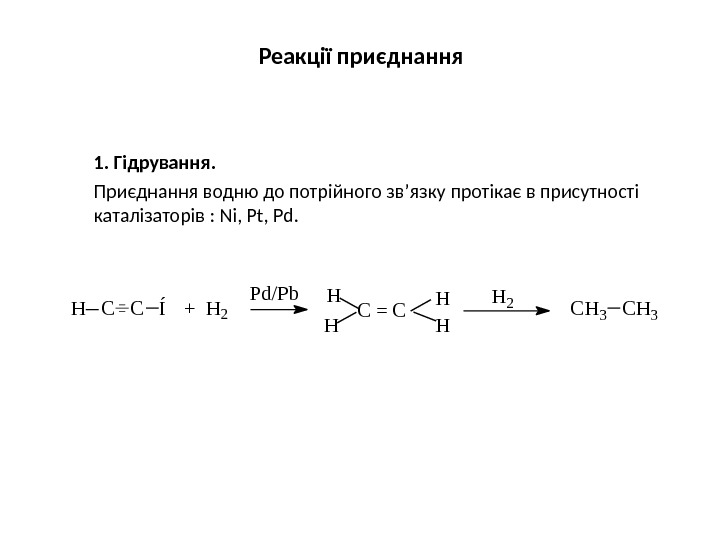
 Реакції приєднання 1. Гідрування. Приєднання водню до потрійного зв’язку протікає в присутності каталізаторів : Ni, Pt, Pd. HH C H 3 C = CH C C Í + H 2 H H H 2 P d / P b
Реакції приєднання 1. Гідрування. Приєднання водню до потрійного зв’язку протікає в присутності каталізаторів : Ni, Pt, Pd. HH C H 3 C = CH C C Í + H 2 H H H 2 P d / P b
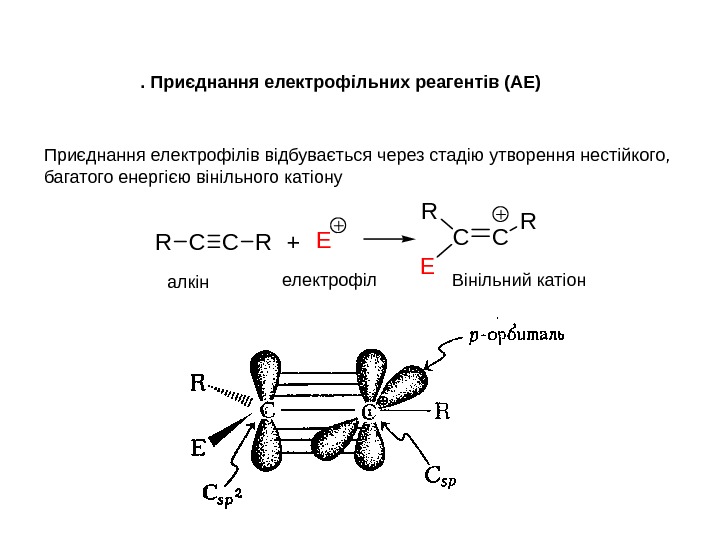
 Приєднання електрофілів відбувається через стадію утворення нестійкого, багатого енергією вінільного катіону. CCRR+ECC R E R. Приєднання електрофільних реагентів (АЕ) Вінільний катіон алкін електрофіл
Приєднання електрофілів відбувається через стадію утворення нестійкого, багатого енергією вінільного катіону. CCRR+ECC R E R. Приєднання електрофільних реагентів (АЕ) Вінільний катіон алкін електрофіл
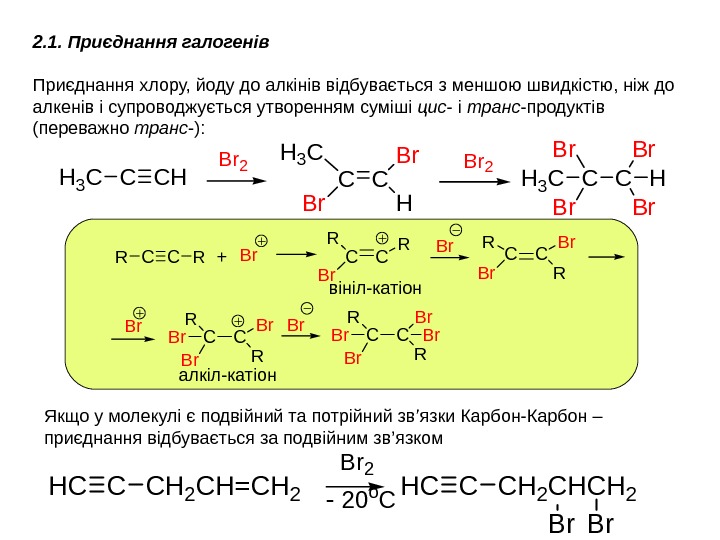
 CHCCH 2 CH=CH 2 Br 2 CHCCH 2 CH Br CH 2 Br — 20 o. CЯкщо у молекулі є подвійний та потрійний зв ’ язки Карбон-Карбон – приєднання відбувається за подвійним зв ’ язком 2. 1. Приєднання галогенів Приєднання хлору, йоду до алкінів відбувається з меншою швидкістю, ніж до алкенів і супроводжується утворенням суміші цис — і транс -продуктів (переважно транс -): CHC Br 2 CCHH 3 C Br Br H Br Br CCRR+CC R Br. Br. CC R Br Br Br CC R Br Br. Br вініл-катіон алкіл-катіон
CHCCH 2 CH=CH 2 Br 2 CHCCH 2 CH Br CH 2 Br — 20 o. CЯкщо у молекулі є подвійний та потрійний зв ’ язки Карбон-Карбон – приєднання відбувається за подвійним зв ’ язком 2. 1. Приєднання галогенів Приєднання хлору, йоду до алкінів відбувається з меншою швидкістю, ніж до алкенів і супроводжується утворенням суміші цис — і транс -продуктів (переважно транс -): CHC Br 2 CCHH 3 C Br Br H Br Br CCRR+CC R Br. Br. CC R Br Br Br CC R Br Br. Br вініл-катіон алкіл-катіон
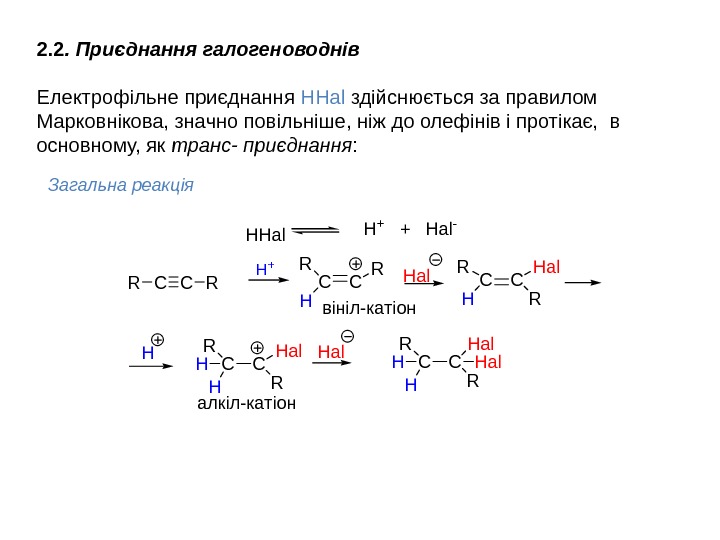
 CCR R CCR H R H a l H H a lв і н і л — к а т і о н а л к і л — к а т і о н H+H H a l H + + H a l -2. 2. Приєднання галогеноводнів Електрофільне приєднання НHal здійснюється за правилом Марковнікова, значно повільніше, ніж до олефінів і протікає, в основному, як транс- приєднання : Загальна реакція
CCR R CCR H R H a l H H a lв і н і л — к а т і о н а л к і л — к а т і о н H+H H a l H + + H a l -2. 2. Приєднання галогеноводнів Електрофільне приєднання НHal здійснюється за правилом Марковнікова, значно повільніше, ніж до олефінів і протікає, в основному, як транс- приєднання : Загальна реакція
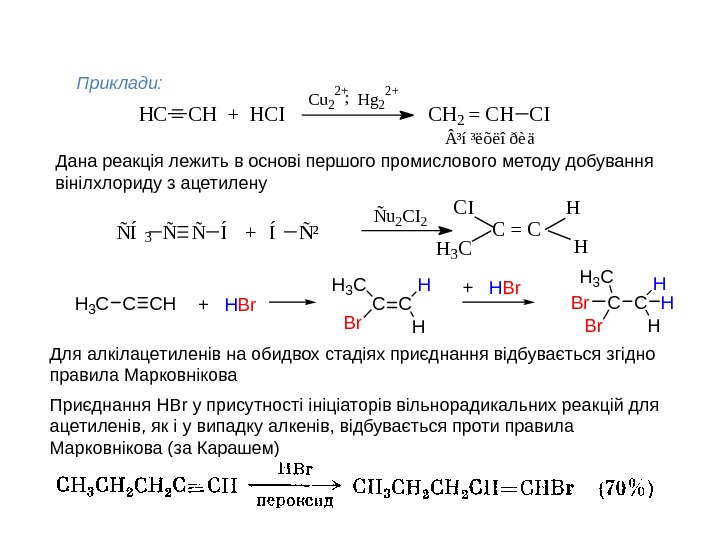
 HH Ñ Í 3 Ñ Ñ Í + Í Ñ ² Ñ u 2 C I H 3 C C = C ³ í ³ ë õ ë î ð è äH C C H + H C I C u 2 2 + H g 2 2 + ; C H 2 = C H C IПриклади: Дана реакція лежить в основі першого промислового методу добування вінілхлориду з ацетилену C HCH 3 C + H B r CCH 3 C B r H H B r H Для алкілацетиленів на обидвох стадіях приєднання відбувається згідно правила Марковнікова Приєднання HBr у присутності ініціаторів вільнорадикальних реакцій для ацетиленів, як і у випадку алкенів, відбувається проти правила Марковнікова (за Карашем)
HH Ñ Í 3 Ñ Ñ Í + Í Ñ ² Ñ u 2 C I H 3 C C = C ³ í ³ ë õ ë î ð è äH C C H + H C I C u 2 2 + H g 2 2 + ; C H 2 = C H C IПриклади: Дана реакція лежить в основі першого промислового методу добування вінілхлориду з ацетилену C HCH 3 C + H B r CCH 3 C B r H H B r H Для алкілацетиленів на обидвох стадіях приєднання відбувається згідно правила Марковнікова Приєднання HBr у присутності ініціаторів вільнорадикальних реакцій для ацетиленів, як і у випадку алкенів, відбувається проти правила Марковнікова (за Карашем)
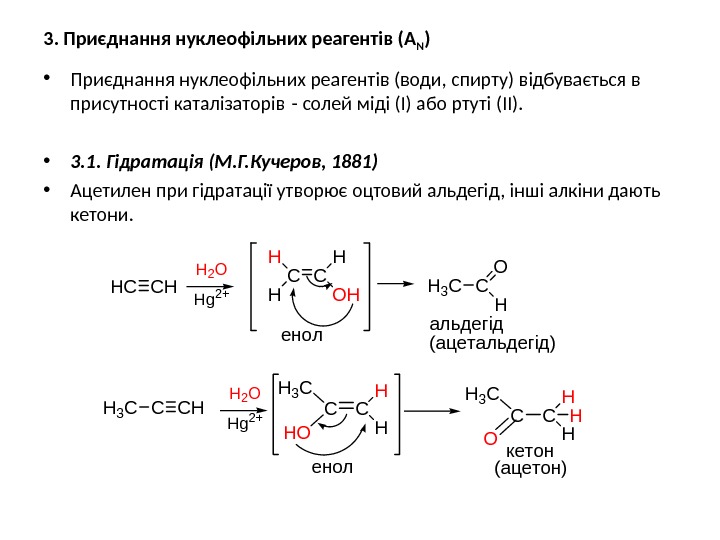
 3. Приєднання нуклеофільних реагентів (А N ) • Приєднання нуклеофільних реагентів (води, спирту) відбувається в присутності каталізаторів — солей міді (І) або ртуті (ІІ). • 3. 1. Гідратація (М. Г. Кучеров, 1881) • Ацетилен при гідратації утворює оцтовий альдегід, інші алкіни дають кетони. CC CHC H 2 O CCH 3 C HO H H CC H 3 C O H H H енол кетон Hg 2+ (ацетон) CHHC H 2 O Hg 2+ H H H OH O H альдегід (ацетальдегід)енол
3. Приєднання нуклеофільних реагентів (А N ) • Приєднання нуклеофільних реагентів (води, спирту) відбувається в присутності каталізаторів — солей міді (І) або ртуті (ІІ). • 3. 1. Гідратація (М. Г. Кучеров, 1881) • Ацетилен при гідратації утворює оцтовий альдегід, інші алкіни дають кетони. CC CHC H 2 O CCH 3 C HO H H CC H 3 C O H H H енол кетон Hg 2+ (ацетон) CHHC H 2 O Hg 2+ H H H OH O H альдегід (ацетальдегід)енол
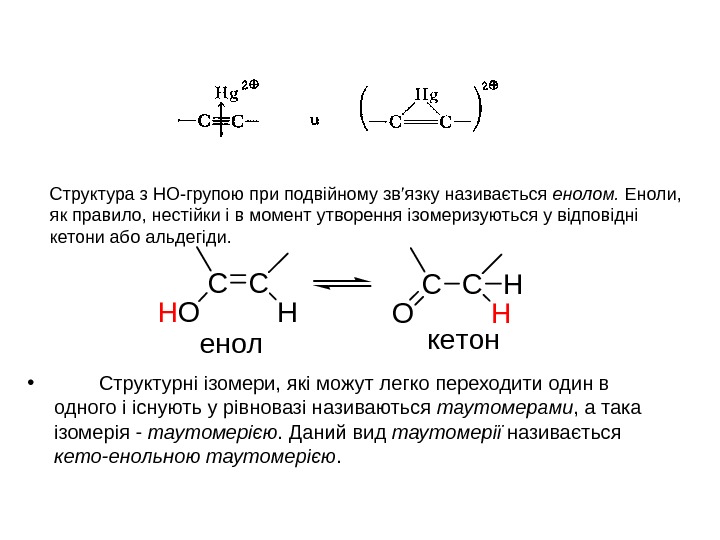
 Структура з НО-групою при подвійному зв’язку називається енолом. Еноли, як правило, нестійки і в момент утворення ізомеризуються у відповідні кетони або альдегіди. • Структурні ізомери, які можут легко переходити один в одного і існують у рівновазі називаються таутомерами , а така ізомерія — таутомерією. Даний вид таутомерії називається кето-енольною таутомерією. CC HOH CC OH H енолкетон
Структура з НО-групою при подвійному зв’язку називається енолом. Еноли, як правило, нестійки і в момент утворення ізомеризуються у відповідні кетони або альдегіди. • Структурні ізомери, які можут легко переходити один в одного і існують у рівновазі називаються таутомерами , а така ізомерія — таутомерією. Даний вид таутомерії називається кето-енольною таутомерією. CC HOH CC OH H енолкетон



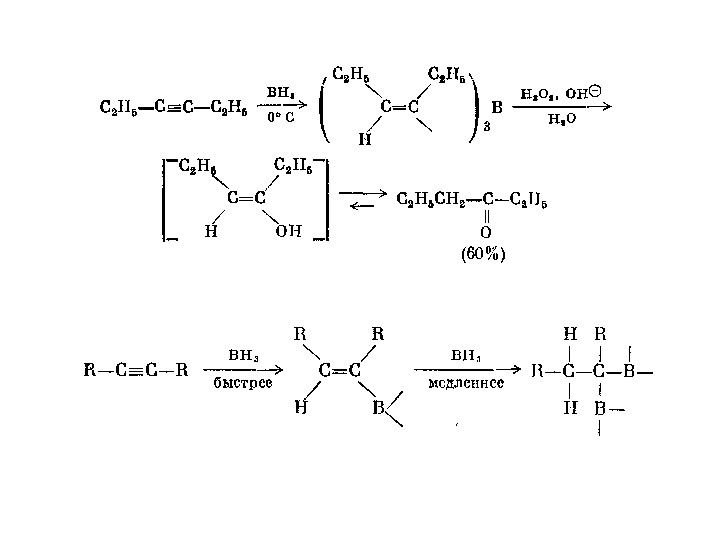
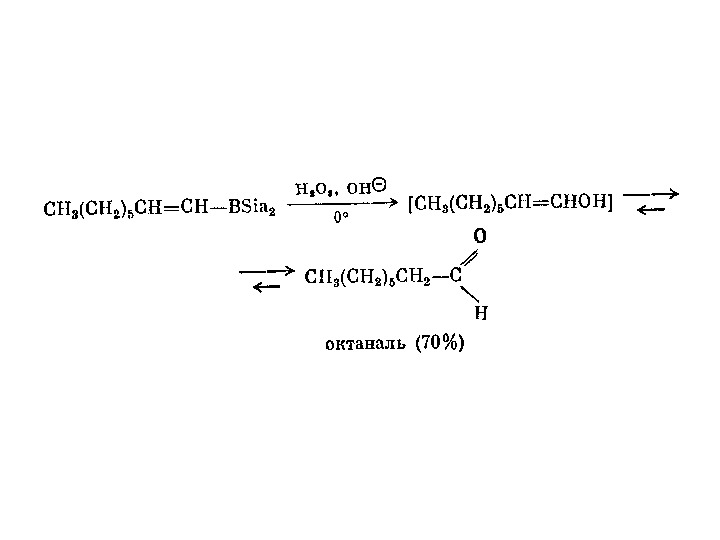
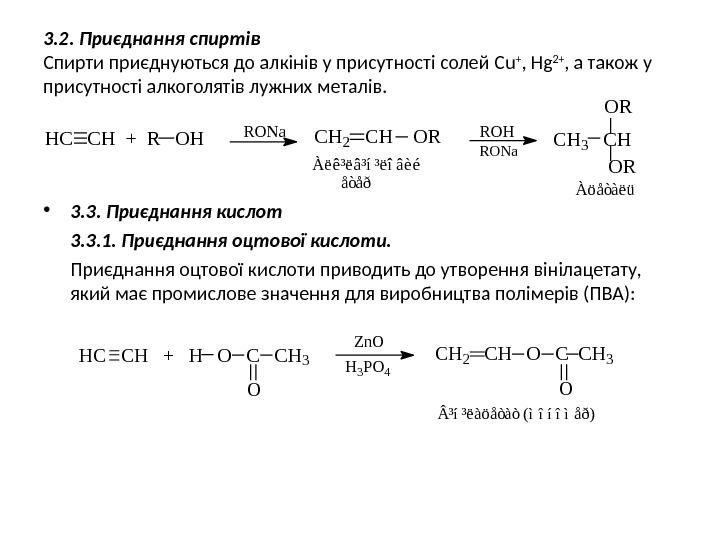
 3. 2. Приєднання спиртів Спирти приєднуються до алкінів у присутності солей С u + , Hg 2+ , а також у присутності алкоголятів лужних металів. • 3. 3. Приєднання кислот 3. 3. 1. Приєднання оцтової кислоти приводить до утворення вінілацетату, який має промислове значення для виробництва полімерів (ПВА): H C C H + R O H R O N a C H 2 C H O R R O H R O N a C H 3 C HO R å ò å ð À ö å ò à ë üÀ ë ê ³ ë â ³ í ³ ë î â è é H C C H + H O C C H 3 OZ n O H 3 P O 4 C H 2 C H O C C H 3 O ³ í ³ ë à ö å ò à ò ( ì î í î ì å ð )
3. 2. Приєднання спиртів Спирти приєднуються до алкінів у присутності солей С u + , Hg 2+ , а також у присутності алкоголятів лужних металів. • 3. 3. Приєднання кислот 3. 3. 1. Приєднання оцтової кислоти приводить до утворення вінілацетату, який має промислове значення для виробництва полімерів (ПВА): H C C H + R O H R O N a C H 2 C H O R R O H R O N a C H 3 C HO R å ò å ð À ö å ò à ë üÀ ë ê ³ ë â ³ í ³ ë î â è é H C C H + H O C C H 3 OZ n O H 3 P O 4 C H 2 C H O C C H 3 O ³ í ³ ë à ö å ò à ò ( ì î í î ì å ð )
 3. 3. 2. Приєднання ціанідної кислоти У результаті реакції утворюється мономер — акрилонітрил (нітрил акрилової кислоти), який широко застосовується для синтезу полімерів та каучуків: • Реакції 2. 2, 3. 2 і 3. 3 називаються реакціями вінілування ― утворення вінільних мономерів, які в свою чергу можуть полімеризуватись з утворенням полімерних матеріалів. H C C H H 2 C C H C NCu(CN)
3. 3. 2. Приєднання ціанідної кислоти У результаті реакції утворюється мономер — акрилонітрил (нітрил акрилової кислоти), який широко застосовується для синтезу полімерів та каучуків: • Реакції 2. 2, 3. 2 і 3. 3 називаються реакціями вінілування ― утворення вінільних мономерів, які в свою чергу можуть полімеризуватись з утворенням полімерних матеріалів. H C C H H 2 C C H C NCu(CN)
 4. Карбонілування алкінів (В. Реппе, 1944 -1949). Карбонілування – це введення карбонільної групи. У присутності нікелевих каталізаторів типу Ni ( CO ) 4 , алкіни взаємодіють з оксидом вуглецю (ІІ) і водню з утворенням ненасичених кислот або їх похідних: • Якщо замість води взяти спирт, то утворюється естер акрилової кислоти. Такі естери є цінними мономерами для одержання прозорих пластиків. À ê ð è ë î â à ê è ñ ë î ò àHC CH + CO + H 2 O N i ( C O ) 4 , P , t o. CH 2 = CH C ÎÍ Î H C C H + C O + Ñ H 3 O H C H 2 = C H C Î Ñ Í 3Î Ì å ò è ë à ê ð è ë à ò
4. Карбонілування алкінів (В. Реппе, 1944 -1949). Карбонілування – це введення карбонільної групи. У присутності нікелевих каталізаторів типу Ni ( CO ) 4 , алкіни взаємодіють з оксидом вуглецю (ІІ) і водню з утворенням ненасичених кислот або їх похідних: • Якщо замість води взяти спирт, то утворюється естер акрилової кислоти. Такі естери є цінними мономерами для одержання прозорих пластиків. À ê ð è ë î â à ê è ñ ë î ò àHC CH + CO + H 2 O N i ( C O ) 4 , P , t o. CH 2 = CH C ÎÍ Î H C C H + C O + Ñ H 3 O H C H 2 = C H C Î Ñ Í 3Î Ì å ò è ë à ê ð è ë à ò
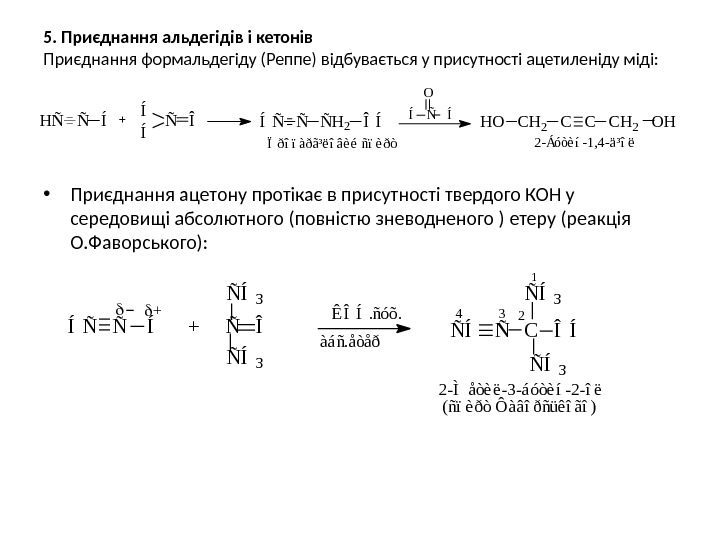
 5. Приєднання альдегідів і кетонів Приєднання формальдегіду (Реппе) відбувається у присутності ацетиленіду міді: • Приєднання ацетону протікає в присутності твердого КОН у середовищі абсолютного (повністю зневодненого ) етеру (реакція О. Фаворського): O Ï ð î ï à ð ã ³ ë î â è é ñ ï è ð ò 2 — Á ó ò è í — 1 , 4 — ä ³ î ëÑ ÎÍ H O C H 2 C C C H 2 O H Í Í Ñ Í Í Ñ Ñ Ñ H 2 Î ÍH Ñ Í Ñ Ñ Í + Ñ Î Ñ Í Ñ C Î ÍÑ Í 3Ñ Í 3 Ê Î Í. ñ ó õ. à á ñ. å ò å ð 1 234 2 — Ì å ò è ë — 3 — á ó ò è í — 2 — î ë ( ñ ï è ð ò Ô à â î ð ñ ü ê î ã î )
5. Приєднання альдегідів і кетонів Приєднання формальдегіду (Реппе) відбувається у присутності ацетиленіду міді: • Приєднання ацетону протікає в присутності твердого КОН у середовищі абсолютного (повністю зневодненого ) етеру (реакція О. Фаворського): O Ï ð î ï à ð ã ³ ë î â è é ñ ï è ð ò 2 — Á ó ò è í — 1 , 4 — ä ³ î ëÑ ÎÍ H O C H 2 C C C H 2 O H Í Í Ñ Í Í Ñ Ñ Ñ H 2 Î ÍH Ñ Í Ñ Ñ Í + Ñ Î Ñ Í Ñ C Î ÍÑ Í 3Ñ Í 3 Ê Î Í. ñ ó õ. à á ñ. å ò å ð 1 234 2 — Ì å ò è ë — 3 — á ó ò è í — 2 — î ë ( ñ ï è ð ò Ô à â î ð ñ ü ê î ã î )
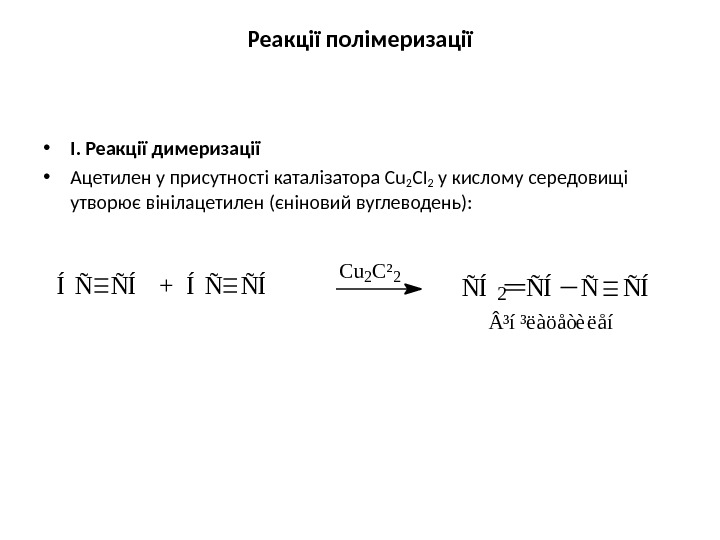
 Реакції полімеризації • І. Реакції димеризації • Ацетилен у присутності каталізатора Сu 2 СІ 2 у кислому середовищі утворює вінілацетилен (єніновий вуглеводень): Í Ñ Ñ Í + Í Ñ Ñ Í C u 2 C ² 2 Ñ Í 2 Ñ Í ³ í ³ ë à ö å ò è ë å í
Реакції полімеризації • І. Реакції димеризації • Ацетилен у присутності каталізатора Сu 2 СІ 2 у кислому середовищі утворює вінілацетилен (єніновий вуглеводень): Í Ñ Ñ Í + Í Ñ Ñ Í C u 2 C ² 2 Ñ Í 2 Ñ Í ³ í ³ ë à ö å ò è ë å í
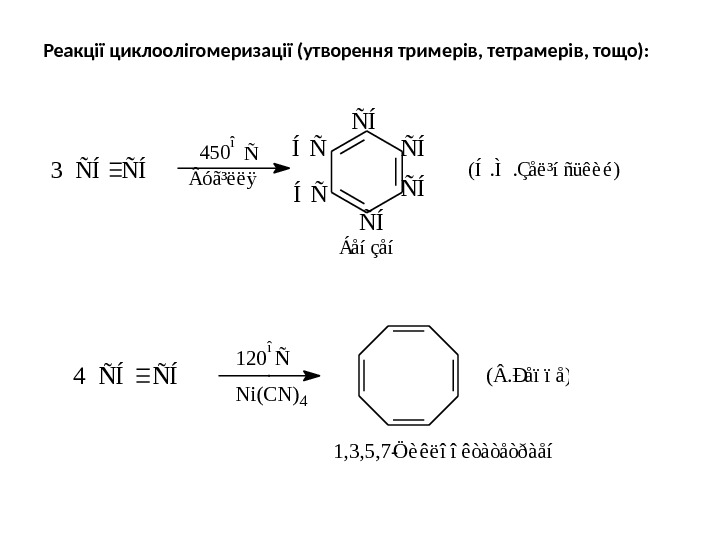
 Реакції циклоолігомеризації (утворення тримерів, тетрамерів, тощо): N i ( C N ) 41 2 0 î Ñ 4 Ñ Í Ö è ê ë î î ê ò à ò å ò ð à å í 1 , 3 , 5 , 7 — ( . Ð å ï ï å ) Ñ ÍÑ Í Ñ ÍÍ Ñ Á å í ç å íÑ 4 5 0 î ó ã ³ ë ë ÿ 3 Ñ Í ( Í. Ì. Ç å ë ³ í ñ ü ê è é )
Реакції циклоолігомеризації (утворення тримерів, тетрамерів, тощо): N i ( C N ) 41 2 0 î Ñ 4 Ñ Í Ö è ê ë î î ê ò à ò å ò ð à å í 1 , 3 , 5 , 7 — ( . Ð å ï ï å ) Ñ ÍÑ Í Ñ ÍÍ Ñ Á å í ç å íÑ 4 5 0 î ó ã ³ ë ë ÿ 3 Ñ Í ( Í. Ì. Ç å ë ³ í ñ ü ê è é )
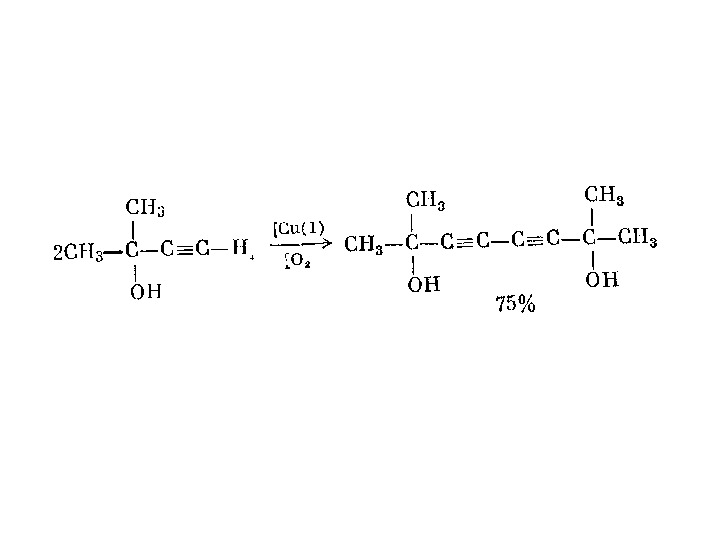
 3. Полімеризація • У присутності ініціаторів або металоорганічних каталізаторів утворюються спряжені полієни (від грецького поліс — багато). Макромолекула (від грецького макрос — великий) полієну складається практично тільки з вуглецевих атомів, з’єднаних між собою спряже-ними подвійними зв’язками: • Ацетилен полімеризується також у присутності солей С u + та окиснювача: • Вважають, що карбін є третьою алотропною видозміною вуглецю разом з алмазом та графітом. Причому, карбіну приписують ще і кумуленову будову макромолекули . . . С=С=С. . . n n ( Ñ Í ) Ñ Í Ê à ò. H Ê à ð á ³ íÑ Ñ ÍC u + [ O ] n Ñ Í n
3. Полімеризація • У присутності ініціаторів або металоорганічних каталізаторів утворюються спряжені полієни (від грецького поліс — багато). Макромолекула (від грецького макрос — великий) полієну складається практично тільки з вуглецевих атомів, з’єднаних між собою спряже-ними подвійними зв’язками: • Ацетилен полімеризується також у присутності солей С u + та окиснювача: • Вважають, що карбін є третьою алотропною видозміною вуглецю разом з алмазом та графітом. Причому, карбіну приписують ще і кумуленову будову макромолекули . . . С=С=С. . . n n ( Ñ Í ) Ñ Í Ê à ò. H Ê à ð á ³ íÑ Ñ ÍC u + [ O ] n Ñ Í n

 Ізомеризація алкінів Заміщення гідрогену галогенами. CHCH 3 C+ HOBr. CH 3 C+ H 2 O CHCH 2 CH 3 C RONa CH 3 CCH 2 CH 3 C KNH 2 CH 2 CH 3 C RONa Na. NH
Ізомеризація алкінів Заміщення гідрогену галогенами. CHCH 3 C+ HOBr. CH 3 C+ H 2 O CHCH 2 CH 3 C RONa CH 3 CCH 2 CH 3 C KNH 2 CH 2 CH 3 C RONa Na. NH
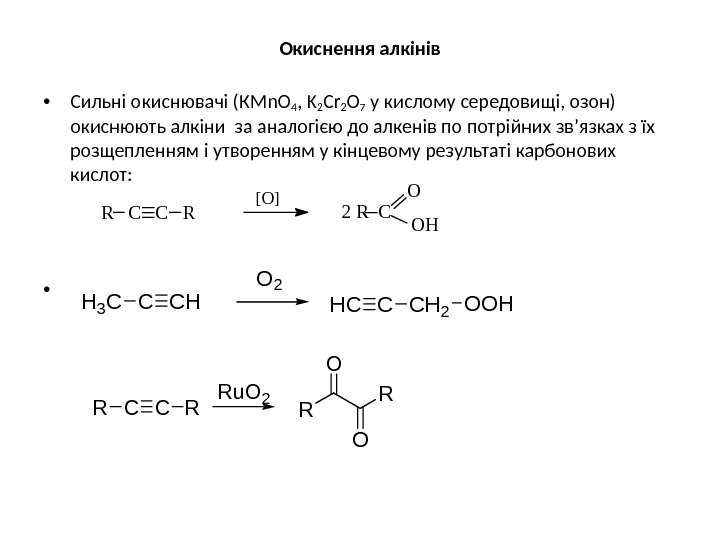
 Окиснення алкінів • Сильні окиснювачі (К Mn. O 4 , K 2 Cr 2 O 7 у кислому середовищі, озон) окиснюють алкіни за аналогією до алкенів по потрійних зв’язках з їх розщепленням і утворенням у кінцевому результаті карбонових кислот: • R C C R [ O ] 2 R C O O HCHCH 3 CHCCCH 2 OOH CCRRR R O O Ru. O
Окиснення алкінів • Сильні окиснювачі (К Mn. O 4 , K 2 Cr 2 O 7 у кислому середовищі, озон) окиснюють алкіни за аналогією до алкенів по потрійних зв’язках з їх розщепленням і утворенням у кінцевому результаті карбонових кислот: • R C C R [ O ] 2 R C O O HCHCH 3 CHCCCH 2 OOH CCRRR R O O Ru. O
