§ 11. Распределение молекул газа по скоростям



















mfit.4-5.ppt
- Размер: 763.5 Кб
- Автор:
- Количество слайдов: 25
Описание презентации § 11. Распределение молекул газа по скоростям по слайдам
 § 11. Распределение молекул газа по скоростям (Распределение Максвелла) Молекулы газа движутся с разными скоростями, причем как величина, так и направление скорости каждой отдельно взятой молекулы непрерывно меняются из-за соударений. Так как все направления движения равновероятны, распределение молекул по направлениям также будет равновероятным. Возможные же значения скоростей v , заключенные в пределах от 0 до ∞ неравновероятны.
§ 11. Распределение молекул газа по скоростям (Распределение Максвелла) Молекулы газа движутся с разными скоростями, причем как величина, так и направление скорости каждой отдельно взятой молекулы непрерывно меняются из-за соударений. Так как все направления движения равновероятны, распределение молекул по направлениям также будет равновероятным. Возможные же значения скоростей v , заключенные в пределах от 0 до ∞ неравновероятны.
 Если какая-то молекула в ряде случаев (последовательных соударений) будет только получать энергию от партнеров – ее скорость будет > v. Если все молекулы отдадут энергию этой молекуле, то ее скорость будет велика, но конечна. Вероятность таких событий ничтожна. Скорости молекул группируются в основном вблизи некоторого наиболее вероятного значения. v Nv v N NN v vfv 1)( )( Определим «плотность» скоростей как отношение числа молекул Δ N v , характеризующихся скоростями в интервале Δ v к величине этого интервала: Очевидно, что ρ зависит от полного количества молекул. Одинаковым для различных объемов газа будет отношение
Если какая-то молекула в ряде случаев (последовательных соударений) будет только получать энергию от партнеров – ее скорость будет > v. Если все молекулы отдадут энергию этой молекуле, то ее скорость будет велика, но конечна. Вероятность таких событий ничтожна. Скорости молекул группируются в основном вблизи некоторого наиболее вероятного значения. v Nv v N NN v vfv 1)( )( Определим «плотность» скоростей как отношение числа молекул Δ N v , характеризующихся скоростями в интервале Δ v к величине этого интервала: Очевидно, что ρ зависит от полного количества молекул. Одинаковым для различных объемов газа будет отношение
 Определенная таким образом функция f ( v ) характеризует распределение молекул газа по скоростям и называется функцией распределения. Зная вид f ( v ) можно найти Δ N v , то есть количество молекул, характеризующихся скоростями, лежащими в интервале от v до v +Δ v : vv. Nf. Nv)( vv. Nf N Nv )( iivvv. Nf. N)( Отношение дает вероятность того, что скорость молекулы будет иметь значение в пределах данного интервала. Сумма взятая по всем интервалам Δ i , на которые можно разбить ось v , должна очевидно равняться полному числу молекул N.
Определенная таким образом функция f ( v ) характеризует распределение молекул газа по скоростям и называется функцией распределения. Зная вид f ( v ) можно найти Δ N v , то есть количество молекул, характеризующихся скоростями, лежащими в интервале от v до v +Δ v : vv. Nf. Nv)( vv. Nf N Nv )( iivvv. Nf. N)( Отношение дает вероятность того, что скорость молекулы будет иметь значение в пределах данного интервала. Сумма взятая по всем интервалам Δ i , на которые можно разбить ось v , должна очевидно равняться полному числу молекул N.
 Nvv. Nfii)(Отсюда вытекает: 1)(iivvf Строго говоря, это условие должно записываться в интегральной форме, т. е. : 1)( 0 dvvf (1) Функция распределения была найдена теоретически Максвеллом и носит его имя. Она имеет следующий вид: где A – множитель не зависящий от v , m – масса молекулы. ( 2 ) 22 2 )(v. Aevfk. T mv
Nvv. Nfii)(Отсюда вытекает: 1)(iivvf Строго говоря, это условие должно записываться в интегральной форме, т. е. : 1)( 0 dvvf (1) Функция распределения была найдена теоретически Максвеллом и носит его имя. Она имеет следующий вид: где A – множитель не зависящий от v , m – масса молекулы. ( 2 ) 22 2 )(v. Aevfk. T mv
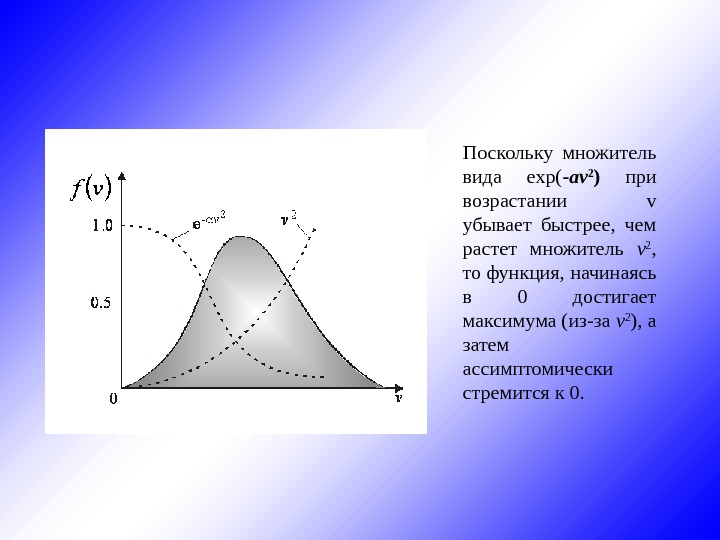
 Поскольку множитель вида exp( — av 2 ) при возрастании v убывает быстрее, чем растет множитель v 2 , то функция, начинаясь в 0 достигает максимума (из-за v 2 ), а затем ассимптомически стремится к 0.
Поскольку множитель вида exp( — av 2 ) при возрастании v убывает быстрее, чем растет множитель v 2 , то функция, начинаясь в 0 достигает максимума (из-за v 2 ), а затем ассимптомически стремится к 0.
 1)( 0 dvvf. Условие (1) : позволяет вычислить множитель А в 22 2 )(v. Aevf k. T mv 1 2 0 2 2 dvve. Ak. T mv Это условие носит название условия нормировки функции, А называется нормировачным множителем.
1)( 0 dvvf. Условие (1) : позволяет вычислить множитель А в 22 2 )(v. Aevf k. T mv 1 2 0 2 2 dvve. Ak. T mv Это условие носит название условия нормировки функции, А называется нормировачным множителем.
 Вычисления дают для А значение Таким образом функция распределения Максвелла имеет вид: ( 3 )222/3 2 ) 2 (4)(ve k. T m vfk. T mv 2/3 ) 2 (4 k. T m
Вычисления дают для А значение Таким образом функция распределения Максвелла имеет вид: ( 3 )222/3 2 ) 2 (4)(ve k. T m vfk. T mv 2/3 ) 2 (4 k. T m
 § 12. Наивероятнейшая, средняя и среднеквадратичная скорости Скорость, отвечающая максимальному значению функции f ( v ) будет очевидно наивероятнейшей. Продифференцировав и прировняв 0, найдем наиболее вероятную скорость v вер. 22 2 )(v. Aevfk. T mv 0)2( )( 2 2 2 k. T mv v. Ae dv vdfk. T mv Скобка обращается в ноль при m k. T vвер 2.
§ 12. Наивероятнейшая, средняя и среднеквадратичная скорости Скорость, отвечающая максимальному значению функции f ( v ) будет очевидно наивероятнейшей. Продифференцировав и прировняв 0, найдем наиболее вероятную скорость v вер. 22 2 )(v. Aevfk. T mv 0)2( )( 2 2 2 k. T mv v. Ae dv vdfk. T mv Скобка обращается в ноль при m k. T vвер 2.
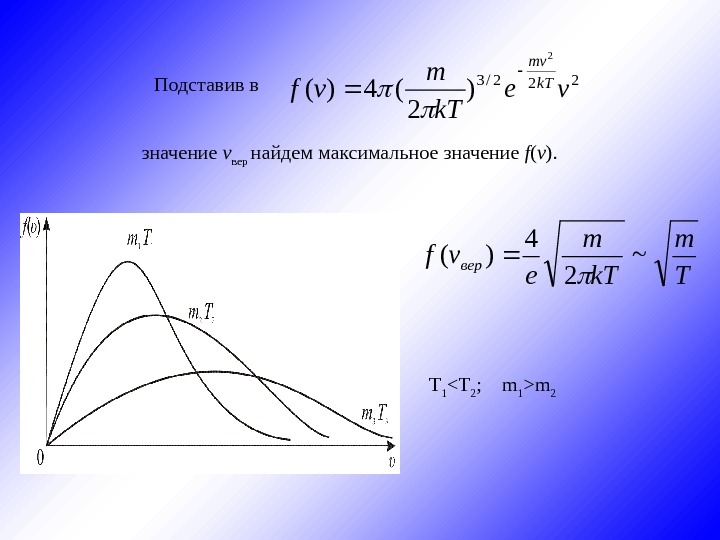
 222/3 2 ) 2 (4)(ve k. T m vfk. T mv T m k. T m e vfвер~ 2 4 )( Подставив в значение v вер найдем максимальное значение f ( v ). T 1 m
222/3 2 ) 2 (4)(ve k. T m vfk. T mv T m k. T m e vfвер~ 2 4 )( Подставив в значение v вер найдем максимальное значение f ( v ). T 1 m
 N Nvivi m k. T vквср 3. . Аналогичным образом находится значение для Необходимо подчеркнуть, что установленный Максвеллом закон распределения молекул по скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесном состоянии. Закон справедлив для любого числа N , если только это число достаточно велико. — средняя скорость молекулы. iiivvfvv)( 0 )(dvvvfv m k. T v 8 2 v
N Nvivi m k. T vквср 3. . Аналогичным образом находится значение для Необходимо подчеркнуть, что установленный Максвеллом закон распределения молекул по скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесном состоянии. Закон справедлив для любого числа N , если только это число достаточно велико. — средняя скорость молекулы. iiivvfvv)( 0 )(dvvvfv m k. T v 8 2 v

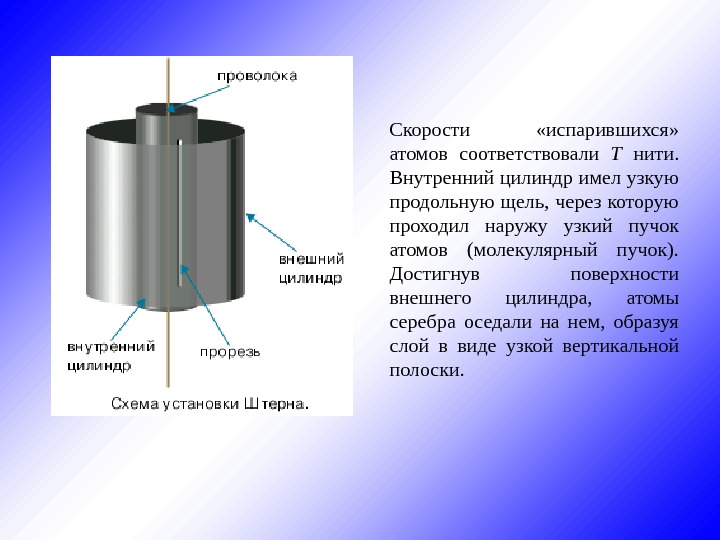
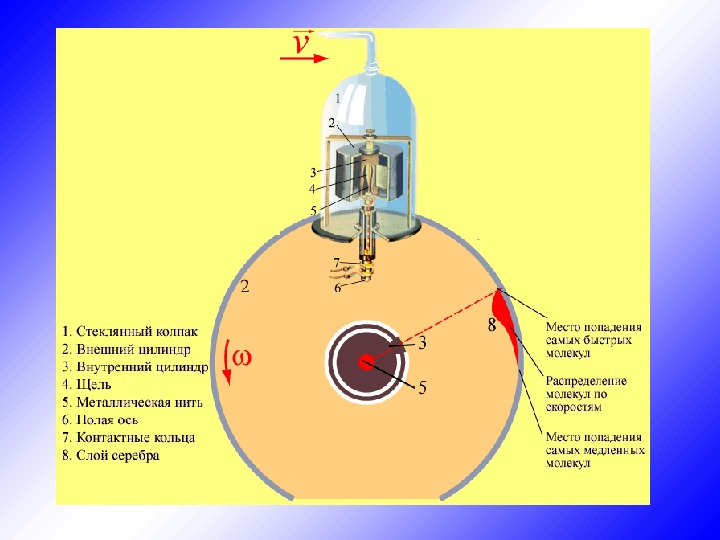
 § 13. Экспериментальная проверка закона распределения Максвелла Первое экспериментальное определение скоростей молекул было осуществлено Штерном в 1920 году. Прибор, использованный для этой цели, состоял из 2 -х коаксиальных цилиндров. По оси прибора была натянута платиновая нить, покрытая серебром. При нагревании нити с ее поверхности испарялись атомы серебра. Скорости «испарившихся» атомов соответствовали T нити. Внутренний цилиндр имел узкую продольную щель, через которую проходил наружу узкий пучок атомов (молекулярный пучок). Достигнув поверхности внешнего цилиндра, атомы серебра оседали на нем, образуя слой в виде узкой вертикальной полоски.
§ 13. Экспериментальная проверка закона распределения Максвелла Первое экспериментальное определение скоростей молекул было осуществлено Штерном в 1920 году. Прибор, использованный для этой цели, состоял из 2 -х коаксиальных цилиндров. По оси прибора была натянута платиновая нить, покрытая серебром. При нагревании нити с ее поверхности испарялись атомы серебра. Скорости «испарившихся» атомов соответствовали T нити. Внутренний цилиндр имел узкую продольную щель, через которую проходил наружу узкий пучок атомов (молекулярный пучок). Достигнув поверхности внешнего цилиндра, атомы серебра оседали на нем, образуя слой в виде узкой вертикальной полоски.
 Скорости «испарившихся» атомов соответствовали T нити. Внутренний цилиндр имел узкую продольную щель, через которую проходил наружу узкий пучок атомов (молекулярный пучок). Достигнув поверхности внешнего цилиндра, атомы серебра оседали на нем, образуя слой в виде узкой вертикальной полоски.
Скорости «испарившихся» атомов соответствовали T нити. Внутренний цилиндр имел узкую продольную щель, через которую проходил наружу узкий пучок атомов (молекулярный пучок). Достигнув поверхности внешнего цилиндра, атомы серебра оседали на нем, образуя слой в виде узкой вертикальной полоски.
 В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проникали движущиеся атомы металла, осаждаясь на внутренней поверхности внешнего цилиндра, образуя хорошо наблюдаемую тонкую полоску прямо напротив прорези.
В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проникали движущиеся атомы металла, осаждаясь на внутренней поверхности внешнего цилиндра, образуя хорошо наблюдаемую тонкую полоску прямо напротив прорези.
 Цилиндры начинали вращать с постоянной угловой скоростью. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол. При вращении цилиндров с постоянной скоростью, положение полоски, образованной атомами на внешнем цилиндре, смещалось на некоторое расстояние.
Цилиндры начинали вращать с постоянной угловой скоростью. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол. При вращении цилиндров с постоянной скоростью, положение полоски, образованной атомами на внешнем цилиндре, смещалось на некоторое расстояние.
 Зная величины радиусов цилиндров, скорость их вращения и величину смещения легко найти скорость движения атомов. Время полета атома t от прорези до стенки внешнего цилиндра можно найти, разделив путь, пройденный атомом и равный разности радиусов цилиндров, на скорость атома v. За это время цилиндры повернулись на угол φ, величину которого найдем, умножив угловую скорость ω на время t. Зная величину угла поворота и радиус внешнего цилиндра R 2 , легко найти величину смещения L и получить выражение, из которого можно выразить скорость движения атома
Зная величины радиусов цилиндров, скорость их вращения и величину смещения легко найти скорость движения атомов. Время полета атома t от прорези до стенки внешнего цилиндра можно найти, разделив путь, пройденный атомом и равный разности радиусов цилиндров, на скорость атома v. За это время цилиндры повернулись на угол φ, величину которого найдем, умножив угловую скорость ω на время t. Зная величину угла поворота и радиус внешнего цилиндра R 2 , легко найти величину смещения L и получить выражение, из которого можно выразить скорость движения атома

 Результаты опытов Штерна подтвердили правильность оценки средней скорости атомов, которая вытекает из распределения Максвелла. Более точно закон распределения был проверен в опыте Ламмерта, в котором молекулярный пучок пропускался через 2 вращающихся диска с радиальными щелями, смещенными друг относительно друга на некоторый угол φ.
Результаты опытов Штерна подтвердили правильность оценки средней скорости атомов, которая вытекает из распределения Максвелла. Более точно закон распределения был проверен в опыте Ламмерта, в котором молекулярный пучок пропускался через 2 вращающихся диска с радиальными щелями, смещенными друг относительно друга на некоторый угол φ.
 Из числа молекул, пролетавших через щель в первом диске, пролетят через второй диск только те, которые подлетят к нему в тот момент, когда на пути пучка встанет прорезь на втором диске. Таким образом, это устройство позволяет выделить из пучка только те молекулы, которые обладают определенной скоростью – Δ v. t 1 = L / v , где t 1 – время полета молекулы между дисками. t 2 = φ / ω , где t 2 – время, за которое диски повернутся на угол φ t 1 = t 2 L / v = φ / ω Следовательно v = Lω / φ Результаты опытов Ламмерта находится в полном согласии с законом распределения Максвелла.
Из числа молекул, пролетавших через щель в первом диске, пролетят через второй диск только те, которые подлетят к нему в тот момент, когда на пути пучка встанет прорезь на втором диске. Таким образом, это устройство позволяет выделить из пучка только те молекулы, которые обладают определенной скоростью – Δ v. t 1 = L / v , где t 1 – время полета молекулы между дисками. t 2 = φ / ω , где t 2 – время, за которое диски повернутся на угол φ t 1 = t 2 L / v = φ / ω Следовательно v = Lω / φ Результаты опытов Ламмерта находится в полном согласии с законом распределения Максвелла.
 § 14. Число соударений и длина свободного пробега молекул Молекулы газа, находясь в тепловом движении, непрерывно сталкиваются друг с другом. Минимальное расстояние, на которое сближаются при столкновении центры 2 -х молекул, называется эффективным диаметром молекулы d. Величина 2 d называется эффективным сечением молекулы ,
§ 14. Число соударений и длина свободного пробега молекул Молекулы газа, находясь в тепловом движении, непрерывно сталкиваются друг с другом. Минимальное расстояние, на которое сближаются при столкновении центры 2 -х молекул, называется эффективным диаметром молекулы d. Величина 2 d называется эффективным сечением молекулы ,
 За время между 2 -мя последовательными столкновениями молекула газа проходит некоторый путь l , который называется длиной свободного пробега. l – случайная величина. Вероятность того, что молекула пролетит без столкновений путь l , определяется формулой: l el )( где λ – средний путь l , проходимый молекулой между двумя последовательными соударениями, называемый средней длиной свободного пробега. За одну секунду молекула проходит в среднем путь, равный средней скорости V ср. Если за секунду она претерпевает z столкновений, то средняя длина свободного пробега будет равна z v ср
За время между 2 -мя последовательными столкновениями молекула газа проходит некоторый путь l , который называется длиной свободного пробега. l – случайная величина. Вероятность того, что молекула пролетит без столкновений путь l , определяется формулой: l el )( где λ – средний путь l , проходимый молекулой между двумя последовательными соударениями, называемый средней длиной свободного пробега. За одну секунду молекула проходит в среднем путь, равный средней скорости V ср. Если за секунду она претерпевает z столкновений, то средняя длина свободного пробега будет равна z v ср
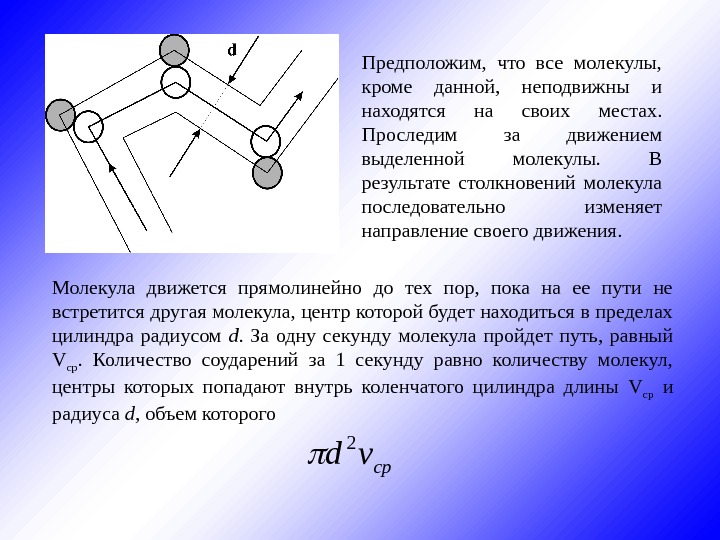
 Предположим, что все молекулы, кроме данной, неподвижны и находятся на своих местах. Проследим за движением выделенной молекулы. В результате столкновений молекула последовательно изменяет направление своего движения. срvd 2 Молекула движется прямолинейно до тех пор, пока на ее пути не встретится другая молекула, центр которой будет находиться в пределах цилиндра радиусом d. За одну секунду молекула пройдет путь, равный V ср. Количество соударений за 1 секунду равно количеству молекул, центры которых попадают внутрь коленчатого цилиндра длины V ср и радиуса d , объем которого
Предположим, что все молекулы, кроме данной, неподвижны и находятся на своих местах. Проследим за движением выделенной молекулы. В результате столкновений молекула последовательно изменяет направление своего движения. срvd 2 Молекула движется прямолинейно до тех пор, пока на ее пути не встретится другая молекула, центр которой будет находиться в пределах цилиндра радиусом d. За одну секунду молекула пройдет путь, равный V ср. Количество соударений за 1 секунду равно количеству молекул, центры которых попадают внутрь коленчатого цилиндра длины V ср и радиуса d , объем которого
 Умножив этот объем на концентрацию молекул, получим число соударений z ’ с неподвижными молекулами: nvdzср 2′ 2 В действительности же все молекулы движутся и, как показывает расчет, средняя скорость относительного движения молекул в раз больше скорости V ср относительно стенок сосуда. Тогда nndnvd v nvdz ср ср ср
Умножив этот объем на концентрацию молекул, получим число соударений z ’ с неподвижными молекулами: nvdzср 2′ 2 В действительности же все молекулы движутся и, как показывает расчет, средняя скорость относительного движения молекул в раз больше скорости V ср относительно стенок сосуда. Тогда nndnvd v nvdz ср ср ср
 Поскольку при Т = const n изменяется пропорционально давлению ( p = nk. T ), то p 1 ~ Эффективный диаметр молекул убывает с ростом температуры (изменяется степень взаимодействия молекул). Поэтому средняя длина свободного пробега с повышением температуры растет. Зависимость λ от Т дается формулой Сёзерленда: СТ Т где С – характерная для каждого газа постоянная величина, имеющая размерность температуры и носящая название постоянной Сёзерленда , а λ∞ — средняя длина свободного пробега при Т = ∞.
Поскольку при Т = const n изменяется пропорционально давлению ( p = nk. T ), то p 1 ~ Эффективный диаметр молекул убывает с ростом температуры (изменяется степень взаимодействия молекул). Поэтому средняя длина свободного пробега с повышением температуры растет. Зависимость λ от Т дается формулой Сёзерленда: СТ Т где С – характерная для каждого газа постоянная величина, имеющая размерность температуры и носящая название постоянной Сёзерленда , а λ∞ — средняя длина свободного пробега при Т = ∞.
 § 15. Экспериментальное определение длины среднего свободного пробега молекулы Для проверки используются молекулярные пучки, подобные тем, которые используются в опыте Штерна. Создается глубокий вакуум, так что молекулы достигают противоположной стенки без промежуточных столкновений. Если ввести в сосуд некоторое количество молекул газа, то траектория частиц, образующих молекулярный пучок будет изменяться в результате соударений с молекулами введенного газа. Это сказывается в появлении налета на боковых экранах. Изменяя давления газа, можно оценить длину среднего свободного пробега и проверить выводы МКТ.
§ 15. Экспериментальное определение длины среднего свободного пробега молекулы Для проверки используются молекулярные пучки, подобные тем, которые используются в опыте Штерна. Создается глубокий вакуум, так что молекулы достигают противоположной стенки без промежуточных столкновений. Если ввести в сосуд некоторое количество молекул газа, то траектория частиц, образующих молекулярный пучок будет изменяться в результате соударений с молекулами введенного газа. Это сказывается в появлении налета на боковых экранах. Изменяя давления газа, можно оценить длину среднего свободного пробега и проверить выводы МКТ.
